Tim-3/galectin-9调控脂多糖诱导的人淋巴细胞中Th1/Th2细胞平衡
孙晓丽,张进进,宋凤英,黄永莉,陈立力,邢颜超*
1.新疆军区总医院 输血科,新疆 乌鲁木齐 830000;2.新疆维吾尔自治区塔城地区裕民县人民医院 检验科,新疆 裕民 834700
脓毒症通常是由多种微生物的感染导致免疫功能失衡和免疫系统的紊乱,最终导致炎性因子和细胞代谢产物的表达,从而影响机体的正常功能[1]。其中T细胞在人体中发挥重要作用。众所周知,T细胞主要分为辅助性T细胞(T helper cell, Th)1型细胞群和2型细胞群。Th1型细胞主要分泌IL-2、IFN-γ等细胞因子,Th2型细胞主要分泌IL-4、IL-5等细胞因子[2]。在脓毒症患者中存在着细胞介导的免疫应答失衡和Th1/Th2细胞群的紊乱[3]。虽然脓毒症患者存在Th1/Th2失衡,但是由何种分子介导的Th1/Th2失衡,目前尚不得知。
T细胞免疫球蛋白黏蛋白分子-3(T cell immunoglobulin and mucin domain containing protein 3, Tim-3)是Tim家族激活诱导的抑制性受体,主要表达在分化成熟的Th1细胞[4]。Tim-3主要分为膜型Tim-3(membrane Tim-3)和可溶性Tim-3(soluble Tim-3)分子。半乳糖凝集素-9(galectin-9)作为Tim-3的配体,与Tim-3特异性结合后,诱导细胞的活化、凋亡等[5-6]。研究表明,Tim-3和galectin-9结合后会引起Th1型细胞功能丧失,Th1相关细胞因子IFN-γ的表达下降,调节Th1型免疫反应和免疫耐受[5]。
JAK是一组细胞内酪氨酸激酶,在膜受体启动的信号转导中发挥重要作用[7]。JAK2/STAT3信号通路控制着对细胞稳态至关重要的多种细胞过程。该轴的改变在癌以及炎性反应中发挥作用[8-9]。因此,本研究主要通过RT-qPCR、ELISA、Western blot以及体外实验等对患者外周血的Tim-3、galectin-9、Th1和Th2相关细胞因子、JAK2/STAT3信号通路的检测与分析,为脓毒症患者靶向药物的研制以及治疗提供有限的理论基础。
1 材料与方法
1.1 材料
1.1.1 一般资料:选取2018年9月至2021年9月新疆军区总医院就诊的102例脓毒症患者,排除血培养为阴性的脓毒症患者、合并恶性肿瘤患者、合并糖尿病等严重代谢性疾病的患者、合并自身免疫性疾病与应用免疫抑制剂的患者、合并过敏性疾病患者、合并器官移植者等。此外, 对照组来自102名健康体检者。本研究所有受试者均知情同意,并通过新疆军区总医院伦理委员会的批准(2023RR0204)。抽取患者及健康对照者空腹静脉血3 mL,3 000 r/min离心10 min,分离患者血清和单个核细胞用于后续实验。
1.1.2 主要试剂:Trizol(Thermo Fisher公司);PrimeScriptTMⅡ 1st Strand cDNA 合成试剂盒(TaKaRa公司);Tim-3 mAb(Biolegend公司);JAK2、 p-JAK2、STAT3、p-STAT3抗体(CST公司);sTim-3、galectin-9、IL-4、IFN-γ、IL-6和TNF-α等ELISA试剂盒(R&D公司)。
1.2 方法
1.2.1 RT-qPCR检测Tim-3、galectin-9、T-bet、GATA-3的mRNA水平:1 mL抗凝血中加入1×红细胞裂解液,室温裂解10 min后,12 000 r/min离心10 min后,弃上清;总RNA的提取按照Trizol试剂的说明书进行。总RNA反转录为第1链DNA后,使用SYBR Prime Script RT-PCR 试剂盒进行荧光定量PCR,根据相对浓度计算法计算Tim-3、galectin-9、T-bet、GATA-3等基因的表达。引物序列见表1。
1.2.2 细胞的分组及处理:分离健康人群中的外周血淋巴细胞, 用含有10%血清的RPMI-1640重悬淋组巴细胞后,加入1×107个淋巴细胞于6孔板中,一加入LPS(0.1 mg/L)(LPS组),体外构建炎性反应模型,另一组加入等量的PBS(PBS组)作为对照组;LPS组与PBS组每孔均加入ConA(10 mg/L),37 ℃中孵育24 h进行体外模拟实验后,加入galectin-9(LPS+galectin-9组);在LPS组中预先加入Tim-3单抗阻断Tim-3的表达后,再加入1.0 mg/L的galectin-9(LPS+galectin-9+Tim-3组)37 ℃孵育12 h,单独加入galectin-9(galectin-9组)和Tim-3 mAb(Tim-3 mAb组),收集细胞和细胞上清后用于后续实验。
1.2.3 MTT检测:1×106/mL细胞于96孔中,分别加入不同浓度的LPS,使其终浓度分别达到10 μg/L、100 μg/L、1 mg/L 和10 mg/L,37 ℃中孵育24 h后,弃上清,加入MTT溶液(5 g/L)继续培养4 h,收集细胞后,每孔加入100 μL的DMSO,10 min后检测每孔的吸光度值。
1.2.4 ELISA检测炎性因子的含量:根据试剂盒中的说明书检测血清和细胞培养上清中sTim-3, galectin-9、IL-4、IFN-γ、IL-6和TNF-α的吸光度值,根据标准曲线计算血清中和细胞培养上清中细胞因子的表达变化。
1.2.5 Western blot检测JAK/STAT通路蛋白的表达:提取上述单个核细胞总蛋白质,蛋白质定量后取30 μg蛋白质进行SDS-PAGE,快速湿转法进行转膜,封闭后孵育JAK2,p-JAK2,STAT3和p-STAT3抗体过夜,再加入碱性磷酸酶(alkaline phosphatase, AP)标记的二抗,室温孵育2 h,以GAPDH为内参,ECL荧光成像系统分析蛋白条带。
1.3 统计学分析
2 结果
2.1 一般数据
本研究共纳入了102例脓毒症患者,其中男性54例,女性48例;共纳入102名健康对照,男性51例,女性51例。其中患者外周血中白细胞(white blood cells, WBC)、中性粒细胞(neutrophils, NEU)、C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)均显著升高(P<0.05或P<0.01);血红蛋白、血小板均降低(P<0.01)(表2)。

表2 脓毒症患者的临床特点Table 2 Clinical characteristics of patients with sepsis
2.2 脓毒症患者外周血中Tim-3/galectin-9的水平
脓毒症患者外周血中Tim-3和galectin-9的mRNA的含量均明显高于对照组(图1A,B)。血清中sTim-3和galectin-9的水平也明显高于对照组(图1C,D)。
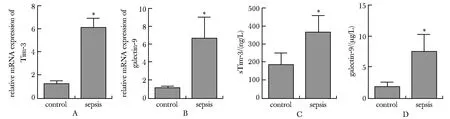
A,B.relative mRNA expression of Tim-3 and galectin-9; C,D.levels of sTim-3 and galectin-9 in serum;*P<0.001 compared with control.图1 外周血Tim-3、galectin-9 mRNA的表达以及血清中sTim-3、galectin-9的水平Fig 1 The mRNA expression of Tim-3 and galectin-9 in peripheral blood and levels of sTim-3 and galectin-9 in n=102)
2.3 脓毒症患者存在Th1/Th2细胞失衡
脓毒症患者Th1相关细胞因子IFN-γ的水平明显低于对照组(图2A),Th2型细胞因子IL-4的水平明显高于对照组(图2B),并且Th1细胞的转录因子T-bet的mRNA表达低于对照组,Th2型细胞的转录因子GATA-3的mRNA表达高于对照组(图2C,D)。
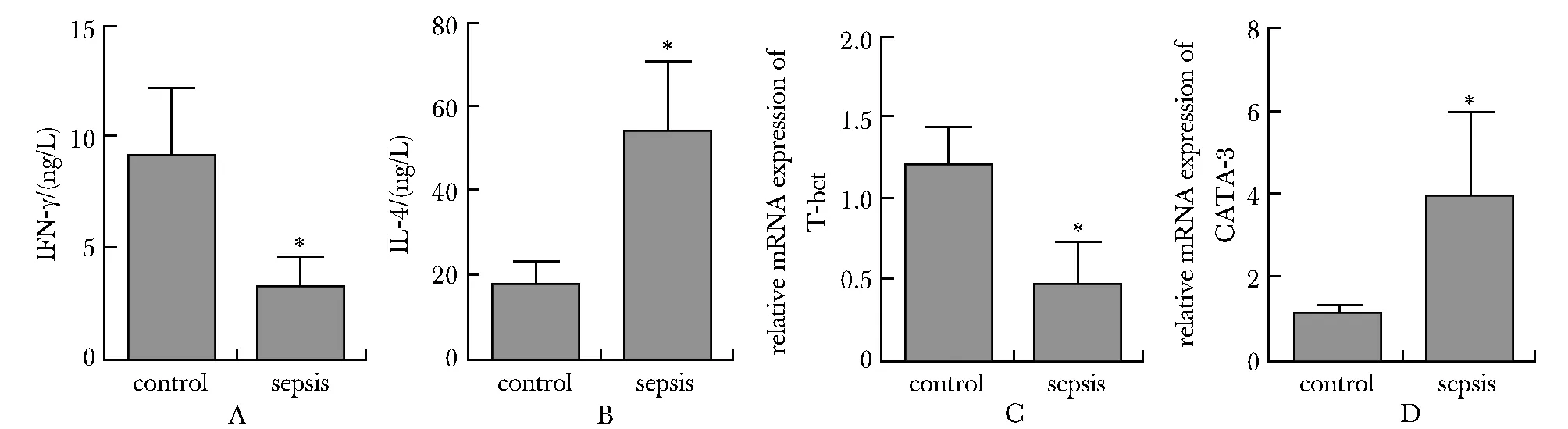
A,B.IFN-γ and IL-4 levels; C,D.relative mRNA expression of T-bet and GATA-3;*P<0.001 compared with control.图2 Th1和Th2细胞相关细胞因子以及转录因子的表达Fig 2 The expression of Th1 and Th2 cell related cytokines and transcription n=102)
2.4 Tim-3/galectin-9分子调节Th1/Th2细胞平衡
与PBS组相比,0.1 mg/L的LPS刺激后 IL-6和TNF-α的水平均明显升高(图3A,B)。与PBS组相比较,LPS组IFN-γ的水平明显高于PBS组,而IL-4的水平明显低于PBS组(图3),LPS+galectin-9组中IFN-γ的表达明显低于LPS组,而IL-4的表达明显高于LPS组,当加入Tim-3 mAb阻断galectin-9与Tim-3的结合,LPS+galectin-9+Tim-3 mAb组中IFN-γ的表达明显高于LPS+galectin-9组,而IL-4的水平明显低于LPS+galectin-9组。galectin-9组和Tim-3 mAb组中,IFN-γ和IL-4的表达没有明显变化。

A,B.the secretion of IL-6 and TNF-α in PBMC with different concentrations LPS; C,D.levels of IFN-γ and IL-4 after using Tim-3 mAb; *P<0.05 compared with PBS group or 0 ng/mL; #P<0.05 compared with LPS group; △P<0.05 compared with LPS+galectin-9 group.图3 细胞培养上清中IL-6、TNF-α、IFN-γ、IL-4的水平Fig 3 The level of IL-6,TNF-α,IFN-γ and IL-4 in cell culture n=102)
2.5 JAK2/STAT3信号通路相关蛋白的表达情况
脓毒症患者外周血中磷酸化的JAK2和STAT3表达均高于对照组(图4A),加入Tim-3单抗后,磷酸化的JAK2和STAT3表达均下降(图4B)。

*P<0.05 compared with control group or PBS group; #P<0.05 compared with LPS group; △P<0.05 compared with LPS+galectin-9 group.图4 JAK2/STAT3信号通路相关蛋白的表达Fig 4 The expression of JAK2/STAT3 signaling pathway associated n=3)
2.6 Tim-3/galectin-9与Th1和Th2细胞相关因子的相关性分析
Tim-3与galectin-9、Tim3与IL-4、IL-4与galectin-9具有明显正相关性(P<0.05),IFN-γ与galectin-9、Tim-3与IFN-γ具有负相关性(P<0.01)(图5)。

图5 Tim-3/galectin-9与Th1和Th2细胞相关因子的相关性分析Fig 5 Correlation analysis of Tim-3/galectin-9 with Th1 and Th2 cell associated factors
3 讨论
脓毒症的主要病理生理过程是机体的促炎性反应和抗炎性反应的失衡,一旦平衡被破坏,疾病往往会加重。T细胞作为细胞免疫应答的重要成分,参与了多种疾病的病理生理过程,尤其是Th1、Th2型细胞。本研究收集了脓毒症患者外周血及血清,分析了血清中IFN-γ和IL-4以及外周血中Th1和Th2细胞相关细胞因子的mRNA表达,发现脓毒症患者体内存在Th1/Th2细胞失衡。但是引起这种失衡的机制目前尚不清楚。
T细胞的活化依赖于共刺激分子。T细胞在接受刺激信号后,发挥相应的免疫应答或免疫抑制作用。Tim-3作为负性共刺激分子,特异性表达于Th1细胞上,负责Th1细胞介导的免疫应答[10]。而galectin-9广泛存在于多种细胞中,属于可溶性糖蛋白之一,主要黏附于细胞膜上,在免疫细胞的动态平衡、炎性反应中发挥作用[11]。Tim-3与其配体galectin-9结合,传递负性刺激信号,确保在过度免疫应答的情况下诱导免疫耐受,实现免疫应答的平衡[12]。 高水平的Tim-3表达与T细胞反应的抑制和T细胞功能障碍相关,并且Tim-3被认为是控制T细胞对各种慢性病毒感染如HBV、HCV等的免疫检查点的受体[21]。本研究发现脓毒症患者Tim-3和galectin-9的mRNA表达明显升高,血清中sTim-3和galectin-9的水平均明显升高,说明了Tim-3/galectin-9信号参与了脓毒症的疾病进程,并且Tim-3的升高可能导致了T淋巴细胞的功能障碍。作为Tim-3的配体,galcetin-9可能与Tim-3结合来调控这一过程。
众所周知,CD4+T细胞主要分为Th1和Th2细胞,Th1细胞主要分泌IFN-γ等细胞因子,Th2细胞主要分泌IL-4等细胞因子。Tim-3与galectin-9结合后,可抑制或下调 Th1 细胞的活化和相关细胞因子IFN-γ的产生,促进免疫抑制[13]。本研究的结果与此相一致,表明Tim-3与 galectin-9结合,抑制了Th1细胞的活化,减少IFN-γ的产生,调节脓毒症炎性过程中淋巴细胞Th1/Th2的平衡。
一些细胞因子如IL-4、IL-6、IL-31等都可以激活JAK2/STAT3通路[14]。因此通过对脓毒症患者外周血单个核细胞JAK2/STAT3信号通路相关因子的分析,发现脓毒症患者外周血中磷酸化的JAK2和STAT3表达均升高,加入Tim-3单抗阻断galectin-9的结合后,磷酸化的JAK2和STAT3表达均下降。这表明galectin-9结合Tim3通过调控JAK2/STAT3信号通路发挥作用。
总之,Tim-3作为一种负性共刺激分子在维持体内免疫系统的平衡中发挥着重要作用。

