经导管动脉化疗栓塞术联合仑伐替尼或多纳非尼靶向治疗中晚期肝癌的效果及安全性对比研究
王闯胜,朱培欣,石佳
平煤神马集团总医院介入放射科,平顶山 467099
目前,肝癌在全球恶性肿瘤发病率中居第6位[1],其具有高隐匿性、发展速度快、高侵袭性和高复发性等特征,导致绝大多数肝癌患者确诊时已处于中晚期阶段,错失了最佳手术时机[2]。据相关研究统计,2020 年全球新发肝癌病例已接近91 万例,且肝癌致死人数已超过83 万例[3-4]。肝癌手术切除率低是影响患者预后的主要影响因素之一,而肝癌术前新辅助治疗或转化治疗可提升手术切除率,改善患者预后。
随着肝癌治疗手段的不断发展和完善,治疗越发注重综合化,致力于把多种有效治疗手段进行综合化,包括手术疗法、消融疗法、介入栓塞疗法、放疗、化疗,以及靶向治疗、免疫疗法、肝移植等[5-6]。靶向药物本身或其载体可瞄准特定的病变部位,并将有效成份释放或蓄积于目标部位。靶向药物可在目标部位形成相对较高的药物浓度,不仅可提高药效,同时可避免全身性不良反应,进而保护正常的组织和细胞[7]。仑伐替尼为多靶点酪氨酸激酶抑制剂,其主要作用机制是抗肿瘤血管生成,降低肿瘤微环境中血管通透性,以达到抑制肿瘤生长的作用[8-9]。相关研究提示[10],仑伐替尼单药治疗晚期肝癌患者疗效较好,可有效抑制肿瘤活性,且安全性高,可作为中晚期肝癌患者的重要治疗手段。此外,近年来多纳非尼也逐渐应用于临床,且效果显著[3,11]。
接受新型靶向药物、免疫药物、抗血管药物等综合治疗方案的肝癌患者客观缓解率(objective response rate,ORR)更高、缓解持续时间(duration of response,DOR)更长,故综合治疗已成为肝癌治疗研究的热点之一。综合治疗如经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)术联合靶向治疗对肝癌具有较好的治疗效果[12-15]。这些联合治疗方案在临床上的应用已成为近期关注点之一。因此,本研究通过给予肝癌患者不同的治疗手段(TACE 联合仑伐替尼靶向治疗及多纳非尼靶向治疗),分析其治疗效果及安全性,以期为临床治疗中晚期肝癌患者提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年1 月~12 月期间于该院就诊并接受治疗的149 例中晚期且不具有手术指征的原发性肝癌患者作为研究对象,采用简单随机抽样方法分为A 组(TACE+仑伐替尼治疗组,n=74)与B 组(TACE+多纳非尼治疗组,n=75)。A 组:男性36 例,女性38 例;年龄40~80 岁,平均年龄(60.54±7.51)岁;病程1 个月~3 年,平均病程(25.21±6.57)个月。B 组:男性38 例,女性37 例;年龄41~79 岁,平均年龄(62.51±5.39)岁;病程2 个月~3 年,平均病程(26.54±6.94)个月。两组患者一般资料比较无统计学差异(P<0.05),具有可比性(表1)。本研究经医院伦理委员会批准通过,所有患者知情同意并签署同意书。
表1 两组一般资料比较 ±s,n(%)
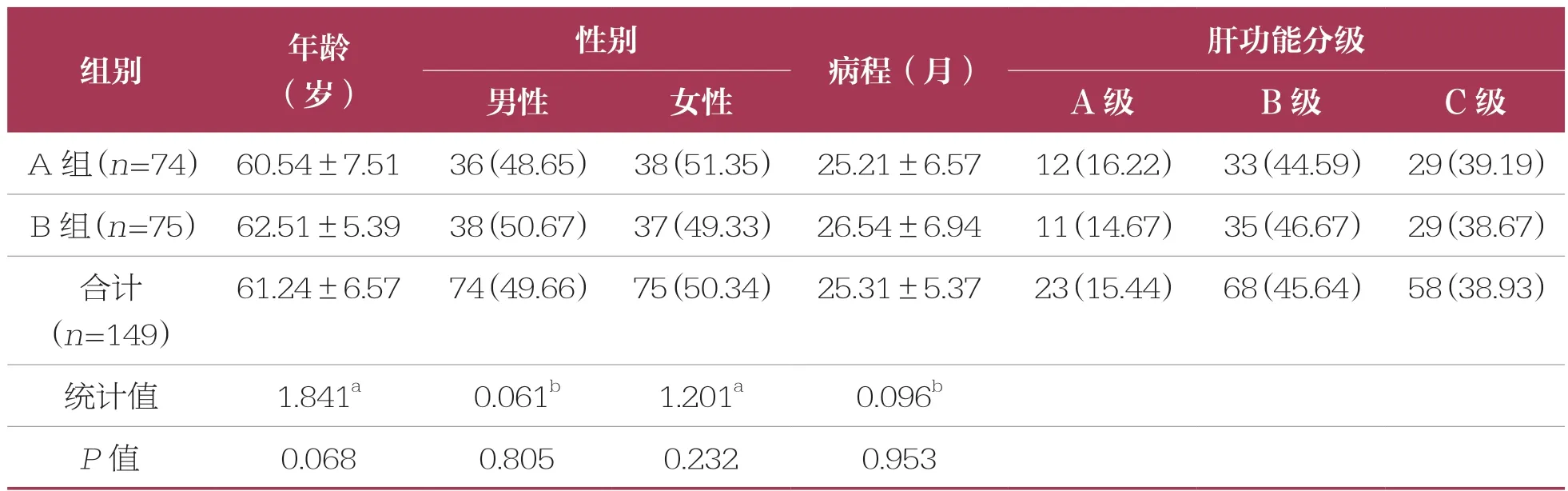
表1 两组一般资料比较 ±s,n(%)
a:t 值;b:χ2 值
组别年龄(岁)性别病程(月)肝功能分级男性女性A 级B 级C 级A 组(n=74) 60.54±7.5136(48.65) 38(51.35) 25.21±6.5712(16.22) 33(44.59) 29(39.19)B 组(n=75) 62.51±5.3938(50.67) 37(49.33) 26.54±6.9411(14.67) 35(46.67) 29(38.67)合计(n=149)61.24±6.5774(49.66) 75(50.34) 25.31±5.3723(15.44) 68(45.64) 58(38.93)统计值1.841a0.061b1.201a0.096b P 值0.0680.8050.2320.953
纳入标准:①年龄≥18 岁且<85 岁者。②符合《原发性肝癌诊疗指南》(2022 年版)[8]相关诊断标准,并确诊为中晚期原发性肝癌者。③不具有手术指征并愿意接受TACE 联合靶向治疗者。④病历数据完善者。⑤能够配合研究和进行随访者。
排除标准:①病理诊断不明确者。②具有手术指征并意向接受手术治疗者。
1.2 治疗方法
A 组:通过多期增强计算机断层扫描(computer tomography,CT)获取患者肝内肿瘤病灶的动静脉走向及血管灌注信息,基于肿瘤血管来源及直径选择相应的造影导管。采用Seldinger 法对右侧股动脉进行穿刺,建立股动脉通道并将导管送至腹腔干动脉和肠系膜上,到达肿瘤供血动脉。通过数字减影血管造影评估肿瘤大小和供血血管情况,评估符合介入治疗指征后行介入治疗,最后于肝动脉通过导管灌注化疗药物。具体方案:注射用奥沙利铂[齐鲁制药(海南)有限公司,国药准字H20093167,规格50mg]100~150mg+氟尿嘧啶注射液[上海旭东海普药业有限公司,国药准字H31020593,规格10ml∶0.25g]500~1250mg;微导管进一步超选入肿瘤供血动脉分支内,造影明确后,用碘化油乳剂栓塞肿瘤血管床。碘化油乳剂为以下药物混合物:盐酸表柔比星注射液(浙江海正药业股份有限公司,国药准字H20041211,规格5ml∶10mg)20~60mg+罂粟乙碘油注射液 [江苏恒瑞医药股份有限公司,国药准字H20163348,规格:10ml(含碘(I)480mg/ml)]5~30ml。TACE 术后,遵从医嘱进行抗炎保肝、对症支持治疗。每次间隔时间不少于4 周。TACE 治疗后第4 天,给予患者甲磺酸仑伐替尼胶囊[Eisai Co., Ltd.,国药准字HJ20200045,规格10mg(按C21H19ClN4O4计算)]口服治疗,若患者体重<60kg,每次8mg,qd;若患者体重≥60kg,每次12mg,qd。剂量调整由个体耐受情况决定,30 天为1 个疗程,共治疗3 个疗程。
B 组:TACE 治疗方法同仑伐替尼联合治疗组,于TACE 治疗后第4 天给予患者甲苯磺酸多纳非尼片[苏州泽璟生物制药股份有限公司,国药准字H20210020,规格:0.1g(按C21H13D3ClF3N4O3计)]口服治疗,每次0.2g,bid,30 天为1 个疗程,共治疗3 个疗程。
1.3 观察指标
(1)肿瘤血管因子及肿瘤标志物。分别于治疗前后采集患者空腹静脉血5ml,采用TD-4M 离心机(济南鑫宇鑫医疗设备有限公司,r=10cm),3000r/min(21 ℃)离心15min,取上清液。采用酶联免疫吸附试验测定两组患者血清血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)、甲胎蛋白(alpha fetoprotein,AFP)以及高尔基体蛋白73(Golgi protein 73,GP73)的表达水平,相关试剂盒购自上海酶联生物科技有限公司。
表2 两组血清肿瘤血管因子、肿瘤标志物水平比较 ±s
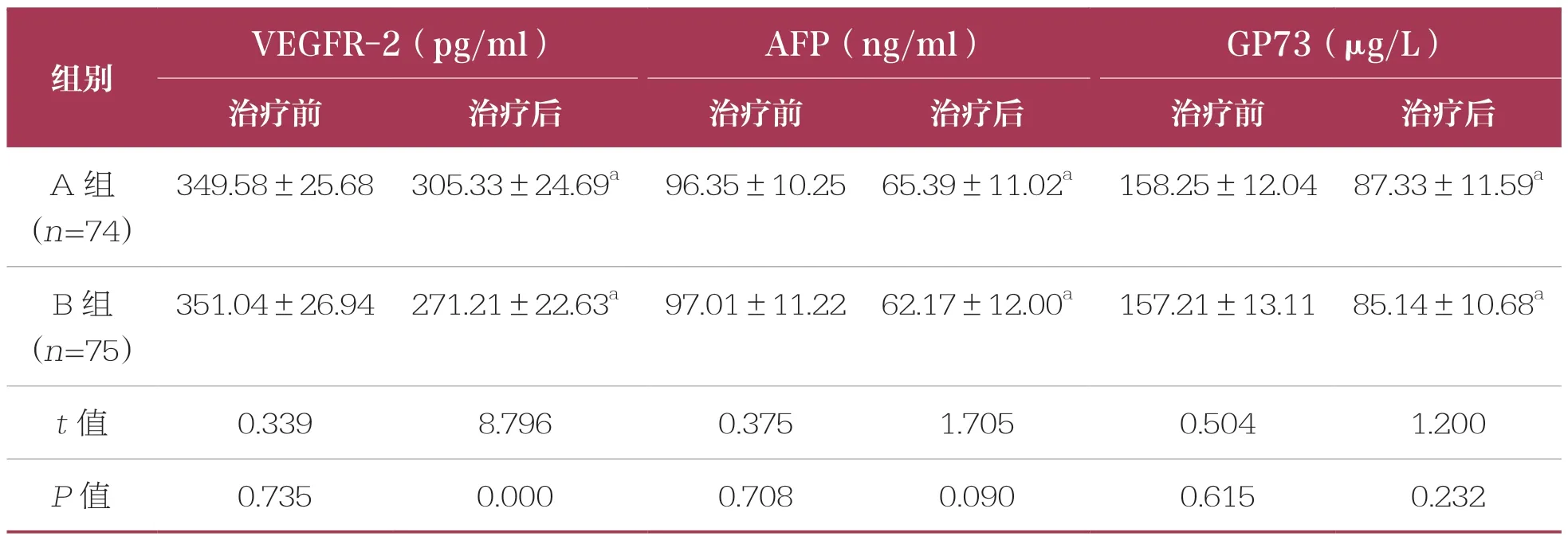
表2 两组血清肿瘤血管因子、肿瘤标志物水平比较 ±s
VEGFR-2:血管内皮生长因子受体-2;AFP:甲胎蛋白;GP73:高尔基体蛋白73;与同组治疗前比较,a:P<0.05。下同
VEGFR-2(pg/ml)AFP(ng/ml)GP73(μg/L)治疗前治疗后治疗前治疗后治疗前治疗后A 组(n=74)组别349.58±25.68 305.33±24.69a 96.35±10.25 65.39±11.02a 158.25±12.04 87.33±11.59a B 组(n=75)351.04±26.94 271.21±22.63a 97.01±11.22 62.17±12.00a 157.21±13.11 85.14±10.68a t 值0.3398.7960.3751.7050.5041.200 P 值0.7350.0000.7080.0900.6150.232
(2)肝功能指标。分别于治疗前后采集患者静脉血5ml,采用TD-4M 离心机(济南鑫宇鑫医疗设备有限公司,r=10cm),3000r/min(21℃)离心15min,取上清液。采用试剂盒检测并记录两组患者谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)水平,试剂盒购自上海酶联生物科技有限公司。
(3)临床疗效。治疗3 个月后,根据《原发性肝癌诊疗指南》(2022 年版)[8]评估两组患者临床疗效:①完全缓解(complete response,CR):多期增强CT 检查结果显示,肿瘤病灶供血均消失。②部分缓解(partial response,PR):CT 检查结果显示肿瘤病灶缩小≥30%。③疾病稳定(stable disease,SD):CT 检查结果显示,肿瘤病灶缩小<30%或增大<20%。④疾病进展(progressive disease,PD):CT 检查结果显示,出现新病灶或肿瘤病灶增大≥20%。疾病控制率(disease control rate,DCR,%)=(CR +PR +SD)病例数/每组总病例数×100%;客观缓解率(objective response rate,ORR,%)=(CR +PR)病例数/每组总病例数×100%。
(4)不良反应发生情况。对比两组患者治疗后不良反应的发生情况,评估治疗方案的安全性。不良反应主要包括高血压、胃肠道反应、肾功能不全、手足综合征、肝毒性、疲劳等。
1.4 统计学方法
应用SPSS 25.0 软件进行数据整理和分析。符合正态分布或者近似正态分布的计量资料以±s 表示,行t检验;非正态分布的计量资料以中位数(M)及四分位间距(IQR)表示,行秩和检验。计数资料以n(%)表示,行χ2检验。P<0.05 为具有统计学差异。
2 结果
2.1 肿瘤血管因子及肿瘤标志物
治疗前,两组患者血清肿瘤血管因子VEGFR-2、肿瘤标志物AFP、GP73 水平比较均无统计学差异(P>0.05)。治疗后,两组患者VEGFR-2 水平降低(P<0.05),且B 组低于A 组(P<0.05);两组AFP和GP73 水平均降低(P<0.05),但两组比较无统计学差异(P>0.05)(表2)。
2.2 肝功能指标
治疗前,两组患者ALT、AST 和LDH 等肝功能指标水平比较均无统计学差异(P>0.05)。治疗后,两组患者ALT、AST 和LDH 水平均降低(P<0.05),但两组比较无统计学差异(P>0.05)(表3)。
表3 两组肝功能指标比较 ±s
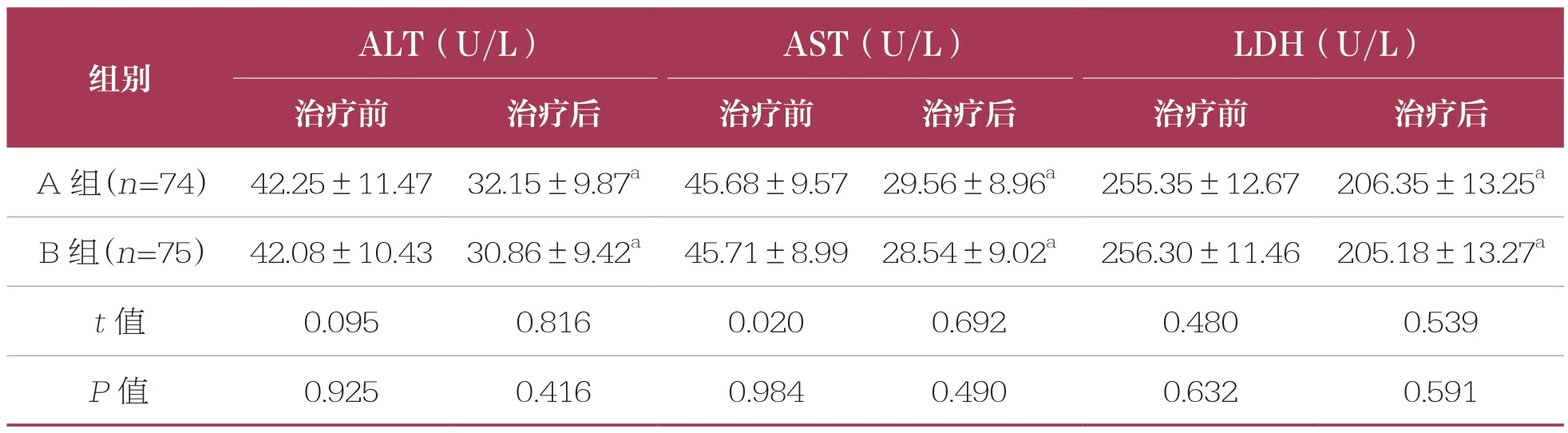
表3 两组肝功能指标比较 ±s
ALT:谷丙转氨酶;AST:谷草转氨酶;LDH:乳酸脱氢酶
ALT(U/L)AST(U/L)LDH(U/L)治疗前治疗后治疗前治疗后治疗前治疗后A 组(n=74) 42.25±11.47 32.15±9.87a 45.68±9.57 29.56±8.96a 255.35±12.67 206.35±13.25a B 组(n=75) 42.08±10.43 30.86±9.42a 45.71±8.99 28.54±9.02a 256.30±11.46 205.18±13.27a t 值0.0950.8160.0200.6920.4800.539 P 值0.9250.4160.9840.4900.6320.591组别
2.3 临床疗效
治疗后,B 组患者DCR(86.67%)高于A组(67.57%,P<0.05); ORR(69.33%)高于A 组(41.89%,P<0.05)(表4)。

表4 两组临床疗效比较 n(%)
2.3 不良反应发生情况
两组患者不良反应总发生率比较无统计学差异(P>0.05)(表5)。
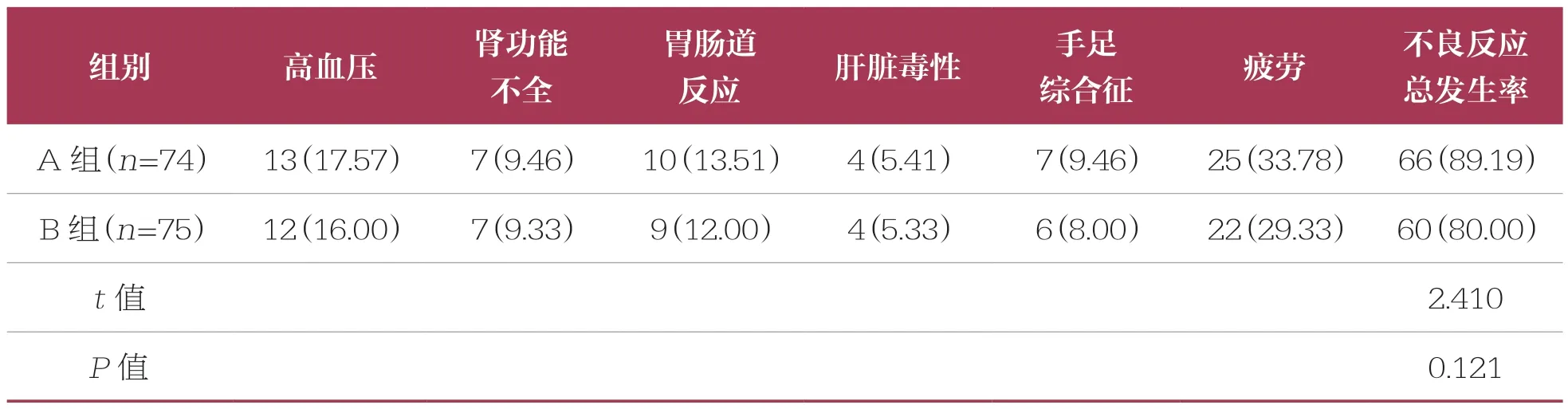
表5 两组不良反应发生率比较 n(%)
3 讨论
全球癌症发病率和死亡率仍处于上升阶段,已成为全球第3 大死因。在我国,肝癌属于高发恶性肿瘤之一,发病率占全球肿瘤患者的近50%[16-17]。尽管外科、介入、放疗等传统疗法以及靶向、免疫治疗等创新疗法均具有一定的治疗效果,但在患者的个体生存期方面仍有待进一步改善。当前,单一靶向或免疫治疗的整体应答率不够理想,且患者个体间的治疗效果差异大,仍是临床面临的挑战之一[17]。对于包括肝癌在内的多种恶性肿瘤,临床治疗模式已由细胞单一治疗模式转向综合治疗模式,使中晚期癌症患者有了新的治疗选择。
对于不能手术切除的新发中晚期肝癌患者来说,目前所能用的一线单药方案有3 个:多纳非尼、索拉非尼和仑伐替尼,均为小分子靶向药物[8]。多纳非尼的安全性和有效性有可能优于索拉非尼[18];仑伐替尼治疗效果优于索拉非尼,但尚缺少该药用于可接受局部治疗的肝细胞癌患者方面的数据[19];索拉非尼虽然是用于晚期肝癌患者的靶向药物,但其毒副作用较大,且其对肝癌患者生存期延长的作用有限。因此,本研究选取了多纳非尼和仑伐替尼作为联合TACE 的靶向药物进行比较。
多纳非尼为新型口服药物,为多靶点多激酶抑制剂类小分子靶向药物,其药物分子中氘代化取代位点与药物的氧化、葡糖醛酸化、酰胺水解等多个代谢途径相关;多纳非尼可抑制多种受体酪氨酸激酶如血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(platelet derived growth factor,PDGFR)等的活性,也可直接抑制各种Raf 激酶,并抑制下游Raf/MEK/ERK 信号传导通路,进而抑制肿瘤血管形成和肿瘤细胞增殖,具有多靶点阻断、双重抑制的特点[20-21]。有人对668 例未进行过全身化疗和(或)分子靶向治疗的不符合手术指征或转移性肝细胞癌患者进行研究,按照1∶1 的比例随机分为多纳非尼组(200mg,bid)和索拉非尼组(400mg,bid),虽然多纳非尼组不良反应谱及其发生率和索拉非尼相似,但其严重不良反应(即≥3 级)发生率较低,因不良反应停药或减量的不良事件发生率更低[18]。
作为多靶点受体酪氨酸激酶抑制剂的仑伐替尼,可作为既往未接受过全身系统治疗的不可切除肝细胞癌患者的治疗选择。在REFLECT 研究[19]中,仑伐替尼中位总生存期(overall survival,OS)为13.6 个月,索拉非尼中位OS 为12.3 个月,两组比较无统计学差异(P>0.05)。此外,仑伐替尼的ORR 和无进展生存期(progression free survival,PFS)均优于索拉非尼(24.1%vs9.2%,7.4 个月vs3.7 个月)。相关研究指出[10],仑伐替尼联合TACE 可达到稳定患者肝功能、延长其生存期的目的。
肿瘤标志物除作为肿瘤诊断的辅助指标外,还可通过检测其变化来评估临床疗效。血清 AFP 是当前诊断肝癌和疗效监测常用且重要的指标[8]。广谱肿瘤标志物血清肿瘤血管因子VEGFR-2 在多种肿瘤诊疗中也有应用[22]。研究显示,血清GP73 对肝癌的诊断和预后预测有一定的应用价值[23]。本研究结果提示,治疗后,两组VEGFR-2 水平均降低(P<0.05),且B 组低于A 组(P<0.05);两组AFP和GP73 水平均降低(P<0.05),但两组比较无统计学差异(P>0.05)。两组ALT、AST 和LDH 等肝功能指标水平均降低(P<0.05),但两组比较无统计学差异(P>0.05)。B 组DCR(86.67%)高于A组(67.57%,P<0.05),且ORR(69.33%)高于A组(41.89%,P<0.05),提示TACE+多纳非尼可有效提高DCR 和ORR,进而改善患者的预后和生存期。此外,本研究分析了2 种联合治疗方案的安全性,两组患者不良反应发生率比较未见统计学差异(P>0.05)。B 组的DCR 和ORR 优于A 组,因此可将TACE+多纳非尼联合治疗方案作为中晚期肝癌患者的首选治疗方案,然而,由于本研究样本量较小、随访时间较短等局限性,仅根据临床数据得出结论可能不够严谨,治疗后两组AFP、GP73、ALT、AST 和LDH 改善水平及不良反应发生率比较均无统计学差异(P>0.05),因此还需要更多的证据来支持这一方案的有效性和安全性。此外,胡晓云等[24]的研究表明,先给予仑伐替尼干预后进行选择性TACE,其治疗效果显著提高。
本研究结果为中晚期肝癌患者选择治疗方案提供了一定的参考,提示TACE 联合仑伐替尼与联合多纳非尼靶向治疗均可用于中晚期且不具有手术指征的原发性肝癌患者的治疗,其中联合多纳非尼靶向治疗的效果和安全性相对更优。但因本研究选取的样本量较小,尚需更大样本量或随机对照研究进一步证实。

