CircYPEL2通过miR-498/MSMO1轴调节宫颈癌细胞的放射敏感性
王 静,易宣洪,汪 萍,黄晓智,熊 伟
(唐山市人民医院,河北 唐山 063000)
宫颈癌是原发于子宫颈部位的女性恶性肿瘤,早期症状不明显,导致多数患者因病情进展到晚期才发现,从而预后很差,该病是造成女性癌症死亡的重要原因。放疗是晚期宫颈癌的标准治疗方法之一,但放疗过程中产生的放射线抵抗性可严重限制其疗效,因此增强宫颈癌细胞的放射敏感性是改善宫颈癌患者预后的关键[1-3]。环状RNA表达失调是宫颈癌的主要发病机制之一[4],其中环状RNA yippee样2(circular RNA yippee-like 2,CircYPEL2)在宫颈癌组织中呈现显著的高表达,CircYPEL2的敲除可导致宫颈癌细胞增殖、迁移和侵袭活力降低[5],因此CircYPEL2可称为宫颈癌的潜在临床治疗靶点。环状RNA调节癌症发生及进展的机制之一是与包括miR-498在内的微小RNA结合并调控其表达[4,6],miR-498作为一种抗癌因子,在食管癌、胃癌、宫颈癌等多种癌组织中表达降低,预示患者预后不良,上调其表达可抑制胃癌和宫颈癌细胞增殖[7-8],并增强食管癌细胞的放射敏感性[9]。甲基甾醇单加氧酶1(methyl sterol monooxygenase 1,MSMO1)是一种独特的肿瘤生物标志物,在食管癌、宫颈癌等各种癌症的恶性进展中起着重要作用,可显著增强食管癌细胞增殖、侵袭和迁移[10],在宫颈鳞状细胞癌肿瘤组织中高表达并与其CD4+T细胞、巨噬细胞、嗜中性粒细胞浸润水平呈显著负相关[11],另外查询Starbase数据库可知CircYPEL2与miR-498之间及miR-498与MSMO1之间有结合位点,因此推测CircYPEL2可能通过miR-498/MSMO1轴调节宫颈癌细胞的放射敏感性。本研究通过建立人宫颈癌放射线抵抗细胞株C33A-RR,对此推测进行验证。
1 材料与方法
1.1 试剂与材料
人宫颈癌细胞株C33A、MEM完全培养基(含10%胎牛血清)购于南京科佰生物科技有限公司;CCK-8试剂盒、兔源抗人β-actin一抗、Hoechst 33258染色染料溶液(ab228550)、兔源抗人Anti-天冬氨酸特异性半胱氨酸蛋白酶3(cysteine-containing aspartate-specific proteases 3,caspase-3)一抗、辣根过氧化物酶标记山羊抗兔IgG二抗、兔源抗人Anti-B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)一抗均购于美国Abcam公司;野生型miR-498报告质粒、CircYPEL2过表达质粒、突变型miR-498报告质粒、野生型MSMO1 3’-UTR报告质粒、突变型MSMO1 3’-UTR报告质粒、miR-498 mimics、miR-498 mimics阴性对照、miR-498 inhibitor、miR-498 inhibitor阴性对照组、CircYPEL2 siRNA质粒、CircYPEL2空载质粒、miR-498及CircYPEL2、MSMO1、β-actin、U6引物购于上海吉玛制药技术有限公司;Trizol(总RNA提取试剂)、结晶紫染色液、脂质体2000、双荧光素酶报告基因检测试剂盒购于北京索莱宝科技有限公司;FITC/PI双染法Annexin V凋亡检测试剂盒、一步法反转录荧光定量试剂盒购买于上海生工生物工程股份有限公司;兔抗人Anti-MSMO1抗体购于上海士锋生物科技有限公司;兔源抗人Anti-Bcl-2相关X蛋白(Bcl2-associated X protein,Bax)抗体、兔源抗人Anti-细胞周期蛋白 D1(cyclin D1,CCND1)抗体、兔源抗人Anti-增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体购于上海碧云天生物技术有限公司等。
1.2 主要仪器
电子直线加速器购于美国Varian公司,荧光定量PCR仪购于济南好来宝医疗器材有限公司,转印模块、电泳系统、全波长酶标仪、流式细胞仪购买于赛默飞世尔科技(中国)有限公司,生物光学显微镜购于南京新睿之鸿光学仪器有限公司,研究级倒置荧光显微镜购于广州市明美光电技术有限公司。
1.3 方法
1.3.1 实时荧光定量PCR和免疫印迹法检测人宫颈癌细胞株C33A和其放射线抵抗细胞株C33A-RR中CircYPEL2、miR-498、MSMO1表达
人宫颈癌放射线抵抗细胞C33A-RR的建立:人宫颈癌细胞系C33A在39℃温水浴中解冻后以MEM完全培养基复苏培养,传代后以电子直线加速器对其以6Gy射线进行放射治疗[12],24h后以新鲜MEM完全培养基洗去死亡细胞并继续培养剩余细胞,然后重新放射治疗后重复操作,如此培养细胞30d后即可获得稳定生长的人宫颈癌放射线抵抗细胞株C33A-RR。
取传代的C33A和C33A-RR细胞加入Trizol混匀后,按照其说明书方法指导提出其中总RNA,然后测量其浓度后以一步法反转录荧光定量试剂盒进行PCR扩增后获得各基因Ct值,具体反应体系的配制和反应条件的设定按照试剂盒说明书进行,以β-actin作为CircYPEL2、MSMO1的内参,以U6作为miR-498的内参,采用算法2-ΔΔCt分析各组基因Ct值得到其相对表达,引物序列见表1。
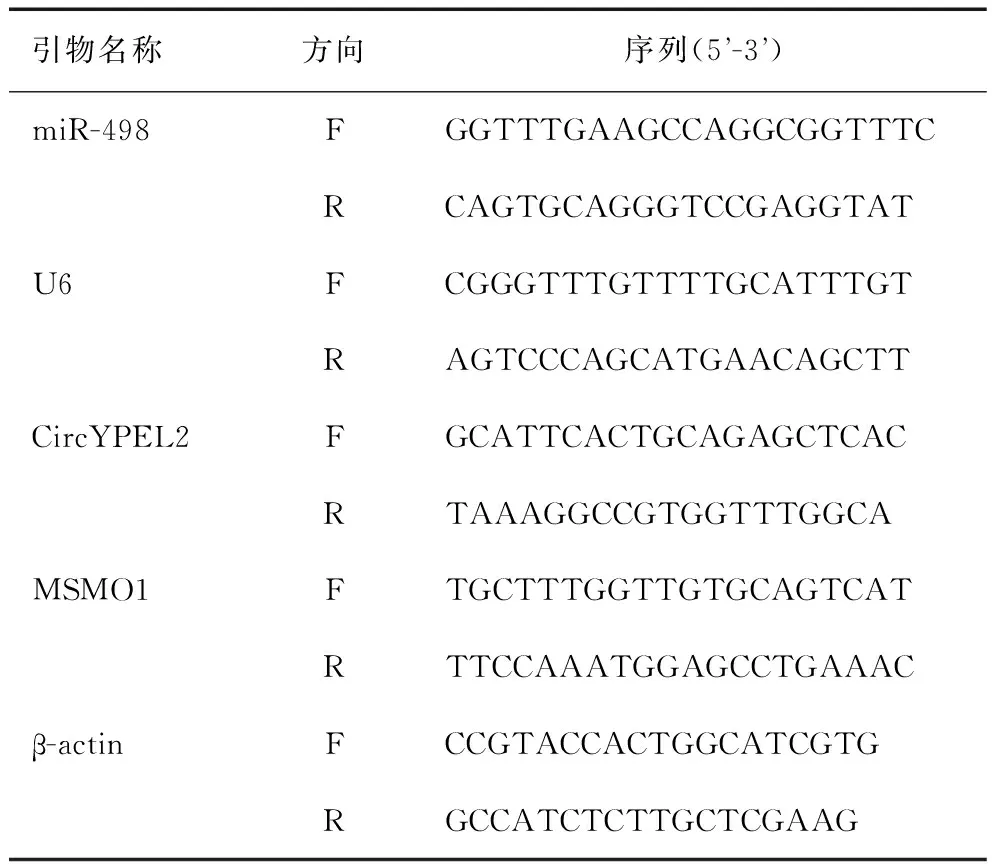
表1 基因引物序列Table 1 Sequences of gene’s primers
取传代的C33A和C33A-RR细胞加入RIPA裂解液混匀,按照说明书提出其中总蛋白后以BCA法测量其浓度,每种细胞取15μg总蛋白100℃变性后通过跑电泳进行分离,然后以120V恒压进行电转使蛋白移至硝酸纤维素膜上,将MSMO1、β-actin蛋白自膜上裁下,孵育兔源抗人MSMO1、β-actin一抗和辣根过氧化物酶标记山羊抗兔IgG二抗,洗膜后化学发光法显色各组蛋白条带,摄取其图像后以Image J软件定量分析各组蛋白相对表达。
1.3.2 分组处理C33A-RR细胞后收集标本
取传代的C33A-RR细胞以每孔1.5×105个的密度接种在12孔板,无菌培养36h,再随机分为对照组、放射组、放射+阴性对照组、放射+CircYPEL2敲低组、放射+CircYPEL2敲低+miR-498 inhibitor组。对照组不做任何处理,放射组细胞以6Gy的射线进行放射治疗,放射+阴性对照组细胞以6Gy的射线进行放射治疗同时采用脂质体2000转染miR-498 inhibitor阴性对照和空载质粒,放射+CircYPEL2敲低组细胞以6Gy的射线进行放射治疗同时采用脂质体2000转染CircYPEL2 siRNA质粒,放射+CircYPEL2敲低+miR-498 inhibitor组细胞以6Gy的射线进行放射治疗同时采用脂质体2000转染CircYPEL2 siRNA质粒和miR-498 inhibitor,各组细胞都在放射治疗及转染24h后收集其细胞沉淀作为标本备用。
1.3.3 实时荧光定量PCR和免疫印迹法检测各组C33A-RR细胞中CircYPEL2、miR-498、MSMO1表达
提取1.3.2中收集的各组细胞中总RNA和总蛋白后进行实时荧光定量PCR和免疫印迹实验,检测出各组C33A-RR细胞中miR-498与CircYPEL2相对表达、MSMO1 mRNA及蛋白相对表达,具体方法见1.3.1。
1.3.4 CCK-8和平板集落形成实验检测各组C33A-RR细胞增殖
CCK-8法:取传代的C33A-RR细胞以每孔1×104个的密度接种在96孔板中无菌培养36h后,以1.3.2的方法分组处理24h后,采用CCK-8试剂盒按照其说明书指导检测各组细胞吸光值后算出各组细胞增殖率,公式为:细胞增殖率=实验组吸光值/对照组吸光值×100%。
平板集落形成实验:取传代的C33A-RR细胞以每孔50个的密度接种在24孔板中无菌培养36h后,以1.3.2中方法分组处理24h后,以新鲜MEM完全培养基继续培养3周后即发现各组细胞形成集落,漂洗、固定后采用结晶紫染色液按照说明书指导染色,采用生物光学显微镜观察着色后的各组细胞集落并摄取图片,以Image J软件分析定量各组细胞集落数目后计算集落生成率,公式为:集落生成率=实验组细胞集落数目/对照组细胞集落数目×100%。
1.3.5 Hoechst 33258染色和流式细胞实验检测各组C33A-RR细胞凋亡
Hoechst 33258染色:取传代的C33A-RR细胞以每孔1.5×105个的密度接种在12孔板中无菌培养36h后,以1.3.2中方法分组处理24h后,漂洗、固定后采用Hoechst 33258染色染料溶液按照说明书指导染色,倒置荧光显微镜观察着色后的各组细胞并摄取其图片,以Image J软件分析定量各组细胞总数目和凋亡细胞数目后算出凋亡细胞比例(正常细胞:圆润并呈微弱蓝色;凋亡细胞:固缩破碎并呈明亮蓝色)。公式为:凋亡细胞比例=凋亡细胞数目/细胞总数目×100%。
流式细胞实验:取传代的C33A-RR细胞以每孔1.5×105个的密度接种在12孔板中无菌培养36h后,以1.3.2中方法分组处理24h后,收集各组细胞沉淀后清洗、计数,每组取5×105个细胞采用FITC/PI双染法Annexin V凋亡检测试剂盒按照说明书检测每组细胞凋亡率。
1.3.6 免疫印迹实验检测各组C33A-RR细胞增殖及凋亡蛋白表达
提取1.3.2中收集的各组细胞总蛋白后进行免疫印迹实验,检测出各组C33A-RR细胞中PCNA、CCND1、Bcl-2、Bax、caspase-3相对表达,具体方法见1.3.1。
1.3.7 检测C33A-RR细胞中CircYPEL2对miR-498及miR-498对MSMO1的靶向调控
取传代的C33A-RR细胞以每孔1.5×105个的密度接种在12孔板中无菌培养36h后,随机分为miR-498突变+CircYPEL2空载组(转染突变型miR-498报告质粒+空载质粒)、miR-498突变+CircYPEL2过表达组(转染突变型miR-498报告质粒+CircYPEL2过表达质粒)、miR-498野生+CircYPEL2空载组(转染野生型miR-498报告质粒+空载质粒)、miR-498野生+CircYPEL2过表达组(转染野生型miR-498报告质粒+CircYPEL2过表达质粒)、MSMO1突变+miR-498 mimics阴性对照组(转染突变型MSMO1 3’-UTR报告质粒+miR-498 mimics阴性对照)、MSMO1突变+miR-498 mimics组(转染突变型MSMO1 3’-UTR报告质粒+miR-498 mimics)、MSMO1野生+miR-498 mimics阴性对照组(转染野生型MSMO1 3’-UTR报告质粒+miR-498 mimics阴性对照)、MSMO1野生+miR-498 mimics组(转染野生型MSMO1 3’-UTR报告质粒+miR-498 mimics),采用脂质体2000按照说明书分组转染,24h后采用双荧光素酶报告基因检测试剂盒检测各组细胞双荧光素酶相对活性值。
1.4 统计学方法

2 结果
2.1 CircYPEL2、miR-498、MSMO1在C33A及C33A-RR中的表达
与C33A细胞相比,C33A-RR细胞中CircYPEL2表达、MSMO1 mRNA与蛋白表达均升高(P<0.05),miR-498表达降低(P<0.05),见表2、图1。

图1 免疫印迹检测C33A及C33A-RR细胞 MSMO1表达Fig.1 Expressions of MSMO1 in C33A cells and C33A-RR cells by immunoblotting detection
表2 C33A细胞、C33A-RR细胞的miR-498与CircYPEL2、MSMO1 mRNA及MSMO1表达水平Table 2 Expression levels of miR-498,CircYPEL2 and MSMO1 mRNA in C33A cells and C33A-RR cells
2.2 各组C33A-RR细胞CircYPEL2与miR-498、MSMO1表达检测结果
各组的CircYPEL2、miR-498、MSMO1 mRNA、MSMO1蛋白表达比较差异均有统计学意义(P<0.05)。与对照组相比,放射+CircYPEL2敲低组细胞CircYPEL2、MSMO1 mRNA与MSMO1蛋白表达均降低(P<0.05),miR-498表达升高(P<0.05);与放射组相比,放射+CircYPEL2敲低组细胞CircYPEL2、MSMO1 mRNA与MSMO1蛋白表达均降低(P<0.05),miR-498表达升高(P<0.05);与放射+CircYPEL2敲低组相比,放射+CircYPEL2敲低+miR-498 inhibitor组细胞的CircYPEL2表达无明显变化(P>0.05),miR-498表达降低(P<0.05),MSMO1 mRNA与蛋白表达均升高(P<0.05),见表3、图2。
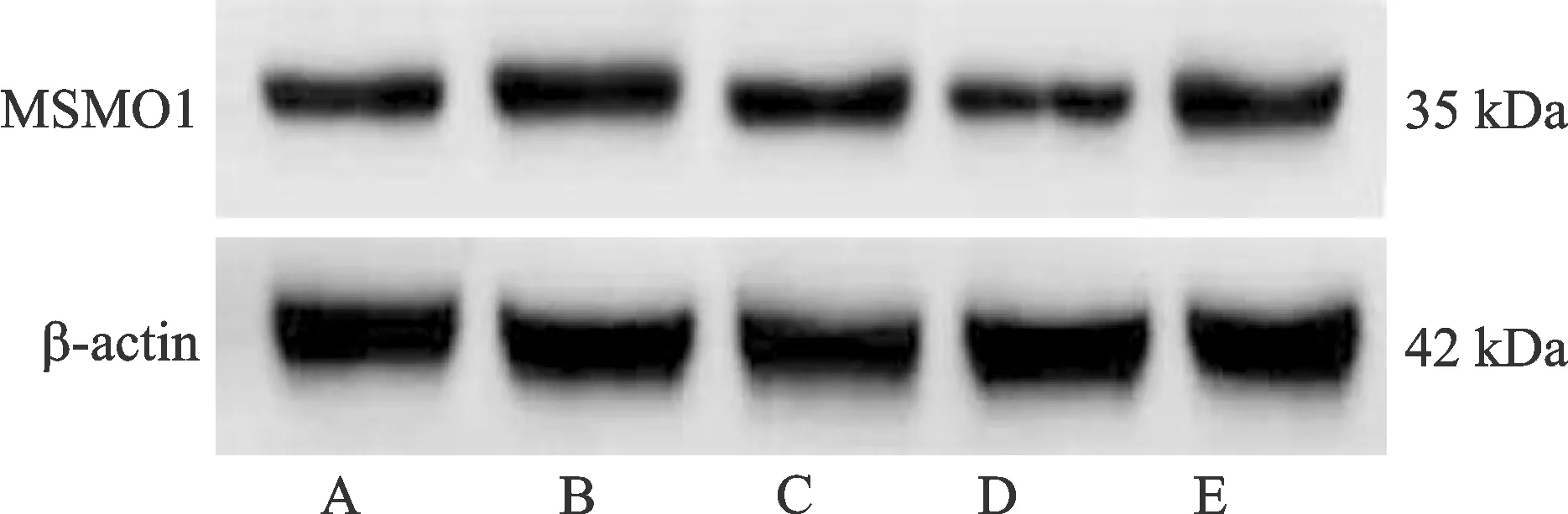
注:A.对照组;B.放射组;C.放射+阴性对照组;D.放射+CircYPEL2敲低组;E.放射+CircYPEL2敲低+miR-498 inhibitor组。图2 免疫印迹法检测各组C33A-RR细胞MSMO1表达Fig.2 Expression of MSMO1 in C33A-RR cells detected by immunoblotting method
表3 各组C33A-RR细胞miR-498、CircYPEL2、MSMO1 mRNA与MSMO1蛋白相对表达水平Table 3 Relative expression levels of miR-498,CircYPEL2,MSMO1 mRNA and it’s proteins in C33A-RR cells in the five groups
2.3 各组C33A-RR细胞增殖检测结果
各组细胞增殖率与集落生成率比较差异有统计学意义(P<0.05)。与对照组相比,放射+CircYPEL2敲低组的细胞增殖率、集落生成率均降低(P<0.05);与放射组相比,放射+CircYPEL2敲低组的细胞增殖率、集落生成率均降低(P<0.05);与放射+CircYPEL2敲低组相比,放射+CircYPEL2敲低+miR-498 inhibitor组的细胞增殖率、集落生成率均升高(P<0.05),见表4、图3。
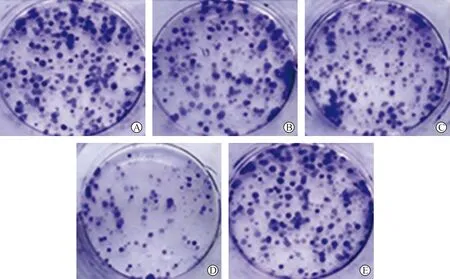
注:A.对照组;B.放射组;C.放射+阴性对照组;D.放射+CircYPEL2敲低组;E.放射+CircYPEL2敲低+miR-498 inhibitor组。图3 结晶紫染色检测各组C33A-RR细胞集落生成Fig.3 C33A-RR cell colony formation in the five groups detected by crystal violet staining method
2.4 各组C33A-RR细胞凋亡检测结果
各组凋亡细胞比例与细胞凋亡率比较差异有统计学意义(P<0.05)。与对照组相比,放射+CircYPEL2敲低组的凋亡细胞比例与细胞凋亡率均升高(P<0.05);与放射组相比,放射+CircYPEL2敲低组的凋亡细胞比例与细胞凋亡率均升高(P<0.05);与放射+CircYPEL2敲低组相比,放射+CircYPEL2敲低+miR-498 inhibitor组的凋亡细胞比例与细胞凋亡率均降低(P<0.05),见表5、图4、图5。

注:A.对照组;B.放射组;C.放射+阴性对照组;D.放射+CircYPEL2敲低组;E.放射+CircYPEL2敲低+miR-498 inhibitor组。图4 Hoechst 33258染色检测各组C33A-RR细胞凋亡Fig.4 C33A-RR cell apoptosis in the five groups detected by Hoechst 33258 staining method

注:A.对照组;B.放射组;C.放射+阴性对照组;D.放射+CircYPEL2敲低组;E.放射+CircYPEL2敲低+miR-498 inhibitor组。图5 流式细胞实验检测各组C33A-RR细胞凋亡Fig.5 C33A-RR cell apoptosis in the five groups detected by flow cytometry
表5 各组C33A-RR凋亡细胞比例与细胞凋亡率比较Table 5 Comparison of proportion of apoptotic cells and apoptosis rate of C33A-RR cells among the five groups
2.5 各组C33A-RR细胞增殖与凋亡相关蛋白表达检测结果
各组PCNA、CCND1、Bcl-2、Bax、caspase-3蛋白相对表达比较差异均有统计学意义(P<0.05)。与对照组相比,放射+CircYPEL2敲低组的细胞PCNA、CCND1、Bcl-2蛋白表达降低(P<0.05),Bax、caspase-3蛋白表达升高(P<0.05);与放射组相比,放射+CircYPEL2敲低组的细胞PCNA、CCND1、Bcl-2蛋白表达降低(P<0.05),Bax、caspase-3蛋白表达升高(P<0.05);与放射+CircYPEL2敲低组相比,放射+CircYPEL2敲低+miR-498 inhibitor组的细胞PCNA、CCND1、Bcl-2蛋白表达升高(P<0.05),Bax、caspase-3蛋白表达降低(P<0.05)。见表6、图6。

注:A.对照组;B.放射组;C.放射+阴性对照组;D.放射+CircYPEL2敲低组;E.放射+CircYPEL2敲低+miR-498 inhibitor组。图6 免疫印迹法检测各组C33A-RR细胞PCNA、CCND1、Bcl-2、Bax、caspase-3的表达Fig.6 Expressions of PCNA,CCND1,Bcl-2,Bax, and caspase-3 in C33A-RR cells in the five groups detected by immunoblotting method
表6 各组细胞PCNA、CCND1、Bcl-2、Bax、caspase-3蛋白相对表达水平Table 6 Relative expression levels of PCNA,CCND1,Bcl-2,Bax and caspase-3 proteins in the five groups
2.6 C33A-RR细胞中CircYPEL2对miR-498的靶向调节及miR-498对MSMO1的靶向调节
在Starbase数据库中查询到CircYPEL2和miR-498之间的结合位点,见图7。各组相对荧光素酶活性比较差异有统计学意义(P<0.05)。与miR-498野生+CircYPEL2空载组比较,miR-498野生+CircYPEL2过表达组的相对荧光素酶活性降低(P<0.05);miR-498突变+CircYPEL2空载组与miR-498突变+CircYPEL2过表达组之间的相对荧光素酶活性差异无统计学意义(P>0.05),见表7。

图7 CircYPEL2和miR-498之间的结合位点Fig.7 Binding sites between CircYPEL2 and miR-498 found in the Starbase database
表7 各组C33A-RR细胞相对荧光素酶活性值Table 7 Relative luciferase activity of C33A-RR cells in the five groups
在Starbase数据库中查询到miR-498和MSMO1之间的结合位点,见图8。各组相对荧光素酶活性比较差异有统计学意义(P<0.05)。与MSMO1野生+miR-498 mimics阴性对照组比较,MSMO1野生+miR-498 mimics组的相对荧光素酶活性降低(P<0.05);MSMO1突变+ miR-498 mimics阴性对照组与MSMO1突变+miR-498 mimics组之间相对荧光素酶活性差异无统计学意义(P>0.05),见表8。

图8 miR-498和MSMO1之间的结合位点Fig.8 Binding sites between miR-498 and MSMO1 found in the Starbase database

表8 各组C33A-RR细胞相对荧光素酶活性值Table 8 Relative luciferase activity of C33A-RR cells in the five groups
3 讨论
3.1 构建人宫颈癌放射线抵抗细胞株C33A-RR
宫颈癌的主要病因是高危型HPV持续感染、多伴侣性行为及多次分娩等,放疗作为其临床标准治疗手段之一可有效杀伤癌细胞,抑制宫颈癌病情进展,但癌细胞放射敏感性会随着放疗次数增多而降低,极大影响了放疗效果,因此探寻有效的放射敏感性增强方法在宫颈癌的临床治疗中意义重大[13-14]。本文以6Gy的射线诱导建立人宫颈癌放射线抵抗细胞株C33A-RR,结果显示,与对照组相比,放射组细胞凋亡细胞比例、细胞凋亡率、细胞增殖率、集落生成率均无明显变化,表明以6Gy的射线对C33A-RR细胞进行照射不影响其增殖及凋亡,提示人宫颈癌放射线抵抗细胞株C33A-RR建立成功。
3.2 敲低CircYPEL2表达可增强宫颈癌细胞放射敏感性
有研究显示环状RNA是调控宫颈癌发生及进展的关键因子[4,15],CircYPEL2作为具有明显致癌活性的环形RNA在宫颈癌组织和细胞中表达显著升高,可作为宫颈癌临床研究的潜在生物标志物,敲除CircYPEL2可明显抑制宫颈癌细胞增殖、迁移和侵袭[5],本文研究结果显示,CircYPEL2在C33A-RR细胞中表达相比C33A细胞明显升高,表明CircYPEL2参与介导宫颈癌的放射线抵抗过程;与放射组相比,放射+CircYPEL2敲低组细胞CircYPEL2表达、细胞增殖率、集落生成率、PCNA、CCND1、Bcl-2蛋白表达降低,凋亡细胞比例、细胞凋亡率、Bax及caspase-3蛋白表达升高,表明敲低CircYPEL2表达可增强放射敏感性,提高射线对宫颈癌的杀伤力,显著抑制6Gy的射线照射的C33A-RR细胞增殖并促进其凋亡,揭示CircYPEL2是调控宫颈癌放射敏感性的重要靶点,对其敲除是提高宫颈癌患者放疗效果的潜在手段。
3.3 CircYPEL2调节miR-498/MSMO1轴对宫颈癌细胞放射敏感性的作用
有研究显示,环状RNA是通过海绵作用下调miR-654-3p、miR-498等介导癌症的发生发展[4,6,16],其中miR-498在食管癌、宫颈癌等肿瘤组织中显著低表达,对其过表达可抑制食管癌进展[17],并可抑制宫颈癌细胞的增殖和侵袭[18],miR-498还可介导食管癌细胞放射线抵抗性的产生,增强其表达可促进放射线杀伤食管癌细胞[9];MSMO1作为一种致癌基因在宫颈鳞状细胞癌肿瘤组织中表达明显升高[11],可通过调控胆固醇生物合成促使胰腺癌细胞存活和化疗敏感性减弱[19],敲除MSMO1可显著降低三阴型乳腺癌细胞对紫杉醇耐药性[20],查询Starbase数据库进行生物信息学分析可知CircYPEL2可能通过miR-498调控MSMO1表达,因此推测CircYPEL2可能通过调控miR-498/MSMO1轴影响宫颈癌细胞的放射敏感性。本研究结果显示,MSMO1 mRNA与蛋白表达在C33A-RR细胞中相比C33A细胞明显升高,但miR-498表达明显降低,且双荧光素酶报告基因实验结果证实CircYPEL2可靶向下调C33A-RR细胞miR-498表达,而miR-498可靶向下调C33A-RR细胞MSMO1表达,表明CircYPEL2可通过调控miR-498/MSMO1轴介导宫颈癌细胞的放射敏感性;以CircYPEL2 siRNA质粒和miR-498 inhibitor联合干预6Gy射线处理的C33A-RR细胞,相比CircYPEL2 siRNA质粒单独处理,可升高细胞增殖率、集落生成率、PCNA及CCND1、Bcl-2蛋白表达,降低细胞凋亡率、凋亡细胞比例、Bax及caspase-3蛋白表达,表明下调miR-498可减弱CircYPEL2的敲低对宫颈癌放射敏感性的增强作用,拮抗其对6Gy射线照射的C33A-RR细胞的促凋亡和抗增殖作用,揭示敲低CircYPEL2增强宫颈癌细胞放射耐药性是通过上调miR-498实现的。
综上所述,CircYPEL2可通过靶向下调miR-498来抑制MSMO1表达,进而促使人宫颈癌细胞的放射抵抗性,敲低CircYPEL2可通过促进miR-498表达而下调MSMO1,从而提高宫颈癌细胞的放射敏感性,增强放射线对C33A-RR细胞的杀伤力,最终对其发挥抗增殖和促凋亡作用。本研究为阐释宫颈癌放射敏感性的调控机制提供了新的科学资料,有利于宫颈癌放疗效果的提高。

