缩骨鲫Cyt b基因和控制区序列克隆及系统进化分析
李强 郑鹏 黄文炜 彭苏汉 周江伟 詹华伟 蓝昭军 桂林


摘 要:研究通過Sanger测序法对天然雌核发育的缩骨鲫(Carassius auratus var. Suogu)线粒体DNA的Cyt b基因和控制区进行扩增和测序,并与已发表的其他鲫属鱼类的Cyt b基因进行系统进化分析,探讨缩骨鲫与其他鲫属鱼类的系统进化关系。结果表明:缩骨鲫线粒体DNA中Cyt b基因和控制区全序列分别长1 141和924 bp;其中,Cyt b基因的碱基含量为29.1%(T)、27.9%(C)、28.7%(A)和14.3%(G),控制区序列的碱基含量为32.6%(T)、20.7%(C)、32.6%(A) 和14.1%(G);2种序列中G+C含量均明显低于A+T含量,且G含量偏低,显示了与其他脊椎动物线粒体核苷酸碱基含量相似的特征;控制区序列可以分为终止序列区、中央保守区和保守序列区3个区域,均识别到了对应的保守序列;基于邻接法(NJ)和最大简约法(MP)构建缩骨鲫与其他鲫属鱼类Cyt b 基因的系统进化树表明,缩骨鲫与红鲫和淇河鲫的亲缘关系最近,而缩骨鲫与野鲫、淇河鲫和红鲫分布在同一个姐妹支系,进一步说明缩骨鲫可能起源于野鲫,是野鲫的一个地方种群。
关键词:缩骨鲫;细胞色素b基因;控制区;系统进化分析
中图分类号:Q953.3; S917.4 文献标识码:A文章编号:1006-060X(2023)10-0007-04
Sequence Cloning and Phylogenetic Analysis of Cyt b Gene and Control Region in mtDNA of Carassius auratus var. Suogu
LI Qiang1, ZHENG Peng1, HUANG Wen-wei1, PENG Su-han1, ZHOU Jiang-wei1, ZHAN Hua-wei1, LAN Zhao-jun2, GUI Lin1
(1. College of Life Science, Guangzhou University, Guangzhou 510006, PRC; 2. Shaoguan Fishery Technology Promotion Station, Shaoguan Fisheries Research Institute, Shaoguan 512006, PRC)
Abstract:The complete sequences of Cyt b gene and control region in mtDNA of natural gynogenesis triploid C. auratus var. Suogu were determined through Sanger sequencing method after PCR amplification. The phylogenetic analysis was performed by sequence alignment of the Cyt b gene between C. auratus var. Suogu and the other Carassius fishes in GenBank to explore their phylogenetic relationship. Results showed that the total length of Cyt b gene was 1 141 bp and the control region was 924 bp. The base composition of Cyt b gene was 29.1% T, 27.9% C, 28.7% A and 14.3% G, and control region was 32.6% T, 20.7% C, 32.6% A and 14.1% G. In these two sequences, the contents of G+C (42.2%, 34.8%) were significantly lower than those of A+T (57.8%, 65.2%), and the G base contents were low, which showed a similarity to those of other vertebrates. The sequence of control region was divided into three regions: termination sequence region, central conserved region and conserved sequence region, in which the corresponding conserved sequences were identified. The phylogenetic trees constructed by the neighbor-joining method (NJ) and maximum parsimony (MP) based on Cyt b gene in C. auratus var. Suogu and other Carassius fishes have revealed that C. auratus var. Suogu is closely related to C. auratus red var. and C. auratus var. Qihe. In addition, the C. auratus var. Suogu is distributed in the same sister branch with C. auratus auratus, C. auratus var. Qihe and C. auratus red var., which has indicated that the C. auratus var. Suogu may be originated from C. auratus auratus and belongs to a local population of C. auratus auratus.
Key words:Carassius auratus var. Suogu; cytochrome b gene; control region; phylogenetic analysis
收稿日期:2023–05–08
基金项目:广州市科技计划项目(201804010486);广东省教育科学规划课题(2021GXJK097)
作者简介:李 强(1983—),男,广东韶关市人,实验师,主要从事淡水鱼类生态与亲缘地理研究。
通信作者:桂 林
缩骨鲫(Carassius auratus var. Suogu)是一种天然雌性核发育的三倍体鲫鱼,属鲤形目鲤科鲫属,主要分布在广东省韶关地区,为该地方特有的鲫鱼品种[1]。与其他鲫鱼形态特征相比,缩骨鲫的尾柄长明显小于尾柄高,体高明显比其他鲫鱼品种突出[2],这一形态是漫长的环境适应进化的结果,为可遗传性状。由于缩骨鲫体短而高的特点,其含肉比例较高,且口感鲜美,是产区的重要經济鱼类。近年来,由于环境污染和过度捕捞等人为干涉,缩骨鲫的野生资源锐减,亟待加以保护和可持续开发利用。目前有关缩骨鲫的研究主要集中在生物学特性[1-2]、人工繁殖[3]、基因克隆[4-5]等方面,尚无缩骨鲫系统进化关系的研究报道。
线粒体DNA(mtDNA)具有结构简单、无基因重组、进化速度比核基因快等特点,是研究鱼类系统进化和遗传多样性的理想分子标记[6]。其中,细胞色素b基因(Cyt b)是mtDNA中结构和功能被研究得最为广泛的基因之一,该基因进化速度适中,较适合研究种内和种间遗传变异[7];另外,控制区是mtDNA中主要的非编码区,属于进化最快的片段,常作为分子标记来探讨各种鱼类的种群遗传多样性和种内遗传分化[8]。该研究通过对缩骨鲫线粒体的Cyt b基因和控制区进行扩增和测序,与已发表的其他鲫属鱼类进行系统进化分析,探讨缩骨鲫与其他鲫属鱼类的系统进化关系,旨在为缩骨鲫种质资源保护、研究和利用提供基础数据。
1 材料与方法
1.1 试验材料
试验所用缩骨鲫来自广东省韶关市水产研究所的试验基地。随机选取5尾缩骨鲫活鱼样品,样品形态见图1。
1.2 DNA 提取和PCR扩增
采用动物基因组DNA提取试剂盒提取缩骨鲫总DNA。PCR扩增反应体系(25 μL):PCR Master Mix 12.5 μL、Primer1 1μL、Primer2 1μL、模板DNA 3 μL、灭菌双蒸水7.5 μL。反应在PTC100或PTC200型PCR仪上进行。PCR扩增程序: 95℃预变性3 min;95℃变性0.5 min,53℃退火0.5 min ,72℃延伸1.5 min ,循环35次;72℃ 延伸10 min。Cyt b基因克隆的引物为L14724和H15915[9],控制区序列克隆的引物为CR1和CR2[10],引物由生工生物工程(上海)股份有限公司合成。电泳检验合格的PCR产物委托生工生物工程(上海)股份有限公司进行纯化并双向测序。
1.3 数据分析
对测得的序列使用Sequence Analysis 5.2 软件进行拼接。通过MEGA 7.0 软件分析各序列的结构特征[11]。为了探讨缩骨鲫在鲫属鱼类中的系统进化关系,从GenBank 数据库下载鲫属鱼类的Cyt b 基因和控制区全序列,包括野鲫(C. auratus auratus)、淇河鲫(C. auratus var. Qihe)、彭泽鲫(C. auratus var. Pengze)、滁州鲫(C. auratus var. Chuzhou)、方正银鲫(C. auratus gibelio)、方正银鲫A系(C. auratus gibelio clone A)、方正银鲫D系(C. auratus gibelio clone D)、方正银鲫E系(C. auratus gibelio clone E)、兰氏鲫(C. auratus langsdorfi)、日本白鲫(C. cuvierius)、萍乡肉红鲫(C. auratus var. Pingxiangnensis)、红鲫(C. auratus red var.)和鲤鱼(Cyprinus carpio),Genbank中的序列登录号依次为JN105355、KJ476998、KJ874429、KM659025、GU138989、JF496198、JF496197、KX611160、AB006953、AB045144、HQ875340、KJ874430和AP009047。基于Cyt b 基因构建邻接法(NJ)和最大简约法(MP)的鲫属鱼类的分子系统进化树。
2 结果与分析
2.1 线粒体DNA Cyt b基因和控制区序列分析
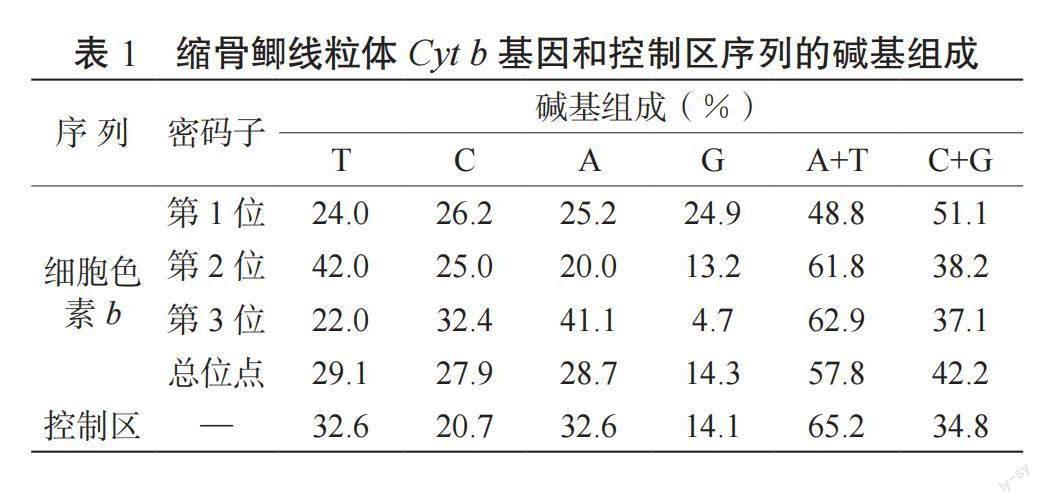
缩骨鲫线粒体Cyt b 基因和控制区序列经软件拼接后的长度分别为1 141和923 bp。Cyt b 基因的起始密码子是ATG,终止密码子是T,共编码380个氨基酸。Cyt b 基因中T、C、A 和G 的含量分别为29.1%、27.9%、28.7%和14.3%,A+T含量(57.8%)明显大于G+C含量(42.2%);控制区序列的T、C、A和G含量分别为32.6%、20.7%、32.6%和14.1%,A+T含量(65.2%)明显大于G+C含量(34.8%)。缩骨鲫线粒体Cyt b 基因和控制区序列中,G含量显著低于其他3种碱基,且具有明显的AT偏好性。
2.2 线粒体控制区序列结构
缩骨鲫和其他硬骨鱼类的控制区相似,位于tRNAPro和tRNAPhe之间,全长923 bp。通过与其他鱼类控制区及各个区域关键序列和保守序列的比对,缩骨鲫的控制区也可以划分为3个部分:终止序列区、中央保守区和保守序列区。由图2可知,终止序列区位于控制区的5'端,是控制区变异最大的区域,识别出1个终止相关序列(TAS),其碱基序列为TACATATATGTA;中央保守区识别出了CSB-F(ATGTAGTAAGAGACCACC)、CSB-E(ATGATA GAATCAGGGACAT)和CSB-D(TTATACTGGCATCTGA TTAA)等关键序列;保守序列区识别出了CSB-1(ATATAAATGAATTATCGTAAGACATA)、CBS-2(CAAACCCCCCTACCCCC)和CBS-3(TGTCAAACCCC GAAACCA)等保守序列(图2)。
2.3 基于鄰接法(NJ)和最大简约法(MP)的缩骨鲫系统进化树
基于邻接法(NJ)和最大简约法(MP)构建缩骨鲫与其他鲫属鱼类Cyt b 基因的系统进化树,以鲤鱼作为外类群,结果如图3所示。2种方法构建的系统进化树的拓扑结构相似,鲫属鱼类聚成Ⅰ和Ⅱ 2支。来自中国的鲫属鱼类组成了第Ⅰ支,而来自日本的兰氏鲫和日本白鲫组成了第Ⅱ支,支系Ⅰ和Ⅱ之间的遗传距离为6.7%,这说明兰氏鲫和日本白鲫与中国的鲫属鱼类发生了明显的遗传分化。在Ⅰ支中,又可分为A和B个2姐妹群。A群包含了方正银鲫系列、彭泽鲫、滁州鲫和萍乡肉红鲫;B群则包含野鲫、缩骨鲫、淇河鲫、红鲫等物种,A群和B群之间的遗传距离为1.8%,中国鲫属鱼类的遗传分化程度较小。从B支系可知,缩骨鲫与淇河鲫和红鲫聚成一支,这说明缩骨鲫与淇河鲫和红鲫的亲缘关系较近。
3 讨 论
3.1 序列组成及控制区结构
鱼类线粒体DNA是研究鱼类系统发育和遗传多样性的理想分子标记[12]。目前,研究最多是Cyt b基因、COI基因、ATPase8/6基因和控制区序列。该研究首次获得了缩骨鲫的线粒体Cyt b基因和控制区的全序列,它们的长度分别为1 141和923 bp。缩骨鲫这2种序列的碱基A+T含量均高于G+C,G含量显著低于其他3种碱基,这些都与脊椎动物线粒体DNA的特点相一致[13]。Cyt b基因以单独的T碱基作为终止密码子,在其他动物类群中也常见[14]。一般认为不完全终止密码子是由于蛋白质编码基因3'端与tRNA基因重叠所致[15],不完全的终止密码子将在转录过程中由mRNA 3'端的 Poly(A)尾补全[16]。控制区是脊椎动物线粒体基因组中主要的非编码片段,是变异最大的区域[6]。缩骨鲫线粒体基因组控制区的长度为923 bp,在终止序列区识别出1个终止相关序列(TAS),中央保守区识别出了CSB-F、CSB-E和CSB-D等关键序列,保守序列区识别出了CSB-1、CBS-2和CBS-3等保守序列,这与刘良国等[10]报道的其他鲫属鱼类线粒体控制区结构相似。
3.2 缩骨鲫系统地位
我国的鲫属鱼类包括鲫和黑鲫2种,前者又可以分为鲫指名亚种和银鲫亚种,银鲫亚种主要分布在黑龙江和额尔齐斯河河水系,而鲫几乎遍布全国各主要水系[17]。鲫适应性强、是遗传背景复杂的类群,在长期的生态适应过程中形成了诸如方正银鲫、滇池高背鲫、江西彭泽鲫、河南淇河鲫、贵州普安鲫、安徽滁州鲫、广东缩骨鲫等许多不同的鲫种群[18]。广东缩骨鲫主要分布在广东省韶关地区的翁源县等地,谢楠等[19]将其归为银鲫的地方类群。张辉等[20]用限制性内切酶对银鲫、彭泽鲫、缩骨鲫和野鲫的mtDNA进行单倍型分析认为,缩骨鲫属于野鲫的一个地方品系。而刘良国等[21]对广东地区彭泽鲫、缩骨鲫和野鲫进行RAPD分析,结果表明彭泽鲫和缩骨鲫的亲缘关系较近,推测它们可能共同起源于野鲫。
该研究使用NJ和MP 2种方法构建的鲫属鱼类Cyt b基因系统进化树的拓扑结构基本一致。在系统进化树上,方正银鲫系列、彭泽鲫、滁州鲫、和萍乡肉红鲫聚成一支;野鲫、缩骨鲫、淇河鲫和红鲫聚成另一支,这2支相互形成姐妹群,具有很高的支持率,分别代表了银鲫类群和非银鲫类群。这一结果也表明,缩骨鲫与红鲫、淇河鲫和野鲫的亲缘关系较近,与方正银鲫、滁州鲫、彭泽鲫的亲缘关系较远,缩骨鲫可能起源野鲫,属于野鲫的一个地方种群,而非银鲫地方种群,这与张辉等[20]的研究结果相似。
参考文献:
[1] 俞豪祥,张海明,林莲英. 广东雌核发育鲫鱼的生物学及养殖试验的初步研究[J]. 水生生物学报,1987,11(3): 287-288.
[2] 俞豪祥,张海明. “缩骨鲫”的生物学及养殖试验初报[J]. 水产科技情报,1986,13(3): 21.
[3] 吴土金,钟良明,谷平华,等. 缩骨鲫人工繁育技术研究[J]. 海洋与渔业,2016(9): 54-55.
[4] 杨 扬,许炎坤,舒 琥,等. 缩骨鲫MSTN基因的克隆与组织表达分析[J]. 淡水渔业,2017,47(2): 23-29.
[5] 杨 扬,周惠强,舒 琥,等. 缩骨鲫(Carassius auratus sogu var.)MC4R克隆、组织分布以及与生长相关SNPs的筛选[J]. 海洋与湖沼,2017,48(4): 830-837.
[6] 刘云国. 水产生物DNA分子标记技术[M]. 北京: 科学出版社,2009.
[7] 肖武汉,张亚平. 鱼类线粒体DNA的遗传与进化[J]. 水生生物学报,2000,24(4): 384-391.
[8] BEHEREGARAY L B,SUNNUCKS P. Fine-scale genetic structure,estuarine colonization and incipient speciation in the marine silverside fish Odontesthes argentinensis[J]. Molecular Ecology,2001,10(12): 2849-2866.
[9] XIAO W H,ZHANG Y P,LIU H Z. Molecular systematics of Xenocyprinae(Teleostei: Cyprinidae):taxonomy,biogeography,and coevolution of a special group restricted in East Asia[J]. Molecular Phylogenetics and Evolution,2001,18(2): 163-173.
[10] 刘良国,杨品红,王文彬,等. 洞庭青鲫与其他六个鲫鱼品系线粒体DNA控制区的比较分析[J]. 水生生物学报,2010,34(2): 378-387.
[11] KUMAR S,STECHER G,TAMURA K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,2016,33(7): 1870-1874.
[12] 郭新红,刘少军,刘 巧,等. 鱼类线粒体DNA研究新进展[J]. 遗传学报,2004,31(9): 983-1000.
[13] HOCHACHKA P,MOMMSEN T P. Biochemistry and molecular biology of fish[M]. London: Elsevier Science Publishers,1993.
[14] CUI Z X,LIU Y,LI C P,et al. The complete mitochondrial genome of the large yellow croaker,Larimichthys crocea(Perciformes,Sciaenidae):unusual features of its control region and the phylogenetic position of the Sciaenidae[J]. Gene,2009,432(1/2): 33-43.
[15] WOLSTENHOLME D R. Genetic novelties in mitochondrial genomes of multicellular animals[J]. Current Opinion in Genetics & Development,1992,2(6): 918-925.
[16] OJALA D,MERKEL C,GELFAND R,et al. The tRNA genes punctuate the reading of genetic information in human mitochondrial DNA[J]. Cell,1980,22(2): 393-403.
[17] 中國科学院中国动物志编辑委员会主编. 中国动物志硬骨鱼纲鲤形目(下卷)[M]. 北京: 科学出版社,2000.
[18] 汪留全,胡 王. 我国鲫品种(系)资源及其生产性能的初步分析[J]. 水利渔业,1997,18(5): 4-6.
[19] 谢 楠,刘 凯,冯晓宇. 鲫鱼常见品种概述[J]. 杭州农业与科技,2016(4): 13-17.
[20] 张 辉,董新红,叶玉珍,等. 三个三倍体鲫鱼品系及野鲫mtDNA的比较研究[J]. 遗传学报,1998,25(4): 330-336.
[21] 刘良国,赵 俊,陈湘粦. 彭泽鲫两个雌核发育克隆与三个鲫鱼品系的RAPD分析[J]. 淡水渔业,2005,35(2): 13-16.
(责任编辑:成 平)

