1 株产单宁酶戊糖片球菌的筛选及功能评价
池耀卿,卢海强,王卫正,毛若雨,田洪涛,谷新晰
(1.河北农业大学 食品科技学院,河北 保定 071000;2.河北斐默特生物科技有限公司,河北石家庄 052460;3.中国农业科学院 饲料所,北京 10081)
单宁是一类天然多酚物质,广泛存在柿子、葡萄及山楂等水果中。单宁具有较强的生理活性,如抗氧化性、抗炎症活性和预防动脉粥样硬化的作用等,但食用过多的单宁往往会对身体造成不同程度的损伤,如单宁可与其他消化酶、淀粉和蛋白质形成复杂的反应,形成“柿结石”[1]。Sharma 等[2]人报道,摄入高浓度单宁可引起氨基酸和蛋白质大量排泄,消化道黏膜受损。此外,这些单宁也会对食品风味及口感造成极大影响。目前,物理法、化学法及生物酶法在单宁的消减中均取得了较好的效果。但是,食品除了基本的安全及营养诉求外,色、香、味、体等也是重要品质特征,这使得物理法和化学法在食品中单宁的消减中的应用受到限制,而生物酶解法因零污染、效率高、条件温和等优点已成为食品单宁物质消减的主要策略,其中单宁酶的挖掘是生物酶法的关键技术。
单宁酶(Tannase,EC 3.1.1.20) 是一类可水解单宁中的没食子酯键,释放葡萄糖和没食子酸的酶类[3],其广泛的分布在动物、植物和微生物中[4]。目前,微生物来源的单宁酶具有较高的酶活力、较好的稳定性及生产的便利等特征,是目前单宁酶的主要来源[5]。在过去150 多年来,许多研究小组对真菌单宁酶进行了深入分析,如青霉属和曲霉属[6],但乳酸菌单宁酶却鲜有报道,仅限于乳杆菌、酒球菌等。如Kanpiengjai 等[7]人从传统发酵茶叶分离出的戊酸乳杆菌BA-7 不仅可以降解单宁,还可以提高茶叶抗氧化能力。到目前为止,并未有其他乳酸菌产单宁酶的相关报道。乳酸菌是一类产乳酸细菌的总称,是一类重要的发酵食品生产用菌,并往往赋予产品特殊的生理功能,如抗氧化性、抑菌性能及肠道的免疫活性等。因此,挖掘具有单宁酶活性的乳酸菌具有重要的理论和应用价值。
本研究以筛选产单宁酶的乳酸菌为目标,开展菌株生物学特征、酶学性质表征及功能特征等研究,并进行菌株的基因组测定分析,进一步全面解析菌株的应用潜力,为菌株的开发利用提供一定的理论支撑。
1 材料与方法
1.1 材料
微生态制剂、金黄色葡萄球菌ATCC 25923、鼠伤寒沙门氏菌CGMCC 1.1190、大肠埃希菌ATCC 25922、单核细胞增生李斯特菌ATCC 19115 和弗氏志贺氏菌CGMCC1.1868 由本课题保存。
罗丹宁、没食子酸正丙酯 上海源叶生物科技有限公司;甲醇、柠檬酸、柠檬酸钠、胃蛋白酶、胰蛋白酶、牛胆盐 北京索莱宝科技有限公司;DPPH 梯希爱化成工业发展有限公司。
MRS 培养基:牛肉膏10 g、蛋白胨10 g、酵母浸粉5 g、葡萄糖20 g、无水乙酸钠5 g、柠檬酸铵2 g、磷酸氢二钾2 g、硫酸镁0.2 g、硫酸锰0.2 g、1 mL吐温80,蒸馏水1 000 mL,115 ℃灭菌20 min。发酵培养基:单宁酸1 g、蔗糖10 g、NaNO33 g、磷酸氢二钾1 g、KCL 0.5 g、MgSO4·7H2O 0.5 g,121 ℃灭菌20 min。单宁酶筛选培养基:100 mL MRS 培养基中加入溴甲酚紫0.04 g、单宁酸1 g,121 ℃灭菌20 min。
1.2 方法
1.2.1 菌株的筛选 将0.1 g 微生态制剂加入至无菌水中震荡活化2 h,随后将菌液梯度稀释,涂布至单宁酶筛选培养基中,37 ℃培养3~5 d,菌落周围出现黄色圈的菌株为阳性菌株,于4 ℃保存备用。将阳性菌株涂布于乳酸菌筛选培养基,37 ℃下培养24 h,挑取有透明圈的菌落并进行纯化,于4 ℃保存。参考Sharma 等[8]人的方法进行单宁酶活性测定,以每分钟生成1 μmol 没食子酸所需的酶量为1 个酶活力单位(U)。
1.2.2 菌株的鉴定 ①形态观察。将菌株STS-6 涂布于MRS 培养基平板,37 ℃倒置培养24 h,观察菌落的形状、大小、颜色、及生长状况等情况,并进行革兰氏染色。
②16S rDNA 分子鉴定。菌株STS-6 接种至100 mL 液体MRS,37 ℃摇床培养24 h,离心收集菌体。采用细菌基因组DNA 提取试剂盒(天根生物,DP302)提取基因组,并使用PCR 扩增引物27F(5'-AGAGTTTGATCCTGGCTCAG-3') 和1 492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR 反应。采用琼脂糖回收试剂盒(天根生物,DP209)进行PCR产物回收,并送至北京金唯智生物科技有限公司进行测序。采用软件BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性分析,采用软件MEGA 7.0构建系统发育树。
1.2.3 菌株STS-6 的生长及产酶特性分析。菌株STS-6 接种于50 mL 产酶培养基中,37 ℃摇床培养,每隔4 h 取1 次样,OD600测定吸光值及酶活力,绘制菌株的生长曲线及产酶曲线。将菌株STS-6 接种至产酶培养基中,37 ℃培养48 h 后,离心(12 000 r/min,10 min)收集菌体及发酵上清,收集备用。采用超声波破碎仪裂解菌体并溶解于缓冲液中,制备细胞内酶液。将细胞重悬于缓冲液中,制备菌体细胞溶液。分别测定细胞内酶液、菌体细胞及发酵上清的酶活力,探究产菌株的单宁酶分布特性。
1.2.4 单宁酶的酶学特性表征 ①温度对单宁酶活性的影响。参照1.2.1 中单宁酶测定方法,酶液与底物在20~90 ℃的温度条件下反应测定单宁酶的最适反应温度,以最高酶活力为100%。将酶液分别在50 ℃和70 ℃处理0、5、10、20、30 和60 min,在最适温度和pH 条件下测定单宁酶活性,分析其温度稳定性。以未经处理的酶液做对照,其酶活力定为100%。
②pH 对单宁酶活性的影响。在最适温度条件下,酶液与不同pH(2.0~12.0)的底物进行反应,测定单宁酶最适pH,以最高酶活力为100%。将酶液置于不同pH(2.0~12.0)缓冲液中,冰浴1 h 后,在最适温度和pH 条件下测定单宁酶活性,分析其pH 稳定性,以未经处理的酶液做对照,其酶活力定为100%。
③金属离子和化学试剂对单宁酶活性的影响。在标准反应体系中分别加入金属离子、表面活性剂SDS、吐温80、CTAB、金属离子螯合剂EDTA 及甲醇、乙醇和异丙醇等有机试剂,使其终摩尔浓度分别为1 和5 mmol/L,按照标准方法进行酶活力的测定,以未处理的酶液为对照组,其酶活力定为100%。
1.2.5 菌株STS-6 的益生功能特性分析 ①菌株胃肠液耐受性测定。参考Jeon 等[9]人方法对菌株STS-6 和商业菌株植物乳杆菌ST-Ⅲ(Lactobacillus plantarumST-Ⅲ)分别进行胃肠液耐受性分析。
②菌株自聚和共聚能力测定。参考Huang 等[10]人方法分别对菌株STS-6 和植物乳杆菌ST-Ⅲ进行自聚能力和共聚能力分析。
③抗氧化能力的测定。将菌株STS-6 接种至MRS培养基中,37 ℃培养24 h 后,离心(12 000 r/min,10 min),收集上清液,并通过冷冻干燥机冻干成粉末。称取1、2、3、4、5、6 mg 粉末分别溶于1 mL蒸馏水中,配制成浓度为1~6 mg/mL 的待测样品。参考Ilavenil 等[11]人的方法进行清除DPPH 自由基能力测定;参考Wang 等人[12]的方法进行总还原能力的测定;参考Ines 等人[13]的方法进行DNA 损伤保护测定。
1.2.6 菌株STS-6 的基因组测序及数据分析 采用Illumina Hiseq 和PacBio 的测序方式对菌株STS-6进行全基因组测序,利用Glimmer,GeneMarkS,Prodigal 软件对基因组中的编码基因(CDS)进行预测,并对预测得到的编码基因进行功能注释,探究益生基因的分布研究。
2 结果与分析
2.1 菌株的筛选及鉴定
从微生态制剂中筛选出1 株高产单宁酶的乳酸菌STS-6(图1 A),菌株STS-6 在MRS 培养基中菌落呈圆形,乳白色,光滑,凸起,边缘整齐,不透明(图1 B),为革兰氏阳性菌,菌体形态为球状,符合乳酸菌外观特征(图1 C)。经序列比对及进化树分析,菌株STS-6 与P.pentosaceus亲缘性最高,序列一致性99%以上(图1 D)。

图1 菌株STS-6 的鉴定Fig. 1 Identification of strain STS-6
2.2 菌株STS-6 的生长及产酶特性分析
菌株STS-6 生长变化情况如图2 A 所示,该菌以体积分数1%接菌培养8 h 进入稳定期。通过对单宁酶活力测定分析,单宁酶的产量随着培养时间的增加,表现出先增加再减少的趋势。该菌随着菌株的生长,单宁酶的产量也在逐渐增加,直至培养36 h,单宁酶的产量达到最大值,为1.6 U/mL,随后单宁酶的产量则逐渐降低。

图2 菌株STS-6 的生长及产酶特性Fig. 2 Growth and enzyme-producing characteristics of strain STS-6
经测定,菌株STS-6 的多个部位均检测到单宁酶活性(图2 B),其中发酵上清酶活力最高(约55 %),除此以外,在细胞及细胞内具有一定的酶活力,上述结果表明菌株STS-6 产生的单宁酶主要以胞外酶为主。
2.3 酶学性质分析
2.3.1 温度对单宁酶活力的影响 研究发现该单宁酶在20~90 ℃温度范围内均表现出一定的酶活力,最适温度为60 ℃,在40~80 ℃之间表现出60%以上的酶活力(图3 A),即使反应温度为90 ℃时,也可表现出20%的酶活力。如图3 B 所示,该单宁酶表现出较好的稳定性,在50 ℃温度条件下处理60 min 后,酶活力维持在87%以上,而在70 ℃温度条件下处理60 min 后,仍保持70%以上的酶活力。
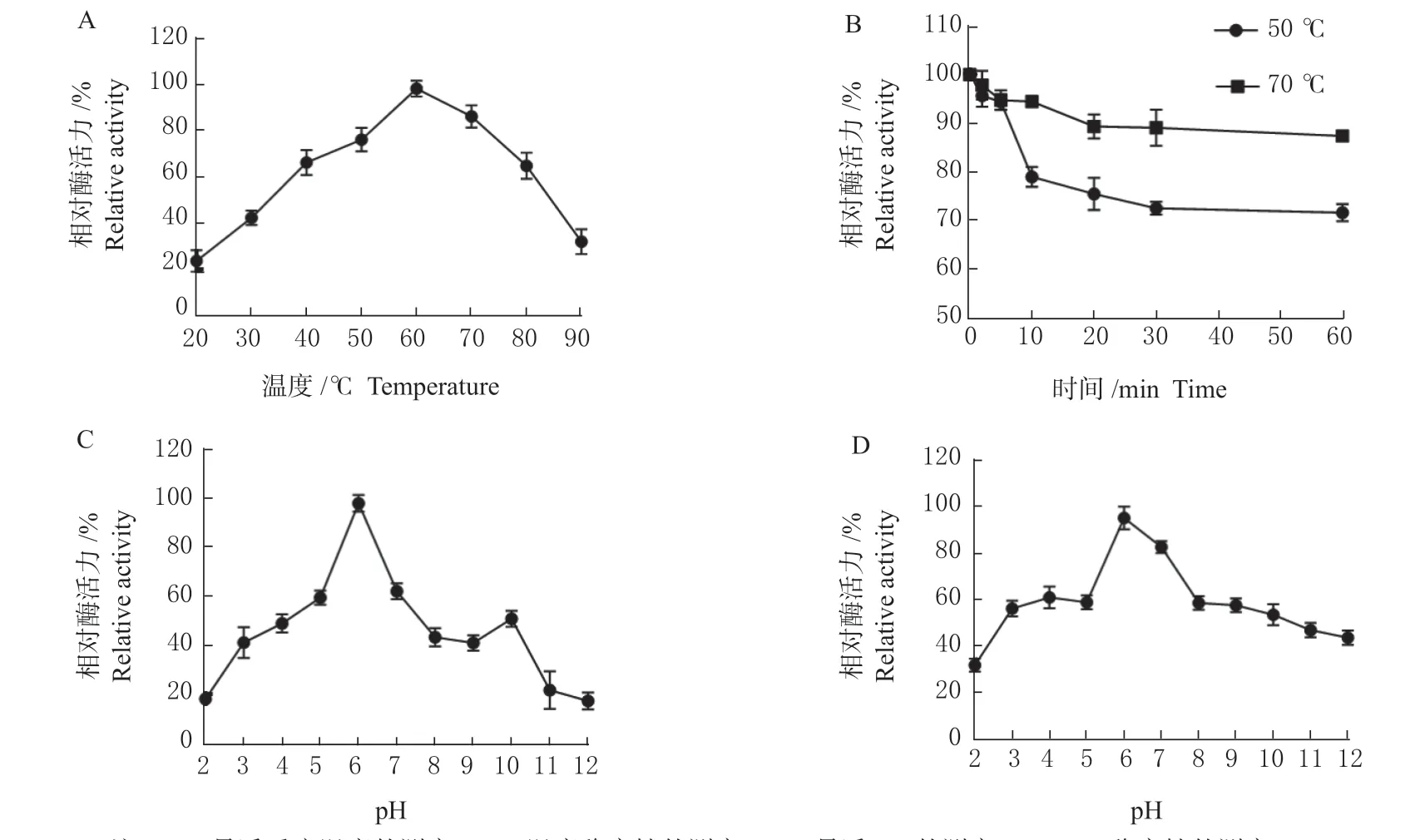
图3 菌株STS-6 单宁酶的酶学性质Fig. 3 Enzymatic properties of tannase in STS-6 strain
2.3.2 pH 对STS-6 单宁酶活力的影响 在60 ℃温度条件下,测定了该单宁酶在pH 2.0~12.0 的单宁酶活性,结果如图3 C 所示。该单宁酶最适pH 为6.0,在pH 5.0~7.0 内酶活力可维持在60.0%以上。将该单宁酶酶液置于不同pH 条件下,0 ℃保温1 h 后,测定该单宁酶残余酶活力,由图3 D 可知,该酶在pH 3.0~9.0 之间残余酶活力均保持在50%以上。
2.3.3 金属离子及化学试剂对单宁酶活力的影响在低离子浓度(1 mmol/L)条件下,Na+、Ag+、Ca2+均对单宁酶的酶活性有促进作用,其中Na+可使单宁酶活力提高约11%。而其它金属离子则对单宁酶活力表现出不同程度的抑制作用,其中Zn2+、Cu2+和Fe3+抑制作用较强,使单宁酶活力均小于25%。在高离子浓度下(5 mmol/L)的金属离子均使单宁酶活性受到抑制,其中Zn2+可使单宁酶失活(见表 1)。
11 种化学试剂对单宁酶活力均有不同程度的抑制作用,EDTA、SDS、吐温80、尿素、甲醇、丙三醇、异丙醇及丙酮对单宁酶的抑制作用随着添加量的增大而增强。在5 mmol/L EDTA 条件下,单宁酶活性显著下降至(25.32±0.26)%。吐温 80、CTAB 和丙酮均表现出非常强抑制作用,5 mmol/L 的吐温80几乎完全抑制了单宁酶活力,甲醇、乙醇、异丙醇及丙酮(极性溶剂)会抑制酶的活性(见表 1)。

表1 金属离子和化学试剂对菌株STS-6 单宁酶的影响Table 1 Effects of metal ions and chemical reagents on tannase of strain STS-6
2.4 菌株STS-6 的益生功能特性分析
2.4.1 胃肠液耐受性分析 菌株STS-6 在模拟人工胃肠液条件下的存活率较高(表 2),菌株STS-6 在经过0.3% 胃蛋白酶处理3 h 后活菌数能达到(7.57±0.43)×108CFU/mL,存活率高达94.17%。在人工肠液中,菌株STS-6 活菌数达到(5.17±0.57)×108CFU/mL,存活率达到92.36%。菌株STS-6 在人工胃肠液中的耐受性均高于菌株ST-Ⅲ。结果表明,菌株STS-6 具有较好的胃肠道环境耐受能力。
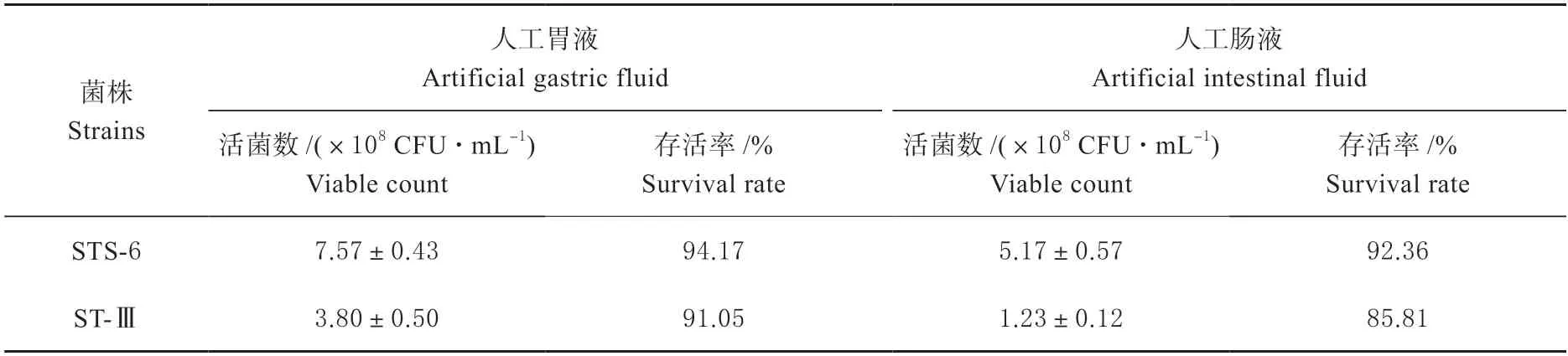
表2 菌株STS-6 和ST-Ⅲ在人工模拟肠液和胃液条件下的耐受性Table 2 Tolerance of strains STS-6 and ST-III under artificial simulated gastric fluid and intestinal fluid conditions
2.4.2 自聚和共聚能力分析 菌株STS-6 和ST-Ⅲ在4 h 后的自聚集分别为(65.34±2.80)% 和(51.58±2.17)%。24 h 后,分别为(82.78±3.39)%和(69.74±2.31)%(表 3)。STS-6 在4 和24 h 后 与单核细胞增生李斯特菌的共聚集性均低于ST-Ⅲ,STS-6 与其它指示菌的共聚性均高于ST-Ⅲ(表 3),STS-6 和ST-Ⅲ在24 h 后与鼠伤寒沙门氏菌共聚集性最高分别为(75.14±1.05)% 和(67.00±1.61)%。结果表明,菌株STS-6 表现出较好的自聚和共聚能力。

表3 菌株STS-6 和ST-Ⅲ的自聚、共聚能力Table 3 Autoaggregation and copolymerization ability of strain STS-6 and ST-III
2.4.3 抗氧化活性分析 菌株STS-6 发酵上清液对DPPH 具有高抗氧化活性(图4 A),最高可达到71.15%,清除活性随着浓度的增加而增加。发酵上清液具有一定的还原能力(图4 A),表现出随浓度增加而增强的趋势,当菌液上清浓度为1 mg/mL 时,A700nm为0.17,浓度为6 mg/mL 时,A700nm为0.83。

图4 戊糖片球菌STS-6 的抗氧化能力分析Fig. 4 Analysis of antioxidant capacity of P.pentosaceus STS-6
菌株STS-6 发酵上清液对质粒DNA 损伤表现出较好的保护作用(图4 B)。用Fenton 试剂孵育质粒DNA,导致DNA 带完全降解,通过Gel-Pro Analyzer 对条带进行灰度值分析,发现发酵上清液加入量为20 和30 μL 时,DNA 损伤程度逐渐减小,条带亮度损伤保护力分别为20.77%和59.54%。表明发酵上清液对DNA 损伤有较强的抑制作用。
2.5 戊糖片球菌STS-6 的全基因组概况
P.pentosaceusSTS-6 的基因组由1 个1 744 964 bp 的环状染色体和3 个质粒构成,其质粒片段总长度分别为9 808、57 772 和12 238 bp。GC 含量为37.28%,包含1 767 个编码基因,占整个基因组的87.86%。其中,NR、Swiss-Prot、Pfam、COG 分别注释了1 761、1 384、1 539、1 486 个基因。
2.6 益生特性相关基因分析
菌株P.pentosaceusSTS-6 的潜在益生特性在全基因组分析数据中得到了有力支撑(表 4)。本研究中从基因组测序结果中发现了8 个与酸耐受性相关的基因(F0F1 ATP 合成酶)和1 个胆盐抗性相关的胆盐水解酶(bsh)基因。此外,菌株P.pentosaceusSTS-6 全基因组中还检测出5 个热应激基因及5 个氧应激的相关基因,这些酶可以有效防止不利环境对菌株造成的损伤[14]。

表4 戊糖片球菌STS-6 的益生基因分布Table 4 Prebiotic gene distribution of P. pentosaceus STS-6
2.7 单宁酶基因预测
经研究发现,戊糖片球菌STS-6 中gene0906 基因与植物乳杆菌JDM1 单宁酶基因(ACT61979.1)氨基酸序列一致性为42.9%。gene0906 基因共编码259 个氨基酸,无信号肽,含有单宁酶的五肽活性位点基序(Gly103-Ser104-Se105r-Ala106-Gly107)。除此以外,该蛋白包含2 个保守结构域,分别为Aes 结构域(乙酰酯酶/脂肪酶)和Abhydrolase-3 结构域(α/β 水解酶折叠)。De 等[15]人报道非“CS-D-HC”单宁酶基因包含上述2 个结构域。gene0906 基因与非“CS-D-HC”单宁酶基因特征相似,但存在差异,可能是由于gene0906 基因自身特异性造成,但还需进一步对该基因进行性质表征研究。
3 结论与讨论
本研究成功筛选获得1 株产单宁酶的戊糖片球菌STS-6。菌株STS-6 所产单宁酶在40~80℃的温度范围内具有较高的活性,在60℃时具有最大酶活性。大多数单宁酶的最佳温度在30~40℃之间[16],也有嗜热单宁酶报道,但它们往往来自真菌,如Shao 等人[17]报道黑曲霉FJ0118 的单宁酶最适反应温度为80 ℃。到目前为止,菌株STS-6 是为数不多的细菌来源的嗜热单宁酶生产菌。除此以外,该菌单宁酶表现出极好的温度稳定性。较好的热稳定性能有利于的单宁酶的生产、储存及运输,在实际应用中往往表现出更好的应用前景。菌株STS-6虽单宁酶活力较低,但接下来的研究可通过发酵条件优化或构建单宁酶高效表达重组菌株等手段,提高单宁酶活性。通过全基因组进一步分析发现,该菌株中存在1 个疑似单宁酶基因gene0906。之前报道的单宁酶多为亚型A 和亚型B 单宁酶,这2 种单宁酶基因大约有470~600 个氨基酸,本研究中单宁酶基因仅有259 个氨基酸,但通过预测gene0906基因可能为新单宁酶基因,此单宁酶的发现可能进一步丰富单宁酶类别。
戊糖片球菌在乳酸菌应用中发挥着越来越重要的作用。近年来从发酵食品、水产品、动物、植物和粪便中分离出的许多戊糖片球菌可用作动物生长生物促进剂,食品的生物防腐剂,或者作为新兴的益生菌候选物应用于发酵中[18]。然而,迄今为止,与戊糖片球菌作为益生菌的相关的问题仍未解决,如缺乏益生特性相关机制探究。乳酸菌菌株要获得潜在的益生菌状态,对胃肠道环境的耐受性至关重要。有研究表明,在模拟胃肠液中菌体发挥功能特性的活菌数临界值为107CFU/mL[19]。本研究中戊糖片球菌STS-6 菌株胃肠液中活菌数均高于108CFU/mL,可达到菌体发挥功能特性活菌数临界值,并且存活率分别高达94.17%、92.36%,表现出较好的人工胃肠液耐受性。夏勒合特·巴克尔拜等人[20]从传统泡菜中筛选出的5 株乳酸菌在肠液中3 h 存活率均达到85%以上。本研究通过全基因组测序检测到菌株STS-6 含有Na+/H+反转运蛋白基因nhaK和胆酰甘氨酸水解酶基因bsh,这很可能是该菌株具有较强的肠胃耐受性的关键。Qureshi 等[21]人的研究证明Na+/H+反转运蛋白、胆酰甘氨酸水解酶与胃肠道耐受性有关。
自聚集作用使菌株能够与肠上皮细胞有效结合,从而提高微生物在胃肠道中的滞留能力,共聚集作用可以阻止病原体在胃肠道定植。Zarali 等人[22]从发酵发芽三叶草种子分离的戊糖片球菌自聚集能力为35.51%,与大肠杆菌共聚集能力为48.71%。Padmavathi 等人[23]筛选的7 株乳酸菌自聚集能力为51.02%~78.95%。本研究中戊糖片球菌STS-6的自聚集能力在24 h 后可达到(82.78±3.39)%,同时与指示菌均有较高的共聚集能力,最高可达到(73.27±0.38)%,结果表明戊糖片球菌STS-6 可以在宿主肠道内很好的定殖,并通过阻止病原微生物的附着形成良好的屏障。
乳酸菌作为功能性发酵剂和潜在的益生菌,其抗氧化活性是极其重要的。本研究发现菌株STS-6的发酵上清表现出较好抗氧化活性。通过全基因组测序进一步分析发现,该菌株存在多个抗氧化基因。例如,该菌株含有硫氧还蛋白arsC 基因,可为硫醇依赖性过氧化物酶提供电子,并参与ROS 和RNS的清除[14]。此外,与应激反应相关的蛋白酶基因也被检测到,如atp 依赖性细胞内蛋白酶clpP 和hslV 基因,在防止蛋白质异常损伤方面具有重要作用[24]。另外还发现了过氧化氢酶基因cotJC。
在本研究中成功筛选获得1 株产单宁酶的戊糖片球菌(P.pentosaceusSTS-6),该菌株单宁酶以胞外分泌为主,最高酶活力为1.6 U/mL。该菌具有较好的胃肠液耐受性,具有较高的自聚集和共聚集能力,发酵上清液表现出较高的抗氧化活性。除此以外,该菌株基因组中含有多个益生特性相关基因和1 个疑似单宁酶基因。综上所述,P.pentosaceusSTS-6 是1 株优良的产单宁酶且具有良好益生特性的菌株,在食品发酵中具有广阔的应用前景。
——“单宁”

