基于WES 识别中国人群甲状腺乳头状癌新易感基因变异EPB41L4A rs1455421289
闫 安 关煦慧子 蔚 田 缪 刚 赵艳阳
(1.北京医院/北京老年医学研究所 国家老年医学中心,北京 100730;2.北京医院普通外科,北京 100730)
近年来,我国甲状腺癌的发病率呈快速升高趋势,2017年新增的患者例数已居全球甲状腺癌新增患者例数首位[1-2]。目前,甲状腺癌的诊断主要依靠B超引导下甲状腺穿刺活检,但其存在明显不足:1)属于有创检查,且穿刺覆盖面有限,易漏诊;2)主要针对>1 cm的结节[3],不适用于早期诊断;3)仅可获取微量细胞,准确诊断需要经验丰富的影像学和病理学医师,基层医疗机构难以开展。因此,寻找适用于甲状腺癌早期筛查的特异性生物标志物是目前亟待解决的问题。识别新的甲状腺癌易感基因可以为寻找早期筛查甲状腺癌高危人群的生物标志物提供依据。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)遗传病因学研究发现,PTC发病具有较强的家族遗传倾向[4-8]和高遗传异质性[5]。家族性PTC占甲状腺癌总发病的5%~10%[9]。大型流行病学研究结果提示甲状腺癌患者的一级亲属是该病的高发人群[4,10],一级亲属的患病风险较对照者高6.8倍[4],其中双胞胎同胞的患病风险比对照者高23倍[10]。
目前,国内外学者相继完成了7项甲状腺癌全基因组关联研究(genome-wide association study,GWAS),并在人类基因组中定位了28个PTC风险位点,如位于红细胞膜蛋白带4.1样4A(erythrocyte membrane protein band 4.1 like 4A,EPB41L4A)基因非编码区的rs73227498位点[11]。GWAS结果提示与这些风险位点连锁的基因中可能存在PTC的易感基因变异。为验证这一推测,本研究拟对我国500例无血缘关系的散发PTC患者的外周血白细胞基因组DNA进行全外显子组测序(whole exome sequencing,WES),靶向分析GWAS定位的28个候选基因的蛋白编码区和侧翼选择性剪接位点序列中潜在影响蛋白编码的罕见变异,并利用多个大型非肿瘤对照人群的高质量基因分型数据进行病例-对照关联分析和变异的功能研究,识别中国人群PTC的新易感基因变异,为寻找可用于甲状腺癌早期筛查且易于检测的特异性生物标志物提供依据。
1 材料和方法
1.1 研究对象
选取2018—2020年北京医院行手术治疗的286例PTC患者,其中男81例、女205例,年龄21~80岁,用于识别PTC候选基因的变异位点。另选取2021—2022年北京医院行手术治疗的214例PTC患者,其中男73例、女141例,年龄25~83岁,用于验证变异位点的突变频率。500例PTC患者均为散发的、无血缘关系的中国汉族人,其中56例仅有颈部淋巴转移,70例仅有甲状腺外侵袭,66例同时有颈部淋巴转移和甲状腺外侵袭。纳入标准:1)术后经病理学检查确诊为PTC;2)能够获取外周血白细胞计数结果和甲状腺癌组织、癌旁组织。排除标准:1)伴有其他部位、其他类型的原发性恶性肿瘤;2)有血缘关系的PTC患者。对照人群的基因分型数据均来自公共数据库的高质量WES和全基因组测序数据,包括gnomAD数据库和TOPMed数据库(包含多人种非肿瘤人群数据)和ChinaMAP数据库、HUABIAO数据库(包含非肿瘤中国人群的数据)。本研究经北京医院伦理委员会批准(2021BJYYEC-044-02),所有研究对象均知情同意。
1.2 候选基因
GWAS定位的28个PTC候选基因[12-18]为:ARSB、BATF、DIRC3、EPB41L4A、FHIT、FOXA2、FOXE1、GALNT18、HTR1B、IMMP2L、INSR、MBIP、MSRB3、NKX2-1、NREP、NRG1、PCNX2、PTCSC3、RARRES1、SEPTIN11、SLC8B1、SMAD3、SNAPC4、SPATA13、STN1、TERT、VAV3和WDR11。
1.3 方法
采集所有患者外周静脉血2 mL,室温条件下离心分离白细胞。采用酚-氯仿法抽提白细胞DNA。采用TRIzol试剂(美国Invitrogen公司)提取外周血白细胞和癌组织、癌旁组织的总RNA。取1 μg白细胞基因组DNA,采用SureSelect Human All Exon V6 and V8试剂盒(美国安捷伦公司)建库,在Novaseq S6000高通量测序平台(美国Illumina公司)进行150 bp双端测序。原始测序数据经质控筛选,采用BWA(ver 0.7.15-r1140)软件与人类基因组参考序列GRCh37进行比对,由ANNOVAR分析软件完成变异注释。随后靶向分析28个PTC关联基因的蛋白编码区及其侧翼选择性剪接序列,筛选出符合下列条件的变异:1)人群中变异频率<0.1%;2)物种间高度保守;3)生物信息学预测存在损伤蛋白结构和/或功能的单核苷酸变异和微小缺失/插入变异。各物种的蛋白氨基酸序列下载自美国国立生物技术信息中心(the National Center for Biotechnology Information,NCBI)数据库,采用Cluster 3.0软件进行氨基酸同源比对分析。
采用等位基因特异性定量聚合酶链反应(allele-specific quantitative polymerase chain reaction,AS-qPCR)检测PTC患者组织或白细胞mRNA 中候选变异的等位基因表达情况,以管家基因EIF4H作为内参。EPB41L4Ars1455421289变异的等位基因特异性引物:野生型等位基因上游引物为5'-GACCACGTATTCCATCACGTAAACCTTGTGGAGATCG-3',下游引物为5'-CCAAAATACAAAGTATATGGAGGTCCAGTGTTGA-3';突变型等位基因上游引物为5'-GACCACGTATTCCATCACGTAAACCTTGTGGAGATCC-3',下游引物为5'-GACGGCCCTGAAGGACATCTTGCT-3'。
采用AS-qPCR检测所有患者外周血白细胞基因组DNA 中候选变异野生型和突变型等位基因的拷贝数变化。以单拷贝基因FOXP2的DNA拷贝数作为内参。EPB41L4Ars1455421289变异的等位基因特异性引物:野生型等位基因上游引物为5'-GACCACGTATTCCATCACGTAAACCTTGTGGAGATCC-3',突变型等位基因上游引物为5'-GACCACGTATTCCATCACGTAAACCTTGTGGAGATCG-3',共用的下游引物为5'-CCACCTAAAACCATATCAGGAAAAGCCAGAG-3'。
1.4 统计学方法
采用SPSS 16.0软件进行统计分析。通过病例-对照关联检测评估变异位点对PTC发病风险的影响,采用比值比(odds ratio,OR)值和95%可信区间(confidence interval,CI)表示风险程度。采用Fisher精确检验比较2个组之间变异携带频率的差异。采用Mann-WhitneyU检验比较变异等位基因表达和基因组拷贝数变化。以P<0.05为差异有统计学意义。
2 结果
2.1 WES结合靶向分析识别PTC的候选变异
WES的测序深度为97.74×~269.96×,平均测序深度为126.50×。有97.85%的碱基测序深度>10×。靶向分析共发现121个发生在蛋白编码区的单核苷酸变异,未发现微小缺失/插入变异。位于EPB41L4A基因上的2个极罕见错义突变[rs1455421289位点c.163G>C:p.D55H(chr5:112307427,NM_001347887.2)和rs761977647位点c.855G>C:p.W285C(chr5:111576448,NM_001347887.2)]潜在影响了编码蛋白的功能。rs1455421289是EPB41L4A基因蛋白编码序列上第165位G到C的碱基突变,该碱基转换导致第55位的天冬氨酸转变为组氨酸。rs761977647是EPB41L4A基因蛋白编码序列上第855位G到C的碱基变异,该碱基转换导致蛋白第285位的色氨酸突变为半光氨酸。生物信息学软件SIFT、PolyPhen-2和CADD的预测分析结果显示,rs1455421289位点c.163G>C:p.D55H突变和rs761977647位点c.855G>C:p.W285C突变可能损伤EPB41L4A蛋白的结构或功能,见表1和图1。这2个错义突变的野生型氨基酸在物种进化上呈现高度保守,见图2。
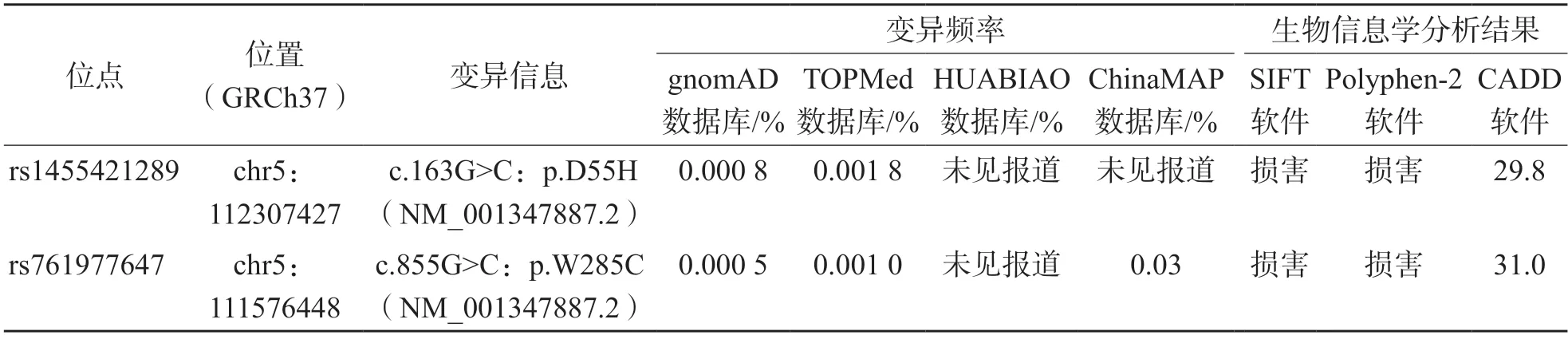
表1 EPB41L4A基因2个极罕见错义突变分析
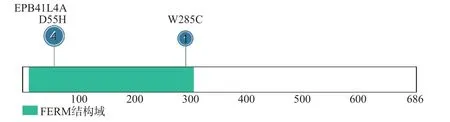
图1 rs1455421289位点c.163G>C:p.D55H变异和rs761977647位点c.855G>C:p.W285C变异在EPB41L4A蛋白氨基酸一级结构中的分布
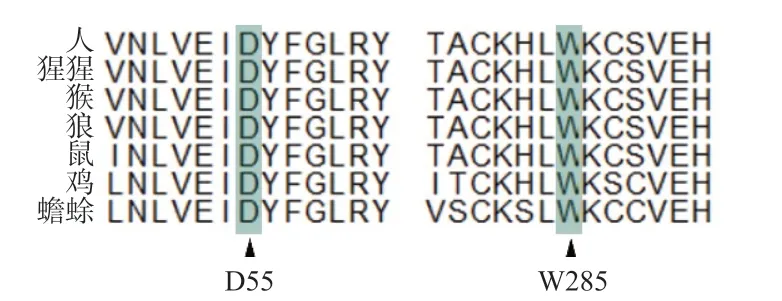
图2 rs1455421289位点和rs761977647位点的野生型氨基酸残基在物种间的进化保守性分析
286例PTC患者中,有3例携带rs1455421289位点c.163G>C:p.D55H 变异,1 例携带rs761977647位点c.855G>C:p.W285C变异。这2个位点在4个对照人群(gnomAD数据库、TOPMed数据库、ChinaMAP数据库、HUABIAO数据库)中的携带频率均<0.05%,见表1。
在214 例PTC 患者中,有1 例携带rs1455421289位点c.163G>C:p.D55H变异,未发现rs761977647位点c.855G>C:p.W285C变异。在所有500例PTC患者中,rs1455421289的突变频率为0.8%(4/500),rs761977647的突变频率为0.2%(1/500)。
2.2 rs1455421289变异的病例-对照关联分析
以4个大型人群数据库(gnomAD数据库、TOPMed数据库、ChinaMAP数据库、HUABIAO数据库)中的282 120名非肿瘤个体的高质量基因分型数据作为对照,分别与PTC患者进行病例-对照关联分析,其中gnomAD数据库(134 187名)和TOPMed数据库(132 345名)是非中国人群的基因分型数据,ChinaMAP(10 588名)和HUABIAO(5 000名)是中国人群的基因分型数据。在gnomAD数据库和TOPMed数据库的对照人群中,分别有2名和5名携带rs1455421289 位点c.163G>C:p.D55H变异,而ChinaMAP数据库和HUABIAO数据库中无个体携带该变异,因此正常人群该位点的突变频率为0.002 5%(7/282 120)。与4个对照人群比较,携带rs1455421289位点c.163G>C:p.D55H变异者PTC发生风险显著升高(OR值分别为40.3、85.4、213.5、541.1,95%CI分别为4.5~361.5、9.5~765.4、57.2~797.2、98.9~2 960.8,P<0.001 )。
2.3 rs1455421289变异的功能分析
在变异携带者的癌组织、癌旁组织中,EPB41L4A基因突变型的mRNA相对表达量均显著高于野生型mRNA(P<0.01)。在变异携带者外周血白细胞mRNA中,野生型等位基因G和突变型等位基因C的相对拷贝数差异无统计学意义(P>0.05)。见图3。

图3 EPB41L4A基因rs1455421289位点野生型和突变型等位基因表达和基因组拷贝数比较
3 讨论
识别甲状腺癌新易感基因对甲状腺癌高危人群的早期筛查和健康监测具有潜在的临床应用价值。为精细定位甲状腺癌的遗传病因,研究人员在欧洲和亚洲人群中分别进行了数次甲状腺癌GWAS[11-12,19],并在人类染色体8p12、9q22.33和14q13.3上频繁定位到PTC的关联信号[11-12,19-20]。染色体的定位数据提示与这3个区域紧密连锁的基因NRG1(8p12)、FOXE1(9q22.33)和NKX2-1(14q13.3)中可能存在PTC的易感变异。然而,本研究对500例中国汉族PTC患者的这些基因进行蛋白编码区和选择性剪接位点的靶向测序分析,未发现潜在的、损害蛋白结构或功能的变异位点。本研究的数据提示PTC具有较强的遗传异质性。这3个候选基因的蛋白非编码区也可能存在增加PTC风险的表达数量性状变异位点(expression quantitative trait locus,eQTL)[12]。
EPB41L4A基因编码的蛋白属于FERM蛋白家族。该蛋白家族主要参与调节细胞骨架的重排、细胞内运输和WNT/β-catenin癌信号的传递[21]。EPB41L4A在正常甲状腺组织中的表达丰度较高,但其在甲状腺癌中的作用尚不明确。2017年,一项基于冰岛人群PTC的GWAS在EPB41L4A基因下游12 kb处识别到1个与PTC关联的常见变异rs73227498A>T(OR=1.37,95%CI为1.23~1.49)[11]。后续的功能实验数据显示,与携带rs73227498野生基因型AA的患者比较,携带纯和变异基因型TT的患者甲状腺组织中EPB41L4A的mRNA及其非编码RNA(EPB41L4A-203)的表达均显著增加[22]。该结果提示rs73227498变异可能以顺式调控的机制影响上游基因EPB41L4A在PTC患者甲状腺组织中的表达。
本研究通过对候选基因EPB41L4A进行靶向测序,在4个无亲缘关系的中国PTC患者中识别到1个频发的新PTC易感变异rs1455421289(c.163G>C:p.D55H),其在患者中的突变频率为0.8%(4/500)。在包括15 588名中国对照个体在内的282 120名非肿瘤对照人群中,仅有7名个体携带该突变,这一突变在正常个体中的突变频率为0.002 5%(7/282 120)。罕见rs1455421289C位点变异携带者的PTC发生风险显著增加(P<0.001)。
rs1455421289(c.G163C:p.D55H)罕见错义突变位于EPB41L4A基因的FERM功能结构域,氨基酸残基D55在进化中高度保守,提示该天冬氨酸可能在维系EPB41L4A蛋白的正常结构和功能中发挥重要作用。本研究的功能实验数据表明,rs1455421289(c.G163C:p.D55H)变异是一个功能性蛋白编码变异,其C等位基因(突变型)显著地增加了患者甲状腺组织和外周血白细胞中突变mRNA的表达丰度。在变异携带患者的DNA中,本研究对该变异位点的野生型和突变型等位基因的拷贝数进行分析,排除了突变型mRNA表达丰度的升高是由突变型等位基因拷贝数增加所致。这提示该变异可能增强了患者甲状腺细胞中突变mRNA的转录和/或增加了突变mRNA的稳定性。结合rs1455421289在正常对照人群中的变异频率、PTC的发生风险,以及生物信息学预测和功能实验证据,本研究将EPB41L4A(c.G163C:p.D55H)变异判定为潜在致病性变异。
综上所述,本研究基于WES识别出1个中国人群PTC的高风险变异rs1455421289,在大样本量PTC患者中验证该变异的突变频率有助于进一步明确其在PTC发生中的遗传风险。此外,进一步探讨该罕见突变的生物学功能也有助于认识EPB41L4A基因在甲状腺癌发生中的作用机制。

