血清miR-140-5p、PGC-1α mRNA 表达与急性缺血性脑卒中患者血管性认知障碍的相关性
朱 倩 褚丽芳 马彩云 姚 洁
(石家庄市人民医院神经内科一病区,河北 石家庄 050011)
卒中居我国居民死亡原因的第3位,急性缺血性脑卒中(acute ischemic stroke,AIS)是最常见的卒中类型,我国AIS患病率为1 255.9/10万,年发病率为144.8/10万,死亡率为62.2/10万[1-2]。有研究结果显示,卒中患者发病后认知障碍的发生率高达30%,血管性认知障碍(vascular cognitive impairment,VCI)居痴呆原因的第2位,仅次于阿尔茨海默病[3]。因此,早期预测AIS后VCI发生意义重大。有研究发现,神经发生和神经氧化应激、炎症反应参与了VCI的发生、发展[4]。微小RNA(microRNA,miRNA)是内源性小分子RNA,能通过调节神经发生参与VCI的发生、发展[5]。miR-140-5p是新近发现的一种miRNA,在出血性脑卒中患者血液中表达上调,与神经缺损程度和预后有关[6]。动物实验结果显示,miR-140-5p参与了大鼠脑出血后的神经发生[7]。过氧化物酶体增殖物激活受体γ共激活剂1α(peroxisome-proliferator-activated receptor gamma coactivator-1 alpha,PGC-1α)是一种转录共激活因子,能通过抑制活性氧产生来抑制氧化应激和炎症反应[8]。动物实验结果显示,PGC-1α参与调节缺氧缺血性脑病大鼠神经氧化应激和神经炎症[9]。目前,关于血清miR-140-5p、PGC-1α表达与AIS患者VCI发生的关系的报道较少。本研究拟探讨血清miR-140-5p、PGC-1α水平与AIS患者发生VCI的关系,旨在为早期防治VCI提供依据。
1 材料和方法
1.1 研究对象
选取2020年1月—2022年1月石家庄市人民医院AIS患者163例,其中男114例、女49例,年龄(59.86±8.62)岁,体重指数为(21.53±2.87)kg/m2;受教育程度:小学及以下34例、中学48例、大学81例。纳入标准:1)经颅脑电子计算机断层扫描(computed tomography,CT)/磁共振成像(magnetic resonance imaging,MRI)确诊为AIS,符合《中国急性缺血性脑卒中诊治指南2018》[10]中的诊断标准;2)年龄≥18岁;3)临床资料完整;4)患者或家属知情并签署同意书。排除标准:1)既往认知功能障碍;2)近3个月内有颅脑手术史或外伤史;3)因精神疾病、失语、听力障碍、视力障碍等不能完成神经心理测试;4)合并造血、免疫系统损伤;5)不能接受随访;6)合并恶性肿瘤。另选取同期石家庄市人民医院体检健康者57名作为正常对照组,其中男40名、女17名,年龄(57.88±7.18)岁,体重指数为(21.47±1.88)kg/m2;受教育程度:小学及以下12例、中学17例、大学28例。2个组年龄、性别、体重指数和受教育程度差异均无统计学意义(P>0.05)。本研究经石家庄市人民医院伦理委员会批准(院科伦审〔2019〕第69号),所有研究对象或家属均知情同意。
1.2 方法
1.2.1 一般资料收集
收集AIS患者的一般资料,包括性别、年龄、体重指数、受教育程度、吸烟史、饮酒史、基础疾病(包括高血压、糖尿病、高脂血症)、病灶位置(脑叶、脑干、白质、基底节、丘脑)和入院时美国国立卫生研究院卒中量表(the National Institute of Health Stroke Scale,NIHSS)评分[11]。
1.2.2 miR-140-5p和PGC-1α mRNA检测
采集AIS患者入院次日和体检者体检当日清晨空腹静脉血3 mL,1 007×g离心15 min,分离血清,-80 ℃冰箱保存。采用Trizol试剂盒(货号ALH011,北京百奥莱博科技有限公司)提取总RNA,采用NanoDrop微量分光光度计(美国ThermoFisher Scientific公司)验证纯度、浓度合格(A260nm/A280nm比值为1.8~2.0)后,采用反转录试剂盒(货号RR036A,日本TaKaRa公司)将RNA逆转录成cDNA。以cDNA为模板,采用VeritiPro PCR仪(美国ABI公司)和SYBR Premix Ex Taq试剂盒(货号DRR820A,上海赫果生物科技有限公司)进行聚合酶链反应(polymerase chain reaction,PCR)扩增,引物设计和合成由上海剑钝生物科技有限公司完成。miR-140-5p正向引物为5'-TAACCGCAGAGGTCACACTCAG-3',反向引物为5'-CTCAGAAACTGTGGCATCCCGA-3'。miR-140-5p 内参U6 正向引物为5'-ACTTTCACGCCGCTCATCCAGT-3',反向引物为5'-TCTCAGGACTGGTTCACAGCGT-3'。PGC-1α正向引物为5'-TAATCTCAGCTGGCAACTGTG-3',反向引物为5'-GAACATGTCTGCGTATCTC-3';PGC-1α 内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)正向引物为5'-CTCGCTTCGGCAGCACAT-3',反向引物为5'-TTTGCGTGTCATCCTTGCG-3'。PCR反应体系:共10 μL,SYBR Premix Ex Taq 5 μL、正向引物0.4 μL、反向引物0.4 μL、cDNA模板1.0 μL、ROX Reference Dye(50×)0.2 μL、DNaseⅠ溶液3.0 μL。反应条件:95 ℃ 90 s,95 ℃ 30 s,63 ℃ 30 s,72 ℃ 15 s,40次循环。采用2-ΔΔCt法计算血清miR-140-5p和PGC-1α mRNA相对表达量。
1.3 随访和分组
通过复诊方式对AIS患者随访3个月,参考《2018中国痴呆与认知障碍诊治指南(一):痴呆及其分类诊断标准》[12]诊断VCI:1)有明确的卒中病史;2)认知障碍(简易智力状态检查量表,文盲<17分、小学<20分,初中及以上<24分)相对急性发病或呈阶梯样进展;3)认知障碍与卒中有明确的因果和时间关系(哈金斯基缺血指数量表≥7分);4)影像学检查显示大脑皮质或皮质下病灶,且直径>1.5 cm。根据是否合并VCI分为VCI组(41例)和非VCI组(122例)。
1.4 统计学方法
选用SPSS28.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用U检验。采用Logistic回归分析评估AIS患者发生VCI的危险因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价血清miR-140-5p、PGC-1α mRNA判断AIS患者发生VCI的效能,采用Hanley & McNeil检验比较各项指标的曲线下面积(area under curve,AUC)。以P<0.05为差异有统计学意义。
2 结果
2.1 AIS组与正常对照组血清miR-140-5p、PGC-1α mRNA表达比较
AIS 组血清miR-140-5p 相对表达量(4.52±1.19)高于正常对照组(1.71±0.45)(t=25.374,P<0.001),PGC-1α mRNA相对表达量(1.16±0.40)低于正常对照组(3.14±0.61)(t=22.857,P<0.001)。
2.2 VCI组与非VCI组各项指标比较
随访3个月后,163例AIS患者中,有41例(25.15%)发生VCI。VCI组NIHSS评分和miR-140-5p相对表达量均显著高于非VCI组(P<0.05),PGC-1α mRNA相对表达量显著低于非VCI组(P<0.05),2个组之间性别、年龄、体重指数、受教育程度、吸烟史、饮酒史、基础疾病、病灶位置差异均无统计学意义(P>0.05)。见表1。

表1 VCI组与非VCI组各项指标比较
2.3 AIS患者VCI发生的危险因素分析
以NIHSS评分、miR-140-5p、PGC-1α mRNA为自变量,是否发生VCI(是为“1”;否为“0”)为因变量,进行多因素Logistic回归分析。结果显示,NIHSS评分、血清miR-140-5p相对表达量升高和血清PGC-1α相对表达量降低是AIS患者发生VCI的独立危险因素[比值比(odds ratio,OR)值分别为3.298、1.438、0.716,95%可信区间(confidence interval,CI)分别为1.983~5.485、1.147~1.801、0.585~0.876]。见表2。
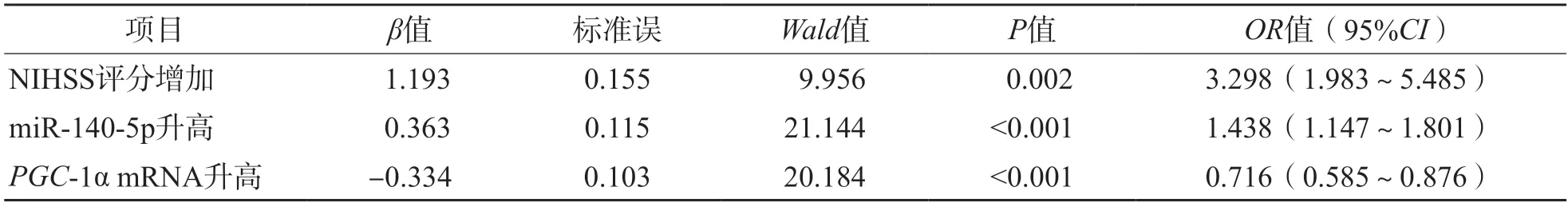
表2 AIS患者发生VCI的多因素Logistic回归分析
2.4 血清miR-140-5p、PGC-1α mRNA判断AIS患者VCI的效能
采用Logistic回归分析建立联合检测方程为:Logit(P)=0.225+0.358×miR-140-5p-0.330×PGC-1α mRNA。ROC曲线分析显示,miR-140-5p、PGC-1α mRNA单项检测和联合检测判断AIS患者发生VCI的AUC分别为0.790、0.780、0.905,联合检测的AUC显著高于单项检测(Z值分别为3.357、3.769,P值分别为0.001、<0.001)。见表3、图1。
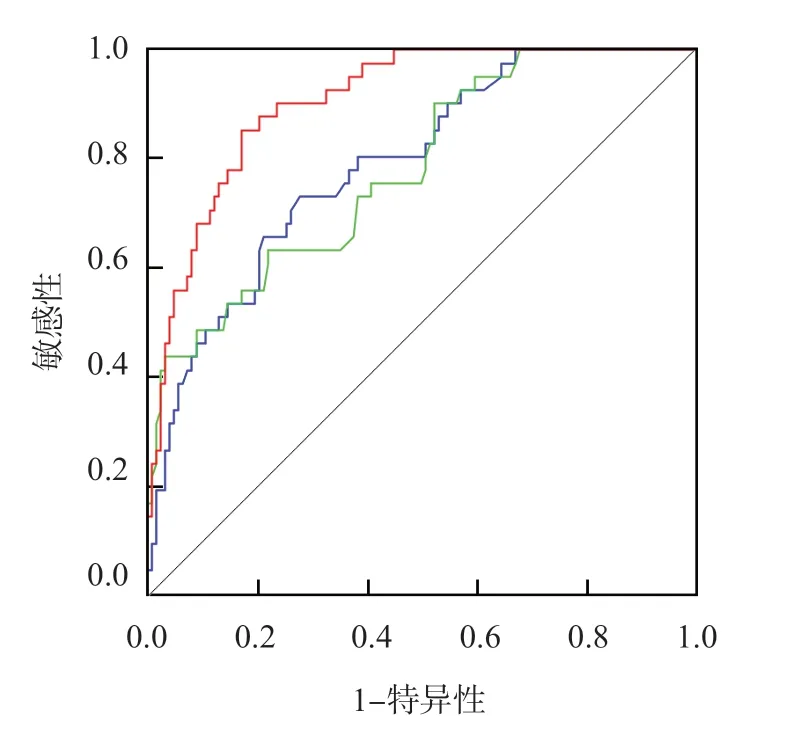
图1 血清miR-140-5p、PGC-1α mRNA判断AIS患者发生VCI的ROC曲线
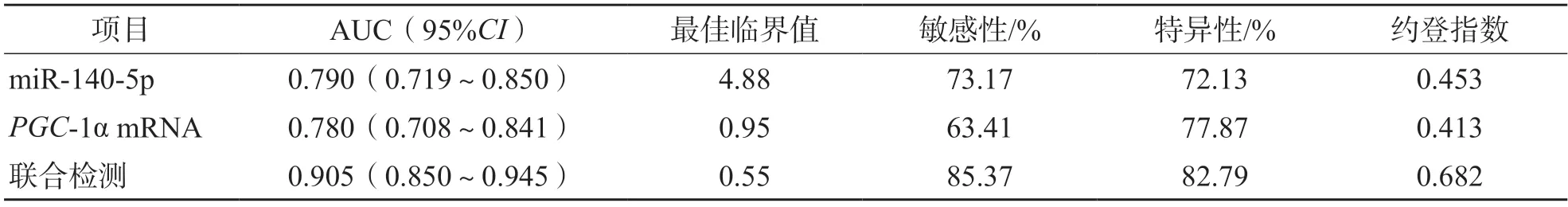
表3 血清miR-140-5p、PGC-1α mRNA表达预测AIS患者发生VCI的效能
3 讨论
脑卒中后VCI是指卒中事件后出现的认知损害,与脑卒中存在时序关系。与阿尔茨海默病等神经系统退行性疾病引起的痴呆不同,脑卒中后VCI具有病程波动性、斑片状认知缺损等特点,且致残、致死率较高,患者5年生存率为39%,而同龄无VCI的脑卒中患者5年生存率为75%,VCI已成为脑卒中疾病负担的重要原因[13]。目前,尚无针对脑卒中后VCI的特异性指标,主要通过简易智力状态检查量表或蒙特利尔认知评估量表评估认知功能来进行诊断,不适用于脑卒中后合并忽视症、失语症的患者,因此有必要寻找可靠的生物标志物用于脑卒中后VCI的辅助诊断。
在生理状态下,侧脑室外侧壁的脑室下区和海马齿状回颗粒下区神经干细胞能通过不断增殖产生新的神经元,即神经发生来维持神经功能,但脑卒中引起的血管损伤会损害神经血管单元,导致神经发生功能被破坏,直接影响神经元的结构和功能,诱发VCI[14]。近年来,越来越多的研究发现,miRNA参与了VCI的发生、发展[15]。miR-140-5p位于人16号染色体q22.1,与神经功能密切相关。动物实验结果显示,miR-140-5p能靶向分拣连接蛋白12,加重其对糖尿病大鼠的神经毒性,而敲除miR-140-5p则可减弱其对糖尿病大鼠的神经毒性作用[16]。miR-140-5p能通过下调ADAM金属肽酶结构域10,加大对阿尔茨海默病患者的神经毒性作用[17]。脑卒中后抑郁症是一种脑卒中后的神经功能障碍。有研究结果显示,AIS小鼠模型脑组织miR-140-5p表达上调与脑卒中后抑郁症发生有关[18]。在采用结扎双侧颈总动脉建立的脑缺血模型中,miR-140-5p过表达能通过靶向Prospero同源框蛋白1(prospero homeobox 1,Prox1)调节细胞外调节蛋白激酶(extracellular signal regulated kinase,ERK)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,抑制神经元的增殖和分化,减少神经元数量[7]。这提示miR-140-5p与AIS患者的神经功能密切相关。本研究结果显示,AIS患者血清miR-140-5p表达显著上调,与文献报道[6]一致;VCI组miR-140-5p相对表达量显著高于非VCI组(P<0.05),且miR-140-5p相对表达量升高是AIS患者发生VCI的独立危险因素(OR=1.438,95%CI为1.147~1.801)。说明血清miR-140-5p可能参与了AIS后VCI的发生,原因可能与miR-140-5p能靶向下调Prox1,抑制神经发生有关。Prox1是海马齿状回颗粒下区的成体神经新生不可或缺的正性调节因子,Prox1表达下调可导致海马区神经新生降低[19]。LIANG等[20]的研究结果显示,miR-140-5p过表达能靶向下调Prox1,抑制神经发生和神经可塑性,进而促进VCI的发生、发展。
线粒体是细胞内能量产生和代谢的中心,AIS患者缺氧、钙超载等一系列病理变化可导致线粒体功能障碍,产生大量活性氧,进而发生氧化应激,促进小胶质细胞持续活化,加重神经炎症反应和神经元损害,因此线粒体功能障碍被认为是VCI发生、发展的关键因素[21]。PGC-1α是调节线粒体生物发生的主要调节剂,能通过上调线粒体DNA和诱导编码线粒体蛋白的基因表达来促进线粒体的生物合成。有研究结果显示,PGC-1α能通过促进活性氧解毒酶和解偶联蛋白表达,减少活性氧的产生,增强线粒体的抗氧化应激能力[22]。另外,PGC-1α还与认知功能有关,运动后,PGC-1α表达会上调,可增加海马脑源性神经营养因子的表达,改善衰老引起的认知功能障碍[23]。采用PGC-1α激活剂上调PGC-1α表达能抑制帕金森病大鼠模型的神经氧化应激和炎症反应[24]。本研究结果显示,AIS患者血清PGC-1α mRNA表达显著下调,可能与AIS影响PGC-1α的转录和翻译修饰,导致PGC-1α mRNA表达下调有关。进一步分析发现,VCI组PGC-1α mRNA相对表达量显著低于非VCI组(P<0.05),且PGC-1α相对表达量降低是AIS后VCI发生的独立危险因素(OR=0.716,95%CI为0.585~0.876),说明血清PGC-1α mRNA表达下调可能参与了AIS后VCI的发生,这可能与PGC-1α能增强线粒体抗氧化应激能力,进而抑制神经氧化应激和炎症反应有关。在采用闭塞双侧颈总动脉方式建立的大鼠脑灌注不足模型中,上调PGC-1α表达能抑制大鼠的线粒体损伤和活性氧产生,保护海马区域的神经元免受炎症损伤,改善认知功能[25]。本研究结果还显示,NIHSS评分是AIS患者发生VCI的独立危险因素(OR=3.298,95%CI为1.983~5.485)。NIHSS评分反映了患者神经功能缺损的程度,评分越高,提示神经功能缺损越严重,发生VCI的风险越高。本研究ROC曲线分析结果显示,miR-140-5p、PGC-1α mRNA单项检测和联合检测判断AIS后发生VCI的AUC分别为0.790、0.780、0.905。由此可见,血清miR-140-5p、PGC-1α mRNA或可作为AIS患者发生VCI的预警指标,且联合检测的预测效能更高。
综上所述,AIS患者血清miR-140-5p和PGC-1α mRNA表达均异常,与VCI发生密切相关,或可作为VCI发生的预测指标。但本研究随访时间较短,关于血清miR-140-5p、PGC-1α mRNA表达与AIS患者远期发生VCI的关系还需进一步研究,二者参与AIS患者VCI发生的机制也需进一步研究。

