牛磺酸对幼刺参生长、抗氧化和代谢酶活性的影响
李培玉,王美琪,宋志东,胡顺鑫,刘财礼,李 璐,刘经未,陆国峰
(1.山东省海洋资源与环境研究院,山东 烟台 264006;2.上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
牛磺酸是一种有机酸,最早从牛胆汁中分离获得[1]。它只存在于动物蛋白中,几乎不存在于植物中[2]。牛磺酸作为一种以游离形式存在的含硫氨基酸,不参与蛋白质的生物合成,但是却参与了水生动物体内广泛的基本生理功能,包括渗透调节[3]、胆盐结合[4]、视觉和视网膜发育[5]、免疫反应调节[6]和抗氧化活性[7-8]。水产动物缺乏牛磺酸会产生一些症状,如肝胆代谢紊乱[9]、溶血性贫血[3]。水生动物通常可通过多种途径合成牛磺酸。半胱氨酸亚硫酸脱羧酶(CSD)和半胱氨酸双加氧酶(CDO)是半胱氨酸亚磺酸途径的两种限速酶,催化蛋氨酸或半胱氨酸转化为牛磺酸。最近研究表明CDO 和CSD 的活性以及鱼类对这两种酶催化效率的调节机制与鱼类内源牛磺酸的合成能力有关[10-12]。一般认为,内源性牛磺酸的产生不足以满足大多数水生动物的需求,因此需要额外在饲料中添加牛磺酸[2]。多项研究表明,添加外源性牛磺酸可促进鱼虾的生长和饲料利用,然而各水产动物对牛磺酸的最佳需求量存在较大差异,如凡纳宾对虾(Litopenaeus vannamei)对饲料牛磺酸需求量为质量分数0.17%[13],尼罗罗非鱼(Oreochromis niloticus)为质量分数0.97%[14],牙鲷(Dentex dentex)为2 g/kg[15],草鱼(Cenopharyngodon idella)为2.50 g/kg[16],黄 条(Seriola lalandi)为7.50 g/kg[17],虹鳟(Oncorhynchus mykiss)为5 g/kg[18]。牛磺酸添加量受多种因素影响,不仅与动物种类有关,还与配方中含硫氨基酸有关。
近年来,刺参(Apostichopus japonicus)消费需求不断上升,推动刺参养殖业的快速发展。野生刺参主要摄取有机沉积物,包括细菌、原生动物、藻类或动物的碎屑[19]。而在养殖实践中,刺参饲料的原料来自鼠尾藻(Sargassum thunbergii)、海带(Laminaria japonica)与马尾藻(Scagassum)等牛磺酸含量较低的水生植物[20],这与刺参体内高含量的牛磺酸形成明显对比[21-22]。明确刺参是否具有在体内合成牛磺酸的能力,并确定刺参生长过程中对牛磺酸的需要量极为重要。因此,本研究以幼参为对象,研究了不同水平的牛磺酸及其代谢中间体(半胱氨酸和磺基丙氨酸)对刺参生长性能、体成分、代谢和抗氧化酶活性的影响,为牛磺酸在刺参配合饲料中的科学应用奠定理论基础。
1 材料和方法
1.1 制备包被氨基酸
将牛磺酸晶体(纯度99.0%)粉碎成粉末,与蒸馏水以质量比1∶4 混合,配制成氨基酸溶液。向氨基酸溶液中加入与牛磺酸同等质量的β-环糊精,完全混合成糊状,然后在水浴(95 ℃)中加热并连续搅拌30 min,冷冻干燥,研磨,用250 μm 筛网过筛,然后在-18 ℃下储存。
1.2 实验饲料制备
以鱼粉、海藻粉、虾粉等为主要蛋白源,添加α-淀粉、卡拉胶以及海泥(采自山东蓬莱长岛网箱养殖区域)等配制成基础饲料(Tau 0,对照),在该配方上添加质量分数0.30%、0.60%、0.90%、1.20%、1.50%的包被牛磺酸(Tau 0.3、Tau 0.6、Tau 0.9、Tau 1.2和Tau 1.5)以及0.60%的半胱氨酸(CY)、0.60%的半胱酸(CA),形成8 种等氮等脂的实验饲料(表1),其常规营养组成见表2。实测饲料中牛磺酸质量分数为0.08%、0.22%、0.37%、0.51%、0.74%、1.04%、0.07%和0.08%(以下含量数值均以质量分数计)。将所有干成分充分混匀后,加入蒸馏水搅拌均匀,然后冷挤压成条带(1.00 cm × 0.50 cm × 0.08 cm)。采用如下方法测定饲料中牛磺酸溶失率:称取5 g饲料置于装有25 mL 水的烧杯中静置,不同时间取样测定水中牛磺酸含量,根据水的体积推算牛磺酸溶出量(图1)。经测定对比,牛磺酸经包被后,其在饲料中的溶失率低于未包被牛磺酸,因此在本实验饲料制作中牛磺酸的添加形式为包被后牛磺酸。
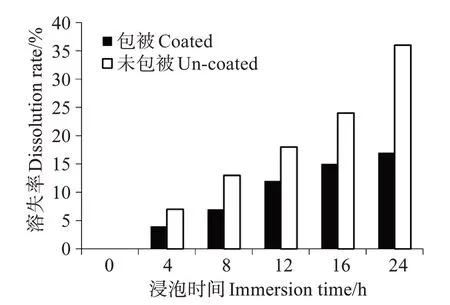
图1 包被与未包被饲料的牛磺酸浸出率Fig.1 Taurine dissolution rate of feeds containg coated-taurine and crystal taurine

表1 实验饲料组分质量分数Table 1 Mass fraction of experimental diet components %

表2 实验饲料的常规营养组成质量分数及能量(干基)Table 2 Proximate composition of experimental diets(dry mass basis)
1.3 实验管理
刺参幼参从山东安源种业科技有限公司(蓬莱)购得,在东营某实验基地的玻璃纤维桶(400 L)中驯化2 周。实验桶底部设置聚乙烯波纹板作为遮蔽物。实验开始前停饲24 h,然后随机选择大小相似的健康幼参[(11.40 ± 0.04)g],分配到24 个养殖桶(30 头/桶)。每3 桶投喂1 种实验饲料,日投喂1 次(16:00),投喂量为刺参体质量3%。收集剩余残饵和粪便,记录每天摄食量,持续8 周。养殖期间,采用自然海水养殖,pH 为7.50~8.20,溶解氧>6 mg/L,盐度为28~30,日换水率为600%,温度保持在(16±1)℃。
1.4 取样及计算
实验结束对每桶刺参进行称质量和计数。测定各养殖桶刺参数量和体质量,计算增重率(WGR)、特定生长率(SGR)和存活率(SR)。每桶随机抽取10头幼参,解剖体壁、呼吸树和肠道样本,在-80 ℃下储存以供分析。
生长性能根据以下公式计算:
1.5 体成分分析
样品水分含量是在105 ℃下干燥至恒重测得。粗蛋白质含量采用凯氏定氮仪(Kieltec 8400,FOSS Analytical A/S)测定,脂肪含量采用索氏提取法(Soxtex 2050,FOSS Analysis A/S)测定,粗灰含量采用马弗炉燃烧法在550 ℃下测定,总能量采用热量计(IKA®C6000,Janke&Kunkel KG,IKA-werk)测定。肌肉和饲料的氨基酸组成采用酸解法测定,即样品用6 mL HCl(6 mmol/L)在110 ℃下水解22 h,除酸后获得的最终水解液通过氨基酸分析仪(Hitachi L8900,Hitachi High-Technologies Corporation,Japan)测定。组织和饲料的牛磺酸含量采用GB 5009.169—2016标准方法测定[23]。
1.6 酶活性分析
肠道低温匀浆后在4 000 r/min、4 ℃下离心10 min,分离上清液用于酶活性分析。淀粉酶(Amylase)、脂肪酶(Lipase)、蛋白酶(Protease)、葡萄糖激酶(GK)、丙酮酸激酶(PK)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)活性均使用试剂盒(南京建成生物工程研究所)测定。半胱氨酸亚硫酸酯脱羧酶(CSD)和半胱氨酸双加氧酶(CDO)的活性根据Goto 等[24-25]的方法进行测定,通过牛磺酸与β-丙氨酸的面积比计算牛磺酸含量作为酶活性单位。
1.7 统计分析
数据采用SPSS 17.0(SPSS 股份有限公司,Chicago)进行单因素方差分析和邓肯多重比较,P<0.05即为各处理组之间的差异具有统计学意义。采用SPSS软件分段线性回归模型对特定生长率、粪便产生率以及呼吸树和肠道牛磺酸含量进行拟合预测折点,分析各个评价指标与牛磺酸水平的相关性。
2 结果
2.1 饲料牛磺酸水平对刺参生长性能的影响
如表3 所示各组SR、肠壁比(IBR)和脏壁比(VBR)无明显差异(P>0.05)。随着牛磺酸添加水平的上升,WGR 及SGR 呈现先升高后平稳趋势,各牛磺酸添加组均提高了WGR 和SGR(P<0.05)。添加质量分数0.60%~1.50%牛磺酸显著提高了刺参的排粪率(FPR)(P<0.05)。CY 组刺参WGR 和SGR 与对照组相比并无显著差异(P>0.05),而CA组刺参WGR 和SGR 均高于对照组(P<0.05)。以SGR 和FPR 为评价指标对饲料牛磺酸水平建立折现回归模型,分析得出,初始体质量为(11.40 ±0.04)g幼参对饲料中牛磺酸的最适需求量为质量分数0.42%~0.51%(图2)。
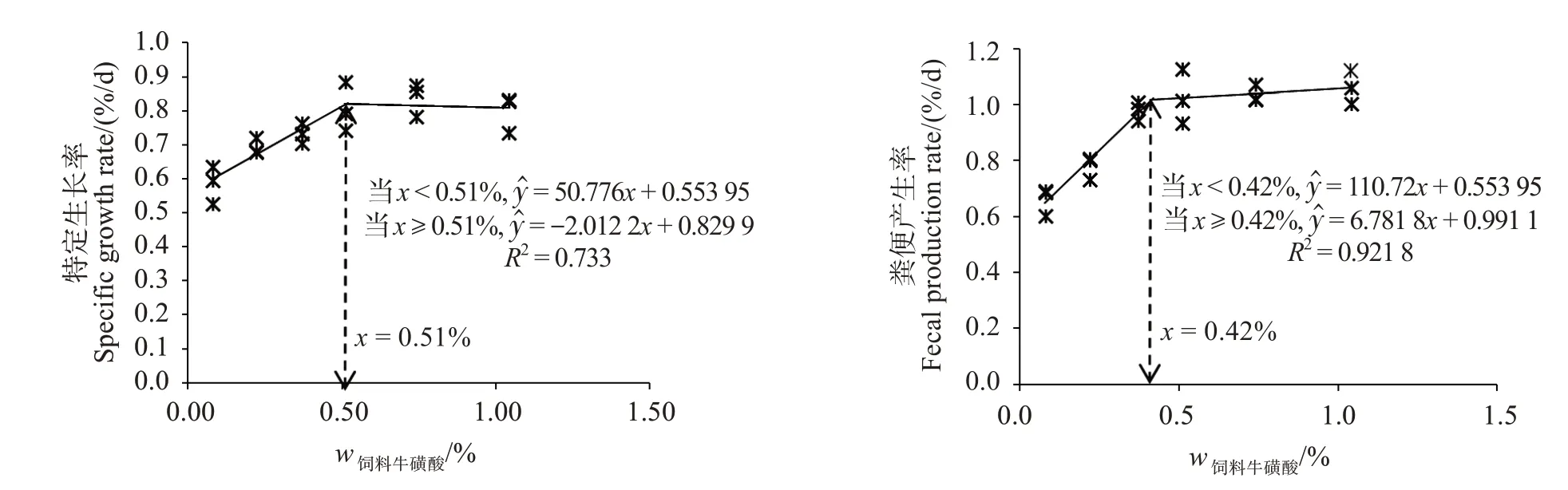
图2 刺参特定生长率及粪便产生率与饲料中牛磺酸含量的阶段线性回归分析Fig.2 Broken line analysis of specific growth rate and fecal production rate,taurine actual level in feed for Apostichopus japonicus
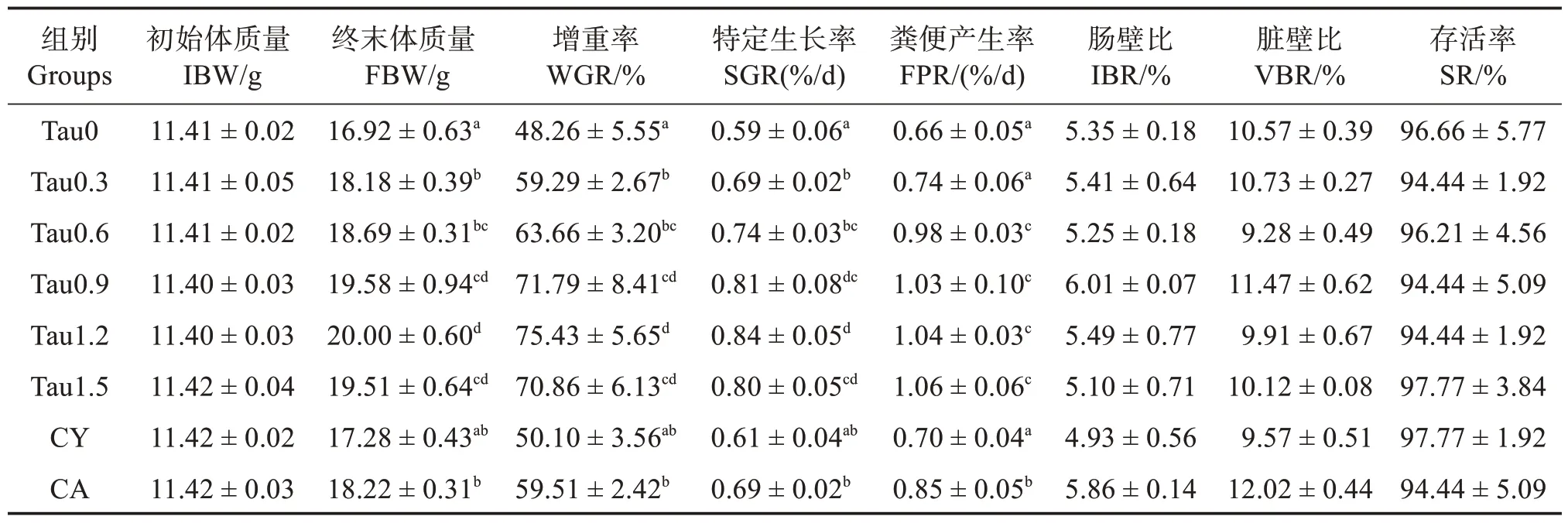
表3 刺参生长性能Table 3 Growth performance of Apostichopus japonicus
2.2 饲料牛磺酸水平对全参基本营养成分和氨基酸组成的影响
如表4、5 和6 所示,添加牛磺酸并未改变全参水分和粗脂肪含量以及全参异亮、赖、精、丝、谷、丙、酪等氨基酸含量(P>0.05),但是1.20% 和1.50%牛磺酸组全参灰分含量显著高于对照组(P<0.05)。全参粗蛋白在0.60%~1.20%的添加水平下显著高于对照组(P<0.05),但是在1.50%的添加水平下反而呈下降趋势。与对照组相比,添加0.60%~1.20%牛磺酸显著提高了全参苏氨酸含量(P<0.05),添加0.30%~1.50%牛磺酸提高了缬氨酸含量(P<0.05),添加0.90%~1.20%牛磺酸提高了蛋氨酸含量(P<0.05),添加0.90%~1.50%牛磺酸提高了半胱氨酸含量(P<0.05)。亮氨酸含量先上升后降低,最高值出现在0.90%牛磺酸添加组。组氨酸含量则呈现持续下降的趋势。与对照组相比,CY和CA 组均提高了全参亮氨酸含量而降低了组氨酸含量(P<0.05)。添加CY 显著提高全参半胱氨酸含量(P<0.05),而添加CA 则降低半胱氨酸含量(P<0.05)。
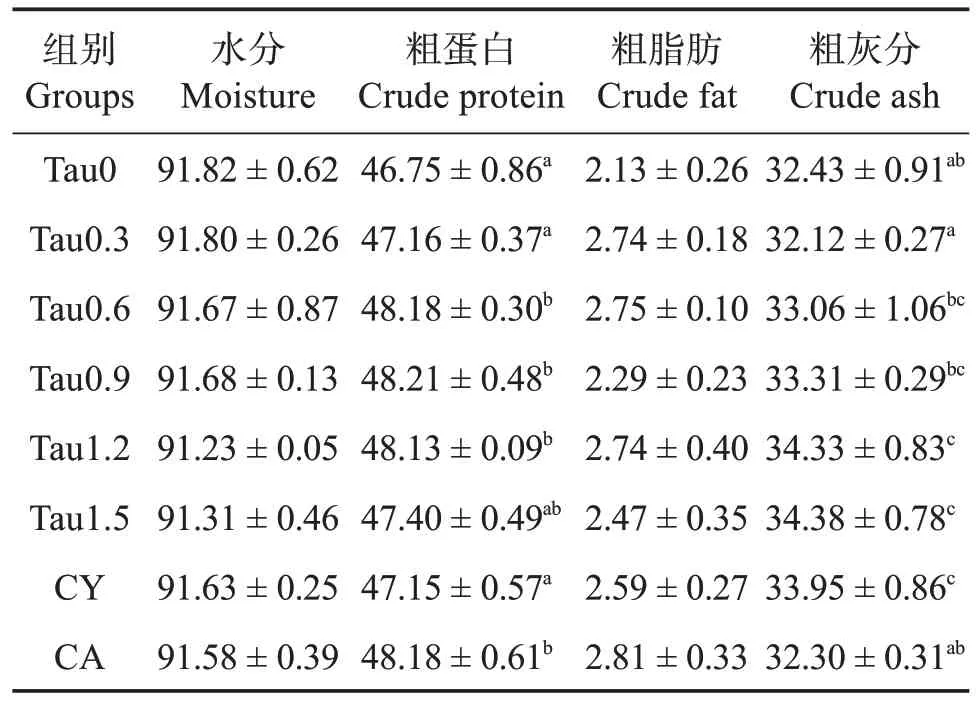
表4 刺参全参营养成分质量分数(干物质)Table 4 Mass fraction of nutrition component of whole body of Apostichopus japonicus(dry matter) %

表5 刺参全参必需氨基酸质量分数(干基)Table 5 Mass fraction of essential amino acid of whole body of Apostichopus japonicus(dry matter basis)%
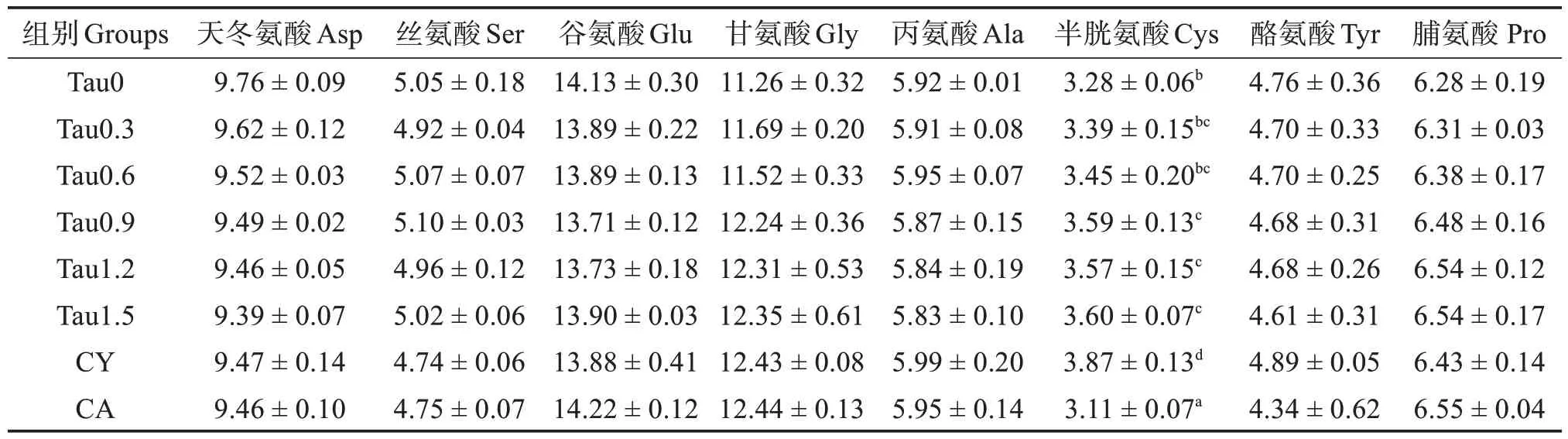
表6 刺参全参非必需氨基酸质量分数(干基)Table 6 Mass fraction of non-essential amino acid of whole body of Apostichopus japonicus(dry matter basis) %
2.3 饲料牛磺酸水平对刺参体壁、呼吸树和肠道牛磺酸含量的影响
由表7可知,随着饲料中牛磺酸水平上升,各组织中牛磺酸含量呈逐渐上升后平稳趋势。0.60%~1.50%添加组刺参体壁和呼吸树中牛磺酸含量均显著高于对照组(P<0.05),0.30%~1.50%添加组的刺参肠道中牛磺酸含量显著高于对照组(P<0.05)。CY 组呼吸树和肠道牛磺酸含量与对照组无显著性差异(P>0.05),但CA 组肠道中牛磺酸含量显著高于对照组(P<0.05)。分别以呼吸树和肠道牛磺酸含量对饲料牛磺酸添加水平进行模型拟合(图3),预测牛磺酸添加量分别为质量分数0.41%和0.47%。
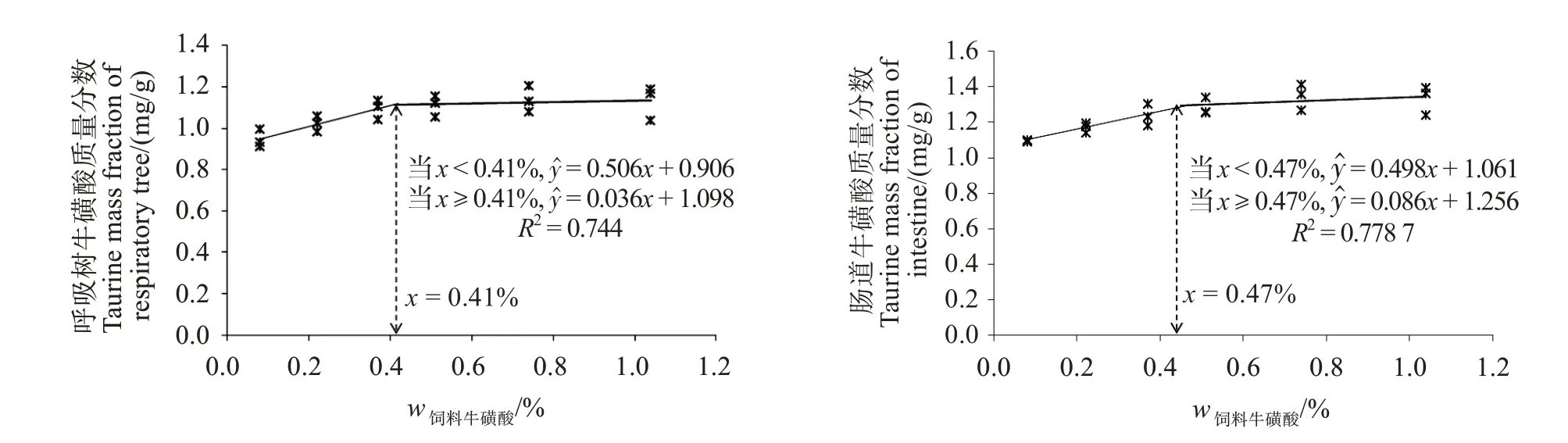
图3 刺参呼吸树及肠道中牛磺酸含量与饲料中牛磺酸含量的阶段线性回归分析Fig.3 Broken line analysis of the taurine content in the respiratory tree and intestine and taurine actual level in feed for A.japonicas

表7 刺参体壁、呼吸树和肠道牛磺酸质量分数Table 7 Taurine mass fractions in body wall,respiratory tree and intestine of Apostichopus japonicus mg/kg
2.4 饲料牛磺酸水平对刺参肠道消化和代谢酶活性的影响
如表8所示,各组间肠道蛋白酶、ALT和AST活性无显著差异(P>0.05)。但是随着牛磺酸添加量的升高,刺参肠道脂肪酶、淀粉酶和PK 等活性呈先升高后下降趋势,且均在0.90%水平下达到最大值;所有牛磺酸组刺参肠道的GK、AKP 等活性均高于对照组(P<0.05)。另外,肠道CDO 活性随着饲料中牛磺酸含量的增加呈下降趋势,在1.20%~1.50%添加水平下显著低于对照组(P<0.05),而CSD 活性在0.60%~1.5%水平下低于对照组(P<0.05)。
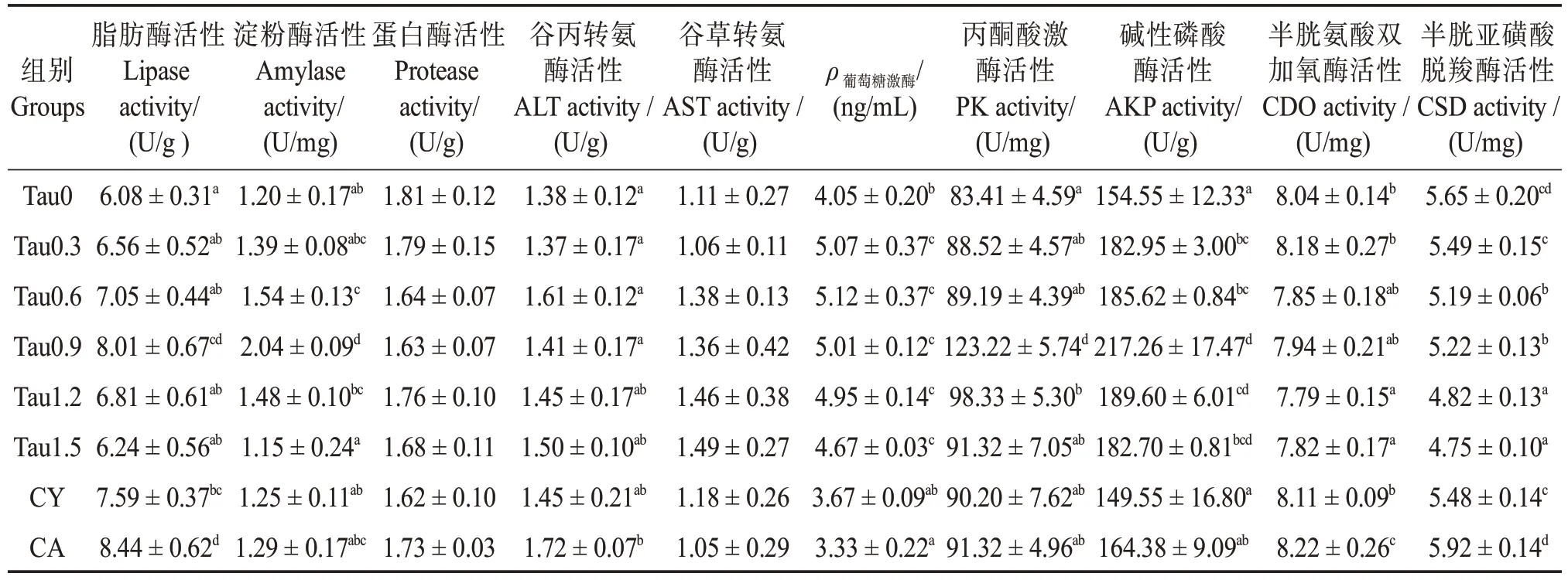
表8 刺参肠道消化与代谢酶活性Table 8 Activity of intestinal digestive and metabolic enzymes of Apostichopus japonicus
2.5 饲料牛磺酸水平对刺参肠道抗氧化性能的影响
如表9 所示,肠道CAT 和SOD 活性随牛磺酸水平的上升均呈先升高后下降趋势,添加0.90%牛磺酸显著提高了肠道CAT 活性,0.60%~1.50% 添加水平显著提高了SOD 活性(P<0.05)。肠道丙二醛(MDA)含量变化则呈现相反趋势,0.90%~1.50%添加水平下刺参肠道MDA含量显著低于对照组(P<0.05)。CY 组肠道CAT 和SOD 活性与对照组无差异(P>0.05),但是CA 组肠道CAT 和SOD 活性显著高于对照组(P<0.05)。

表9 刺参肠道抗氧化性能Table 9 Antioxidation abilities ofApostichopus japonicus intestine
3 讨论
3.1 牛磺酸对刺参生长性能的影响
研究证明饲料中添加牛磺酸能够促进鱼类摄食和生长、提高脂肪的吸收沉积以及增强抗氧化能力[7,26-27],且鱼类能够调节牛磺酸合成的相关代谢酶基因的表达和酶活性[28]。牛磺酸在鱼类饲料中应用较多,但是在刺参饲料中的应用研究较少。本实验中,牛磺酸添加水平在0.30%~0.90%时,刺参生长随牛磺酸添加量上升而提高,说明刺参单靠内源牛磺酸的合成可能无法满足自身需要,饲料中添加牛磺酸能够改善刺参的生长性能。这一研究与Zhao等[22]的结论有很大差异,可能是本实验中牛磺酸采用包被方式,降低了牛磺酸溶失,提高了刺参有效摄食浓度。另有相关研究表明添加牛磺酸可以改善饲料的适口性,提高动物的采食率[29]。本实验中由于残饵崩解造成收集困难,无法测算摄食率,但是摄食率和粪便产生率具有正相关性[30-31]。幼参粪便产生率随着牛磺酸含量的升高而提高,说明添加牛磺酸改善了饲料的诱食性,这与在象牙贝(Babylonia areolate)[32]以及方斑东风螺(Babylonia areolata)[33]等上的研究结果一致。根据折线回归模型可见,在以藻粉、鱼粉、虾粉以及豆粕为主饲料中,添加0.42%~0.51%牛磺酸可以明显改善幼参的饲料利用和生长。这一估测值明显低于象牙贝(1.50%~2.00%)[32]、鲇(Pangasianodon hypophthalmus)(1.505%~1.631%)[34]等的需求量,但是接近于凡纳滨对虾(Litopenaeus vannemei)(0.43%)[35]、中华绒螯蟹(Eriocheir sinensis)(0.40%~0.80%)[7]、真鲷(Pagrus major)(0.50%)[36]、黄鳝(Monopterus albus)(0.37%)[26]等的需求量,说明牛磺酸的需求量有种属差异性。
3.2 牛磺酸对刺参基本营养成分的影响
刺参具有钙质骨片,本实验中,高水平的牛磺酸(1.20%和1.50%)添加提高了体壁灰分,说明牛磺酸能够促进钙等矿物质在刺参体壁中沉积,与在黑鲷(Acanthopagrus schlegelii)上的研究结果一致[29]。在一些动物模型上的研究也发现牛磺酸可以通过与钙作用促进骨的形成从而提高骨密度[37-38]。另外,随饲料牛磺酸水平上升全参蛋白含量显著提高,说明牛磺酸在促进蛋白沉积上扮演重要角色,在大菱鲆(Scophthalmus maximus)、花鲈(Lateolabrax japonicus)也发现类似现象[39,40]。虽然牛磺酸不参与机体蛋白合成,但是却参与含硫氨基酸的代谢转化。添加适量牛磺酸发挥氨基酸节约作用,使得蛋氨酸和胱氨酸等含硫氨基酸可以更多地参与到蛋白质合成代谢中,促进机体蛋白质沉积[41]。氨基酸组成测定结果也证实了这一推断:适量牛磺酸添加不仅提高了含硫氨基酸含量,也显著提高了其它几种氨基酸如苏氨酸、缬氨酸的含量。牛磺酸与这些氨基酸的代谢之间的关联作用,需要进一步实验研究。
3.3 牛磺酸添加水平对幼参牛磺酸合成能力以及组织中分布的影响
研究发现,CDO和CSD酶活性主要取决于水产动物种类。如黄尾鲴(Xenocypris davidi)、大黄鱼(Pseudosciaena crocea)、贻贝(Mytilus edulis)和疣荔枝螺(Reishia clavigera)等物种中CSD 的活性很低[24],而虹鳟(Oncorhynchus mykiss)、鲈(Lateolabrax japonicus)、泥蚶(Tegillarca granosa)、芝麻螺(Monodonta labio)、疣荔枝螺(Reishia clavigera)等则活性很高[42-43]。CDO的表达也受多种因素调节,如含硫氨基酸、外源牛磺酸等[44-45]。本实验发现,随着饲料中牛磺酸添加水平的升高,刺参肠道CSD和CDO活性均呈现下降趋势,而添加半胱酸却能够提高CSD活性,这与在大菱鲆[46]、卵形鲳鲹(Trachinotus ovatus)[28]、虹鳟以及牙鲆(Paralichthysolivaceus)[11]上的结果一致。牛磺酸合成酶的可调节性说明刺参具有一定程度的牛磺酸合成能力,因此也解释了刺参生长的低牛磺酸需求。本实验还发现添加CA能够改善幼参生长、提高牛磺酸组织含量等,而CY却不能明显提高组织牛磺酸含量,这说明在CY 转化成CA 过程中存在一定障碍,这也说明了饲料中添加牛磺酸的必要性。
水产动物对牛磺酸既存在器官蓄积差异,也存在种属差异[28,47-48]。本实验中发现,刺参的肠道和呼吸树对牛磺酸蓄积较多,而体壁则蓄积较少,这说明牛磺酸可能参与调节呼吸树和肠道的一些生理功能活性,反映了器官组织对牛磺酸需求的差异性。肠道和呼吸树牛磺酸蓄积水平随饲料牛磺酸添加水平呈现先升高后平稳趋势,符合二段式线性回归特点,其折点代表了组织所能容纳牛磺酸的最大量,也暗示了组织代谢所需要的最低量。根据估算,饲料中牛磺酸达到0.41%~0.47%可满足刺参肠道和呼吸树代谢的需求。这一估测值与生长模型所预测的牛磺酸需求量基本一致,说明0.41%~0.47%的牛磺酸能同时满足代谢和生长的需要。
3.4 牛磺酸对刺参肠道消化代谢酶的影响
本实验中,添加0.60%~0.90%牛磺酸可提高刺参肠道脂肪酶和淀粉酶活性,这一结果与Zhao等[49]一致,这说明添加牛磺酸有助于幼参对脂肪和碳水化合物的消化吸收。但是随饲料牛磺酸水平进一步升高,脂肪酶和淀粉酶活性有所下降,说明过高牛磺酸反而抑制了这两种酶的分泌,相似现象也在黄 鳝(Monopterus albus)[26]、红鳍东方鲀(Takifugu rubripes)[50]、草 鱼(Ctenopharyngodon idella)[51]等鱼类上发现。在本实验中,随牛磺酸含量的增加,GK 和PK 活性呈现先增加后降低的趋势,分别在0.60%和0.90%的添加水平下达到最高。由此可见,适量添加水平的牛磺酸可能调节肠道糖酵解代谢,提高葡萄糖利用能力。碱性磷酸酶对水产动物吸收水中钙质具有重要作用,能够催化各种含磷化合物水解。实验结果表明,饲料中添加牛磺酸可改善刺参肠道碱性磷酸酶活性,与红鳍东方鲀[50]、中华绒螯蟹[7]上的研究结果一致。刺参具有内骨片结构,因此碱性磷酸酶活性提高说明饲料牛磺酸在一定程度上能上调成骨细胞活力,促进刺参内骨片生长[52-53]。综上,从刺参肠道消化代谢酶方面来看,饲料牛磺酸添加水平在0.60%~0.90%(饲料实际牛磺酸含量0.37%~0.51%)范围,能够促进刺参的消化和代谢活动。
3.5 牛磺酸对刺参肠道抗氧化性能的影响
本实验中,饲料添加一定量的牛磺酸可以提高刺参肠道SOD和CAT活性,这一发现与Zhao等[49]的研究结果一致。可能添加牛磺酸增强了刺参肠道在线粒体膜潜力,改善呼吸链传递途径介导的能量代谢[54],并通过Nrf2 介导的信号通路作用于抗氧化酶系统,增强SOD和CAT等抗氧化酶的合成以消除活性氧[55-56]。相反,过量牛磺酸抑制SOD和CAT活性,导致刺参抗氧化能力的降低。说明过量牛磺酸对细胞产生一定毒性作用,从而抑制细胞分泌SOD 和CAT,这一结论在非洲鲇(Clarias gariepinus)上也得到证实[57]。MDA 是氧自由基攻击多不饱和脂肪酸而形成的脂质过氧化物,反映细胞损伤和脂质过氧化程度。在本研究中,牛磺酸添加水平大于0.60%时,肠道MDA含量显著低于对照组。随着牛磺酸添加水平的增加,MDA 含量呈降低趋势,与SOD 和CAT酶的变化趋势基本相符。这也说明在刺参中添加牛磺酸高于0.60%时(实际牛磺酸含量0.37%)有助于提高机体抗氧化能力,降低脂质过氧化对细胞的毒性,从而保护机体免受自由基的损害。
4 结论
综合特定生长率、粪便产生率、呼吸树和肠道牛磺酸蓄积水平的回归分析,并结合消化酶、抗氧化能力等,推测初始体质量为(11.40 ± 0.04)g 刺参幼参对饲料中牛磺酸的最适需求量为0.47%~0.51%,这个范围内的牛磺酸添加水平,可以提高刺参幼参对营养物质的消化和代谢能力,增强幼参抗氧化性能,又可以促进幼参生长。

