旋毛虫钙网蛋白对小鼠巨噬细胞和大鼠PBMC免疫功能的影响
张朝莹,文兆海,张玥,李嫄,徐立新,陆明敏,宋小凯,李祥瑞,严若峰
(南京农业大学动物医学院,江苏 南京 210095)
旋毛虫病(Trichinosis)是由旋毛形线虫(Trichinellaspiralis)引起的一种食源性人兽共患病,呈全球性分布。主要临床症状是创伤性和免疫学的改变,包括眼睑水肿、发热综合征、腹泻、肌肉疼痛和嗜酸性粒细胞增多等[1]。旋毛虫病重症患者的特征是心血管、肺和中枢神经系统损伤,最终可导致宿主死亡,给动物生产和人类公共卫生安全构成了严重威胁。旋毛虫可感染多种哺乳动物、鸟类和爬行动物等,其中鼠是旋毛虫病的一种重要的传染源[2]。当旋毛虫与宿主建立寄生关系时,会产生各种免疫逃避机制,从而让其能够成功寄生[3],因此其逃避宿主免疫系统的机制引起了广泛关注。尽管现在针对旋毛虫病有相对安全的药物,如阿苯达唑等[4],但其耐药问题已日趋严重。故此,研究旋毛虫与宿主间相互作用、筛选出新的疫苗候选抗原对预防该病具有重要意义[5]。
钙网蛋白(calreticulin,CRT)是内质网中高度保守的Ca2+结合蛋白[6],在某些情况下其可以从细胞内转运出来,出现在胞质、胞膜表面、血清、颗粒物等中,或者以可溶性的形式被分泌到体外[7-8]。钙网蛋白是一种钙结合伴侣,参与一系列细胞过程,在免疫反应中具有多种功能。在内质网中,钙网蛋白促进主要组织相容性复合体(MHC)I类分子及其组装因子的折叠,从而影响向细胞毒性T细胞的抗原呈递[9]。研究表明钙网蛋白也可在细胞表面表达[10],并与细胞的吞噬摄取和免疫原性相关。然而,研究rTs-CRT对宿主免疫细胞功能的影响却少有报道。
本研究团队前期从旋毛虫外泌体蛋白质谱分析结果中鉴定到钙网蛋白,但其对宿主免疫功能的影响尚不清楚。本文根据NCBI上发布的钙网蛋白核苷酸序列进行了克隆表达,并对重组蛋白的免疫调节功能开展了初步研究,以期为深入了解虫体与宿主间的相互作用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 试验动物与虫体旋毛虫为中国河南猪分离株,国际编号ISSS534,由本研究团队传代并保存。健康6周龄SPF级雄性SD大鼠(约200 g)购自北京维通利华实验动物公司。
1.1.2 主要试剂与材料大肠杆菌DH5α、BL21菌种,pET-28a(+)载体,小鼠巨噬细胞系(RAW264.7)均由本实验室保存;大鼠淋巴细胞分离液、抗凝真空采血管为天津灏洋公司产品;DNA回收试剂盒为Omega公司产品;PrimeSTAR Max DNA Polymerase、限制性内切酶(EcoRⅠ、XhoⅠ)、Ligation mix 为TaKaRa公司产品;ToxinEraserTM内毒素去除试剂盒为金斯瑞公司产品;RPMI-1640培养基、内毒素去除柱、青链霉素双抗、HRP 标记抗大鼠IgG、胎牛血清(FBS)、RIPA 裂解液为Thermo Fisher公司产品;总NO检测试剂盒、CCK-8检测试剂盒和细胞凋亡检测试剂盒为碧云天公司产品;RNA isolater、HiScript Ⅲ反转录试剂、qPCR试剂盒为南京诺唯赞公司产品;DAB显色试剂盒为天根生物公司产品;引物由通用生物公司合成。
1.2 TsCRT基因的克隆与表达
1.2.1 引物设计与合成根据NCBI中TsCRT的CDS序列(XM_003379455.1)设计引物,选择酶切位点EcoRⅠ和XhoⅠ,引物如下所示,下划线部分的序列表示酶切位点。CRT F/R:5′-CGGAATTCGAGGTTTA-TTTGAAAGAAACGTTC-3′/5′-CCCTCGAGTTAAAGTTCGTCGTCAGCATG-3′。
1.2.2 目的基因的扩增与原核表达质粒的构建根据TRIzol试剂说明书提取旋毛虫肌肉幼虫虫体总 RNA,将其反转录为cDNA,再通过PCR扩增目的基因。按照凝胶回收试剂盒(OMEGA)说明书回收PCR产物,用EcoRⅠ和XhoⅠ将回收产物与pET-28a(+)质粒分别进行双酶切,并在25 ℃水浴条件下连接酶切产物,时间为30 min。将连接产物转化至大肠杆菌DH5α中,置于37 ℃摇床中培养12~16 h,收集重组菌,进行双酶切与测序鉴定。阳性质粒命名为pET-28a-TsCRT。
1.2.3 重组旋毛虫钙网蛋白(rTsCRT)的表达及纯化将pET-28a-TsCRT转化至大肠杆菌BL21,挑取单菌落37 ℃、180 r·min-1振荡培养约3 h,加入IPTG至其终浓度为1 mmol·L-1,继续振荡培养5 h,用120 g·L-1十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蛋白分布情况。用镍柱纯化重组蛋白,再用PEG20000浓缩蛋白,并使用试剂盒去除内毒素。
1.2.4 旋毛虫感染血清的制备用7 000条旋毛虫肌幼虫经口感染SD大鼠,35 d后经腹主动脉采血并分离得到纯化的抗重组CRT蛋白(rTsCRT)血清,分装后保存于-20 ℃备用。
1.2.5 rTsCRT的Western blot分析SDS-PAGE电泳后将重组蛋白转印PVDF,在37 ℃条件下用50 g·L-1脱脂奶粉封闭1 h,再使用50 g·L-1脱脂奶粉按1∶100(体积比)稀释一抗(感染旋毛虫的大鼠血清与未感染的大鼠血清),4 ℃孵育过夜;加入 50 g·L-1脱脂奶粉按1∶5 000(体积比)稀释的山羊抗大鼠IgG,37 ℃避光孵育1 h。将 ECL滴加于PVDF膜上,使用全自动化学发光图像分析系统曝光成像。
1.3 rTsCRT对小鼠巨噬细胞功能的影响
1.3.1 rTsCRT对小鼠巨噬细胞增殖的影响将传代培养的小鼠巨噬细胞浓度调整为5×105mL-1,以每孔100 μL加入96孔细胞培养板,分别向每孔加入不同浓度的rTsCRT(0、5、10、20、40、80 μg·mL-1),另设空培养基的空白孔。置于37 ℃、5% CO2细胞培养箱中培养 48 h,根据CCK-8 检测液说明书检测增殖结果。
1.3.2 rTsCRT对小鼠巨噬细胞分泌NO的影响将传代培养的小鼠巨噬细胞浓度调整为1×106mL-1,将细胞加入24 孔细胞板,每孔1 mL。用不同浓度的rTsCRT(5、10、20、40、80 μg·mL-1)处理巨噬细胞;同时设置PBS空白组。每组设3个重复。置于37 ℃、5% CO2细胞培养箱中培养48 h。收集细胞,2 000 r·min-1离心10 min,收集上清液,按照总NO检测试剂盒的步骤检测每组的NO分泌水平。
1.3.3 rTsCRT对小鼠巨噬细胞凋亡的影响将传代培养的小鼠巨噬细胞浓度调整为1×106mL-1,将细胞加入24 孔细胞板,每孔1 mL。用不同浓度的rTsCRT(5、10、20、40、80 μg·mL-1)处理巨噬细胞,同时设PBS 空白组。置于培养箱内培养24 h,每组至少3个重复。根据凋亡试剂盒说明书检测凋亡结果,试验独立重复3次。
1.4 rTsCRT对大鼠PBMC转录因子和细胞因子转录水平的影响
1.4.1 rTsCRT对大鼠PBMC不同类型Th细胞关键转录因子转录水平的影响将新鲜分离的大鼠PBMC培养在含1%青(链)霉素双抗和10% FBS的RPMI-1640中,浓度调整为1×106mL-1,然后将细胞铺于12孔细胞培养板,每孔2 mL,分别加入不同浓度(10、20、40和80 μg·mL-1)的rTsCRT和PBS,每组设3个重复。置于37 ℃、5% CO2细胞培养箱中培养24 h。24 h后使用TRIzol法分别提取各孔细胞总RNA,逆转录合成cDNA,再进行实时荧光定量PCR(qPCR),最后试验结果采用2-ΔΔCT法计算,分析各组转录因子mRNA的水平变化。qPCR反应体系:cDNA模板1 μL,上、下游引物各0.2 μL,ROX Reference Dye Ⅱ 0.2 μL,2×GS AntiQ qPCR SYBR Master Mix 5 μL,ddH2O 3.4 μL,总反应体积为10 μL。反应程序:95 ℃ 1 min;95 ℃ 20 s,65 ℃ 20 s,72 ℃ 30 s,40个循环;熔解曲线程序:95 ℃ 15 s,60 ℃ 60 s,95 ℃15 s。qPCR引物序列见表1。

表1 本试验中qPCR所用引物Table 1 The primers for qPCR in this test
1.4.2 rTsCRT对大鼠PBMC细胞因子转录水平的影响具体步骤同1.4.1节。实时荧光定量PCR引物序列见表1。
1.5 数据的处理与分析
使用SPSS 22.0统计软件分析数据,采用One-way ANOVA法对数据进行方差分析和差异显著性检验(*P<0.05,**P<0.01,***P<0.001),采用GraphPad Prism 8.0绘图。
2 结果与分析
2.1 CRT基因的克隆与表达
琼脂糖凝胶电泳验证扩增产物,结果显示在1 152 bp处有单一条带(图1-A);双酶切鉴定重组质粒pET-28a-CRT,在相应位置分别观察到载体与目的基因条带(图1-B);重组蛋白主要分布于上清液(图1-C),蛋白纯化效果良好,相对分子质量约为46×103(图1-D)。

图1 CRT基因的克隆表达及蛋白的表达和纯化Fig.1 CRT gene cloning and expression and protein purification A.CRT基因PCR扩增(M.DNA标准 DL2000;1.PCR产物);B. pET-28a-CRT的双酶切鉴定(M.DNA标准 DL10000;1.重组质粒经EcoRⅠ和XhoⅠ双酶切);C.重组CRT蛋白的分布情况(M.蛋白标准;1.CRT在上清液的分布;2.CRT在包涵体的分布);D.重组蛋白CRT的纯化(M.蛋白标准;1. CRT的纯化结果)。A. PCR amplification of CRT gene(M. DNA Marker DL2000;1. PCR product);B. Identification of pET-28a-CRT digested by restriction endonuclease(M. DNA marker DL10000;1. The recombinant plasmid was digested by EcoRⅠand XhoⅠ);C. Distribution of recombinant protein CRT(M. Protein marker;1. Distribution of CRT in supernatant;2. Distribution of CRT in inclusion bodies);D. Purification of recombinant proteins CRT(M. Protein marker;1.Purification results of CRT).
2.2 rTsCRT的Western blot分析
Western blot结果显示,在相对分子质量为46×103左右有一特异性条带,而阴性对照无条带(图2),说明该重组蛋白具有良好的反应原性,能够被感染旋毛虫大鼠阳性血清识别。
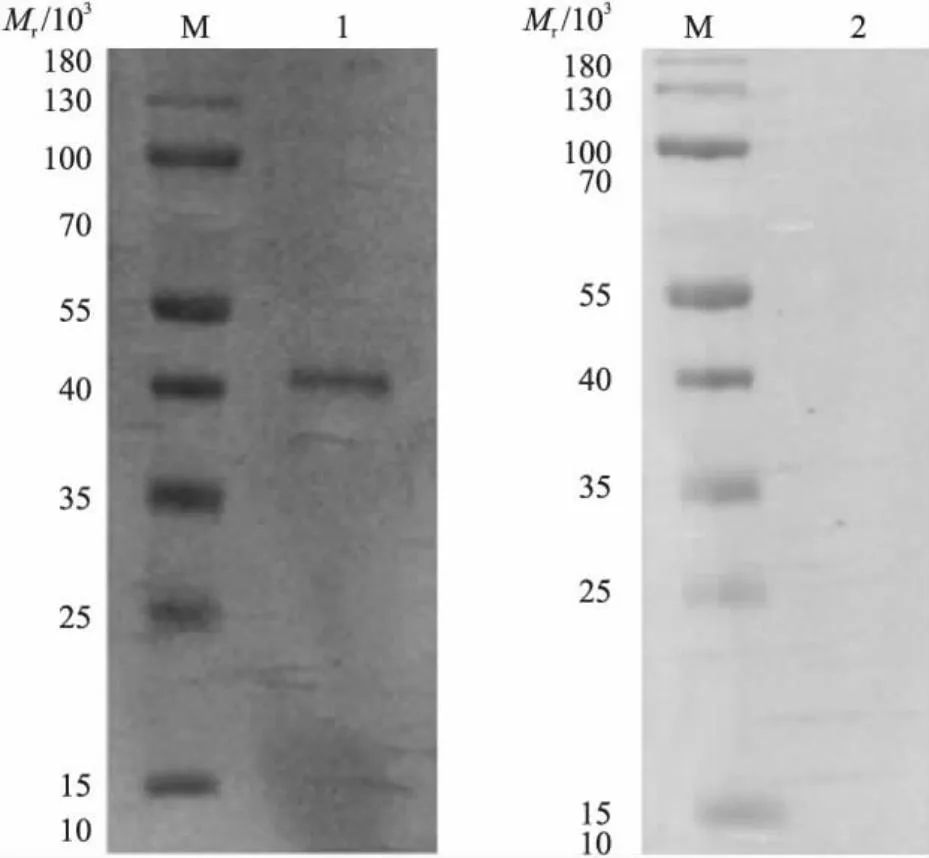
图2 重组蛋白CRT(rTsCRT)的Western blot分析Fig.2 Western blot analysis of recombinant proteins CRTM.蛋白标准品;1.rTsCRT与大鼠阳性血清;2.rTsCRT与大鼠阴性血清。M. Protein marker;1. Recombinant proteins CRT with rat positive serum;2. Recombinant proteins CRT with rat negative serum.
2.3 rTsCRT对小鼠巨噬细胞增殖的影响
细胞增殖指数(试验组吸光值/对照组吸光值)如图3所示:与空白对照组相比,5、10、20、40、80 μg·mL-1的rTsCRT均能够促进小鼠巨噬细胞的增殖。
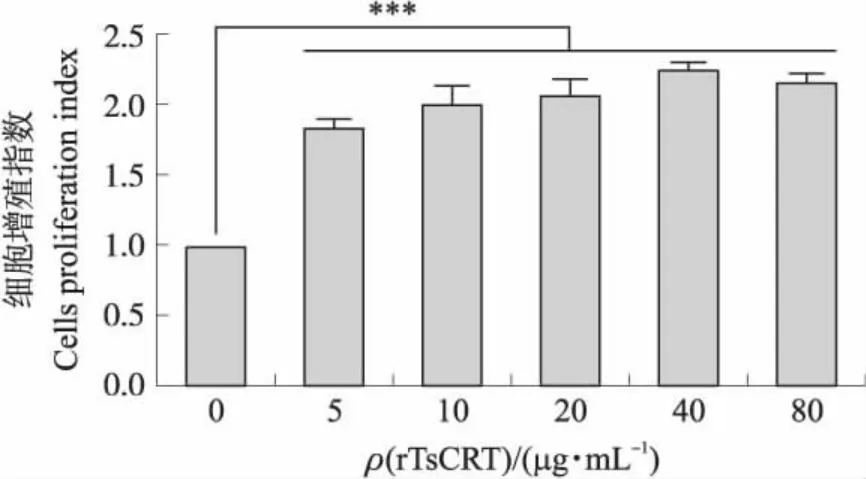
图3 rTsCRT对RAW264.7细胞增殖的影响Fig.3 The impacts of rTsCRT on RAW264.7 cells proliferation***P<0.001.The same below.
2.4 rTsCRT对小鼠巨噬细胞分泌NO的影响
从图4结果可知:与空白对照组相比,5、10、20、40、80 μg·mL-1的rTsCRT均能够促进小鼠巨噬细胞细胞分泌NO,且在重组蛋白浓度为10和20 μg·mL-1时,刺激效果最显著。
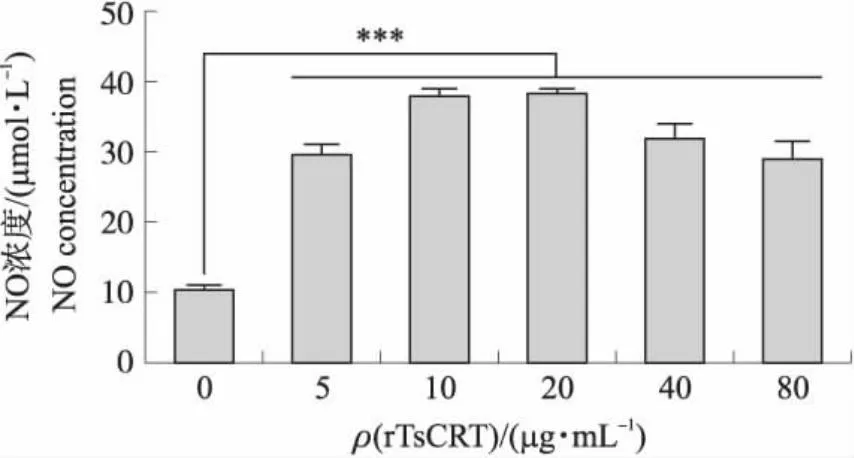
图4 rTsCRT对RAW264.7细胞NO分泌的影响Fig.4 The impacts of rTsCRT on RAW264.7 cells NO production
2.5 rTsCRT对小鼠巨噬细胞凋亡的影响
使用流式细胞仪对Annexin Ⅴ-FITC和碘化丙啶(PI)双染后的细胞进行检测。结果如图5所示,与空白对照组相比,不同浓度的rTsCRT均能够抑制小鼠巨噬细胞的凋亡,且在重组蛋白浓度为20 μg·mL-1时,抑制程度最显著。

图5 rTsCRT对RAW264.7细胞凋亡影响的流式细胞检测(A)和凋亡率统计(B)Fig.5 Flow cytometry detection(A)and apoptosis rate statistics(B)of the impacts of rTsCRT on RAW264.7 cells apoptosis
2.6 不同浓度rTsCRT对大鼠PBMC不同类型Th细胞关键转录因子转录水平的影响
结果如图6所示:与阴性对照组相比,rTsCRT对T-bet、Gata-3、PU.1都具有显著抑制作用(P<0.05),其中重组蛋白浓度在10 μg·mL-1时对T-bet和Gata-3的抑制效果最明显。该蛋白能够显著刺激Foxp3和Ahr(P<0.05)的表达,其中对Ahr的刺激效果最为明显。重组蛋白在10 μg·mL-1时能显著刺激RORγt和Bcl-6(P<0.05)的转录,而在浓度20、40 和80 μg·mL-1时与阴性对照组相比无显著差异。

图6 rTsCRT对大鼠PBMC转录因子转录水平的影响Fig.6 Effects of rTsCRT on the transcription factor transcription levels in rat PBMC
2.7 不同浓度rTsCRT对大鼠PBMC细胞因子转录水平的影响
结果如图7所示:与阴性对照组相比,rTsCRT对IFN-γ、IL-17、IL-10、IL-9和IL-22的表达都具有显著刺激作用(P<0.05),其中对IL-17和IL-22的刺激效果最明显。重组蛋白浓度在20和40 μg·mL-1时能显著刺激TGF-β(P<0.05)的表达。该蛋白能够显著抑制IL-21的转录水平(P<0.05),且对IL-21的抑制作用随蛋白浓度的升高而减弱。同时该蛋白在10和20 μg·mL-1能显著抑制IL-4的转录(P<0.05),但浓度为80 μg·mL-1时能显著刺激其转录。
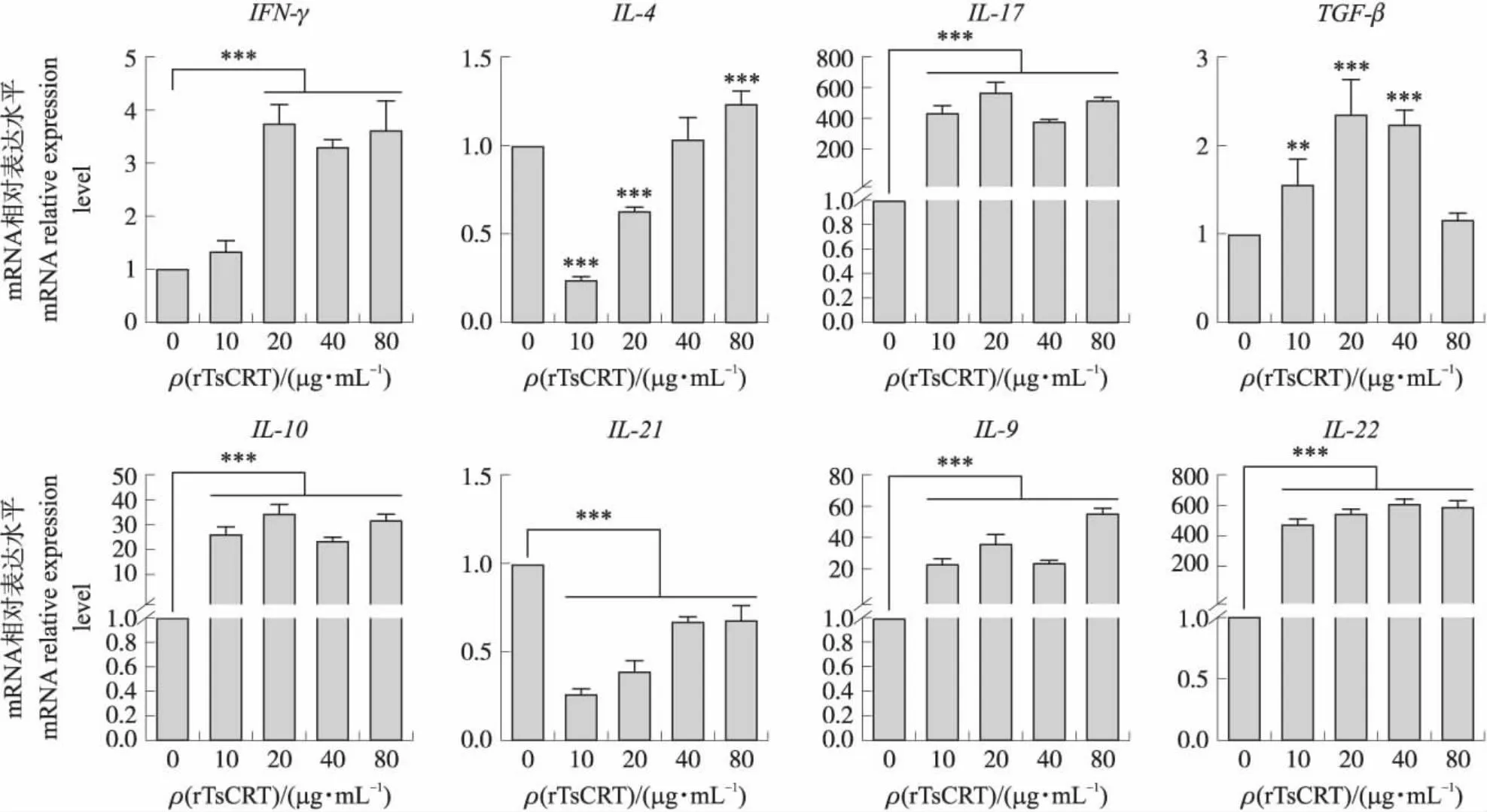
图7 rTsCRT对大鼠PBMCs细胞因子转录水平的影响Fig.7 Effects of rTsCRT on the cytokines transcription levels in rat PBMC
3 讨论与结论
巨噬细胞是机体免疫反应中的一种重要免疫细胞,参与大部分先天性免疫和获得性免疫反应,在炎症和宿主防御中起着重要作用[11]。病原体感染宿主,巨噬细胞能够通过吞噬作用及分泌不同的细胞因子和释放NO等发挥免疫功能。因此,本试验通过测定小鼠巨噬细胞增殖、凋亡和NO分泌这些免疫指标,从而明确rTsCRT与宿主免疫细胞之间的作用关系。细胞增殖对机体免疫反应非常重要,能够帮助细胞参与宿主防御病原体的入侵过程。细胞凋亡通常在发育和衰老过程中发生,以维持组织中细胞群的稳[12]。本研究结果显示,rTsCRT在与小鼠巨噬细胞共孵育后能够极显著促进其增殖功能及NO的释放,并抑制其凋亡功能。这表明该蛋白能通过多种机制调节宿主免疫细胞发挥功能,有利于机体排出或杀死旋毛虫。
外周血单个核细胞(PBMC)是一类包含淋巴细胞、单核细胞和树突状细胞在内的混合细胞,在免疫系统中起重要作用[2]。PBMC收集与分离方法较为成熟,被广泛运用于多种试验研究中[13]。本试验前期结果已初步表明CRT对小鼠巨噬细胞具有一定的影响,而旋毛虫入侵宿主过程复杂,且多种免疫细胞均参与其中,因此选用大鼠PBMC继续探究CRT对其的影响能够更好地模拟旋毛虫在感染宿主过程中对宿主免疫系统产生的影响。
幼稚CD4+T细胞分化为不同的Th细胞亚群取决于诸多因素,特定的刺激条件能够影响转录因子的表达,决定T细胞将遵循的分化程序,从而影响细胞因子的生产。Th1亚群需要IL-12的刺激而进行分化,产生IFN-γ作为其标志性细胞因子,受转录因子T-bet调节,对细胞内病原体的免疫很重要;Th2亚群需要IL-4的刺激而进行分化,受转录因子Gata-3调节,介导针对细胞外病原体的免疫应答;Th17亚群需要IL-21进行分化,产生IL-17作为其标志性细胞因子,受转录因子RORγt调节;调节性T细胞亚群需要TGF-β的刺激而进行分化,受转录因子Foxp3调节,对于维持自我耐受和调节免疫至关重要。研究表明,缺乏T-bet和GATA3表达的Treg细胞能够上调RORγt表达并获得产生IL-17的能力;且T-bet和Gata-3的动态表达以及T-bet、Gata-3、RORγt和Foxp3之间的交叉调节对于维持Treg功能非常重要[14]。本研究中,与PBS组相比,rTsCRT能够显著下调T-bet和GATA-3表达,同时产生更高水平的转录因子Foxp3和RORγt,与先前报道[14]结果类似。
细胞因子的表达模式表征了单Th细胞亚群,并决定了它们在宿主防御中的功能[15]。当寄生虫感染发生时,细胞介导的免疫对于阻止寄生虫的寄生有着很重要的作用[16]。旋毛虫在感染早期,可诱导宿主中Th1/Th2免疫应答[17]。IFN-γ是Th1细胞和CD8+T细胞的关键细胞因子[18]。它可以激活巨噬细胞和树突状细胞,刺激MHC-肽复合物的表达增加,并防御细胞内感染[19]。IL-4以自分泌的方式促进Th2细胞分化,其转录水平可反映Th2型免疫应答。先前研究发现旋毛虫感染期间Th17和Treg反应的相互发展对于免疫保护和免疫病理学的平衡很重要,增加的TGF-β可能有助于Th17的早期增加[20],而由此产生的IL-17通过介导空肠肌肉的收缩,帮助蠕虫排出[21]。本研究中,与PBS组相比,rTsCRT在与大鼠PBMC共孵育后,能产生更高水平的Th1类细胞因子(IFN-γ)、Th17类细胞因子(IL-17)、Treg类细胞因子(IL-10和TGF-β)、Th9类细胞因子(IL-9)以及Th22类细胞因子(IL-22),表明rTsCRT能够刺激大鼠产生Th1、Th17、Treg、Th9、Th22等多种类型的免疫反应。rTsCRT能显著抑制Tfh类细胞因子(IL-21)的表达,且在蛋白浓度为10和20 μg·mL-1时,显著抑制了Th2类细胞因子(IL-4)的表达。这表明rTsCRT可以抑制Th2和Tfh免疫反应。除此之外,PBMC细胞因子转录水平变化情况还显示,IL-17一直处于较高的转录水平,且TGF-β的转录水平也上调,这表明rTsCRT在宿主体内可能会通过引起宿主空肠肌肉的收缩来达到排除虫体的效果。
综上所述,本研究证实旋毛虫钙网蛋白(TsCRT)主要通过刺激巨噬细胞活化、增殖,抑制其凋亡来发挥免疫作用;rTsCRT可显著促进大鼠IFN-γ、IL-17、IL-10、TGF-β、IL-9、IL-22等细胞因子的表达,抑制IL-4、IL-21等表达,结果说明TsCRT可刺激宿主产生Th1、Th17、Treg、Th9、Th22等多种类型的免疫反应,抑制Th2和Tfh免疫,对宿主免疫调节作用复杂。

