NDM-5-C208A突变大肠埃希菌的构建及大蒜辣素与NDM-5相互作用位点分析
叶志滨,王晓明,吕茜,刘雨桐,金季赜晓,朱馨艺,黄金虎,王丽平
(南京农业大学动物医学院,江苏 南京 210095)
由于抗生素长期在临床治疗和畜禽养殖上的不规范使用,各类细菌的耐药性日益严重,尤其对碳青霉烯类抗生素耐药的肠杆菌(carbapenems resistance enterobacteria,CRE)严重威胁公共卫生安全,已被世界卫生组织(WHO)列为对人类健康威胁最大的超级细菌以及急需开发新型抗生素的极为重要病原体之一[1-2]。CRE菌株可产生水解β-内酰胺类抗生素的碳青霉烯酶,其中最常见的是新德里金属-β-内酰胺酶(New Delhi metallo-β-lactamase,NDM),其活性中心有2个锌离子,能广泛水解除氨曲南之外的β-内酰胺类抗生素,是临床β-内酰胺类抗生素的头号威胁[3-4]。NDM自2009年首次在印度新德里发现之后便在全球广泛流行,极大地限制了碳青霉烯类及其他β-内酰胺类药物的使用,致使“超级细菌”的威胁日益严重[5-7]。迄今为止,NDM已产生了三十多种变体,在人群、动物和环境中分布较为广泛的是NDM-5[8]。研究证实经典的β-内酰胺酶抑制剂如克拉维酸、舒巴坦和他唑巴坦等对NDM均无效。开发新型抗耐药菌药物难度大、成本高、周期长,因此,筛选NDM酶特异性抑制剂以遏制其对现有抗生素的灭活成为抗碳青霉烯耐药菌药物研发的首选方案。
大蒜是药食两用植物,已有数千年的应用历史。研究发现大蒜中的活性成分大蒜辣素(allicin,化学名为二丙烯基硫代亚磺酸酯)具有显著的抗菌活性[9]。本课题组前期研究发现,大蒜辣素不仅具有直接的抗菌活性,而且大蒜辣素能通过有效抑制NDM活性,恢复碳青霉烯类抗生素对产NDM大肠埃希菌的抑菌活性,但其与NDM酶的互作位点及具体抑制机制尚未阐明。因此,本研究基于分子对接的预测结果,进一步通过定点突变方法研究了NDM-5的Cys208位点对NDM-5活性的影响,以及大蒜辣素联用美罗培南对NDM野生型和Cys208突变菌株的抑菌作用差异,初步探讨大蒜辣素的抑酶活性以及与NDM-5的互作位点,以期为开发和应用大蒜辣素作为金属-β-内酰胺酶抑制剂提供理论支持。
1 材料与方法
1.1 材料
1.1.1 菌株携带NDM-5酶表达基因的工程菌株大肠埃希菌BL21(DE3)pET21a-NDM-5由本实验室构建并保存,大肠埃希菌ATCC-25922购于中国兽医药品监察所。
1.1.2 仪器与试剂PCR仪、核酸电泳槽、蛋白电泳槽和凝胶成像系统均购于美国Bio-Rad公司;Ni-NTA镍柱购于上海生工生物公司;细胞超声波破碎仪购于宁波新芝生物科技有限公司;Synergy H1酶标仪购于美国伯腾仪器有限公司;定点突变试剂盒购于南京诺唯赞生物科技有限公司;LB肉汤、LB琼脂、MH肉汤均购于青岛海博生物技术有限公司;蒜粉(潜在大蒜辣素含量为1.603%)由新疆医科大学提供;阿莫西林(≥ 98%)、氨苄西林(≥ 98%)、头孢呋辛(≥ 98%)、头孢他啶(≥ 98%)、头孢噻肟(≥ 99.5%)、美罗培南(≥ 98%)购自上海阿拉丁生化科技有限公司;咪唑、苯甲基磺酰氟(PMSF)和异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购自北京索莱宝科技有限公司;SDS-PAGE快速配胶试剂盒购于雅酶生物公司。
1.2 方法
1.2.1 分子对接选择蛋白数据库中的NDM-5(PDB:6MGY)作为受体,ZINC数据库中的大蒜辣素(ZINC:1530846)作为配体。在AutoDock中对NDM-5进行去水、加氢处理,对大蒜辣素加氢后进行分析。在软件中将处理后的NDM-5与大蒜辣素执行刚性蛋白质和柔性配体的标准对接程序,对软件给出的结合位点进行筛选。
1.2.2 NDM-5突变体工程菌株的构建采用点突变试剂盒对本实验室前期构建的质粒pET21a-NDM-5进行点突变,具体方法参照说明书。根据碱基变动尽量少的原则设计突变引物,将NDM-5第208位活性位点半胱氨酸(Cys,C)突变为惰性氨基酸丙氨酸(Ala,A)。上游引物设计为NDM-5-C208A-F:5′-TTTGGTGGCGCCCTGATCAAGGACAGCAAGGCC-3′,下游引物设计为NDM-5-C208A-R:5′-ATCAGGGCGC-CACCAAAAGCGATGTCGGTGCC-3′,下划线处为突变位置。参考说明书优化扩增体系和反应程序,扩增体系包括:25 μL 2×Max Buffer、1 μL dNTP Mix、10 ng DNA、2 μL上游引物、2 μL下游引物、1 μL DNA Polymerase,加ddH2O至50 μL。反应程序:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 6 min,共18个循环;72 ℃ 5 min。使用DpnⅠ酶特异性识别并消化反应产物中原始的甲基化模板质粒,防止原始质粒干扰形成假阳性克隆。用Exnase Ⅱ酶催化扩增消化产物,将突变位点进行高效重组,实现线性DNA的体外环化。将产物转入感受态大肠埃希菌BL21(DE3),在氨苄青霉素抗性的LB平板上涂布后于37 ℃静置过夜培养。次日挑取阳性克隆转接至氨苄抗性LB肉汤,37 ℃振摇培养8 h后菌液送南京生工生物公司测序。将测序结果正确的转化子命名为大肠埃希菌BL21(DE3)pET21a-NDM-5-C208A,甘油保存。
1.2.3 NDM-5突变体转化子的抗生素表型验证根据EUCAST推荐的微量肉汤稀释法[10]测定6种 β-内酰胺类抗生素氨苄西林、阿莫西林、头孢呋辛、头孢噻肟、头孢他啶和美罗培南对大肠埃希菌BL21(DE3)pET21a-NDM-5和大肠埃希菌BL21(DE3)pET21a-NDM-5-C208A的最小抑菌浓度(MIC),大肠埃希菌ATCC25922作为质控菌株。根据EUCAST敏感性折点进行菌株耐药性评价[11]。各药物折点分别为氨苄西林<8 μg·mL-1、阿莫西林<8 μg·mL-1、头孢呋辛<8 μg·mL-1、头孢噻肟<1 μg·mL-1、头孢他啶<1 μg·mL-1和美罗培南<2 μg·mL-1。
1.2.4 不同浓度的大蒜辣素对NDM-5野生型和突变体菌株生长的影响将大肠埃希菌BL21(DE3)pET21a-NDM-5和BL21(DE3)pET21a-NDM-5-C208A接种于LB肉汤中过夜培养后,调整菌液浓度D600值为0.1后均匀加入96孔板,除对照组外,每孔再加入不同梯度终浓度的大蒜辣素,于37 ℃恒温培养。每隔4 h测定D600,绘制不同菌株的生长曲线。
1.2.5 NDM-5突变体的表达与纯化挑选测序与表型结果符合预期的大肠埃希菌BL21(DE3)pET21a-NDM-5-C208A转接至LB肉汤中,37 ℃过夜振荡培养。将过夜培养物按1∶100稀释至1 L的新鲜LB肉汤中,培养至菌液的D600值为0.6~0.8时,加入终浓度为0.2 mmol·L-1的IPTG,转入30 ℃摇床中振荡培养 16 h。12 000g离心30 min后弃上清液,用平衡缓冲液重悬沉淀并加入终浓度为1 mmol·L-1的PMSF以保护蛋白,将重悬混合液在冰浴条件下进行超声破碎,功率为35 W,破碎5 s,暂停10 s,共超声15 min。12 000g离心30 min后取上清液,将上清液加至平衡液平衡好的Ni-NTA柱,用梯度浓度(20~500 mmol·L-1)的咪唑缓冲液冲洗柱子并收集各洗脱液,将各洗脱液逐一进行SDS-PAGE验证。把含有单一目的条带的洗脱液混合后用截留蛋白相对分子质量为10×103的超滤离心管进行换液和浓缩。SDS-PAGE验证浓缩液纯度后,Nanodrop检测浓缩液中的蛋白浓度。
1.2.6 NDM-5突变体的酶活性测定为测定所得NDM-5-C208A突变对酶活性的影响,比较相同浓度的NDM-5与NDM-5-C208A对底物美罗培南的水解能力。参考文献[12]的方法,略作优化后进行测定。水解反应于96孔板中进行,每孔分别加入100 μL稀释后终浓度为20 nmol·L-1的NDM-5和NDM-5-C208A,接着每孔均加入100 μL终浓度为200 μmol·L-1美罗培南溶液,温和振荡96孔板使酶与底物充分接触,迅速放入酶标仪,于30 ℃检测D300值的变化,每隔1 min检测1次,持续检测30 min。将2组底物美罗培南吸光值的下降量除以各自反应时间分别得到NDM-5和NDM-5-C208A的水解速率vWT和vMT。设定NDM-5的酶活性为100%,则NDM-5-C208A的酶活性为(vMT/vWT)×100%。
1.2.7 大蒜辣素对NDM-5及突变体NDM-5-C208A的抑制活性比较构建反应体系测定大蒜辣素对NDM-5和NDM-5-C208A的酶抑制情况。于96孔板中进行反应,每孔分别加入50 μL终浓度为20 nmol·L-1的NDM-5和NDM-5-C208A,与梯度浓度大蒜辣素(0、2.5、5、10、20和40 μmol·L-1)于30 ℃下孵育30 min。接着加入100 μL终浓度为200 μmol·L-1的美罗培南溶液后立刻放入酶标仪中检测30 min内D300的变化。计算对照组中酶水解速率(v0),大蒜辣素处理后的酶水解速率(vi),以2组对照组中的酶活性为100%,剩余酶活性为(vi/v0)×100%。
1.2.8 大蒜辣素联合美罗培南对NDM-5野生型和NDM-5-C208A突变菌株的联合抑菌活性采用微量肉汤棋盘稀释法[13]测定大蒜辣素与美罗培南联合对NDM-5野生型菌株和NDM-5-C208A突变菌株的联合抑菌活性。反应于96孔板中进行,在6×6范围内将二倍梯度稀释的2种药物分别与2株细菌悬液(1.5×106CFU·mL-1)混合,于37 ℃温箱中静置培养18 h。根据公式计算联合抑菌指数(FICI):FICI=FICIa+FICIb=MICab/MICa+MICba/MICb。式中:MICa是化合物A单独的MIC;MICab是联用药物时化合物A的MIC;MICb为化合物B单独的 MIC;MICba是联用药物时化合物B的MIC。判读标准:FICI≤ 0.5为协同作用;0.5
1.2.9 不同浓度的大蒜辣素对NDM-5野生型和突变体菌株的时间杀菌曲线将大肠埃希菌BL21(DE3)pET21a-NDM-5和BL21(DE3)pET21a-NDM-5-C208A过夜培养后,以1∶1 000稀释于LB肉汤后进行如下药物处理:对大肠埃希菌BL21(DE3)pET21a-NDM-5,分别设美罗培南处理组(32 μg·mL-1,1/4MIC)、大蒜辣素处理组(8 μg·mL-1,1/2MIC)、美罗培南(32 μg·mL-1,1/4MIC)+大蒜辣素(8 μg·mL-1,1/2MIC)联合处理组,以及不加药的空白对照组;对突变菌株BL21(DE3)pET21a-NDM-5-C208A,分别设美罗培南处理组(0.004 μg·mL-1,1/4MIC)、大蒜辣素处理组(4 μg·mL-1,1/2MIC)、美罗培南(0.004 μg·mL-1,1/4MIC)+大蒜辣素(4 μg·mL-1,1/2MIC)联合处理组,以及不加药的空白对照组。处理完毕后于37 ℃振荡培养24 h,每隔6 h分别吸取100 μL菌液用无菌PBS系列梯度稀释后进行活菌计数,以时间为横轴、lgCFU为纵轴绘制时间杀菌曲线。
2 结果与分析
2.1 关键结合位点的确认及NDM-5 C208A转化子的鉴定
经过AutoDock软件的模拟对接,得到大蒜辣素与NDM-5的结合模式图(图1-A)。大蒜辣素与NDM-5有4个可能结合的位点,其中只有Cys208位于酶活性口袋处,推测其对维持酶活性有重要作用,故选择Cys208为关键位点进行突变。对转化后的突变子疑似阳性克隆进行测序,将测序结果与NDM-5的序列进行比较,结果(图1-B)显示已成功将Cys208突变为Ala208,且未发现其他突变,符合后续试验要求。将成功构建的NDM-5-C208A突变载体命名为pET21a-NDM-5-C208A,菌株命名为大肠埃希菌BL21(DE3)pET21a-NDM-5-C208A。
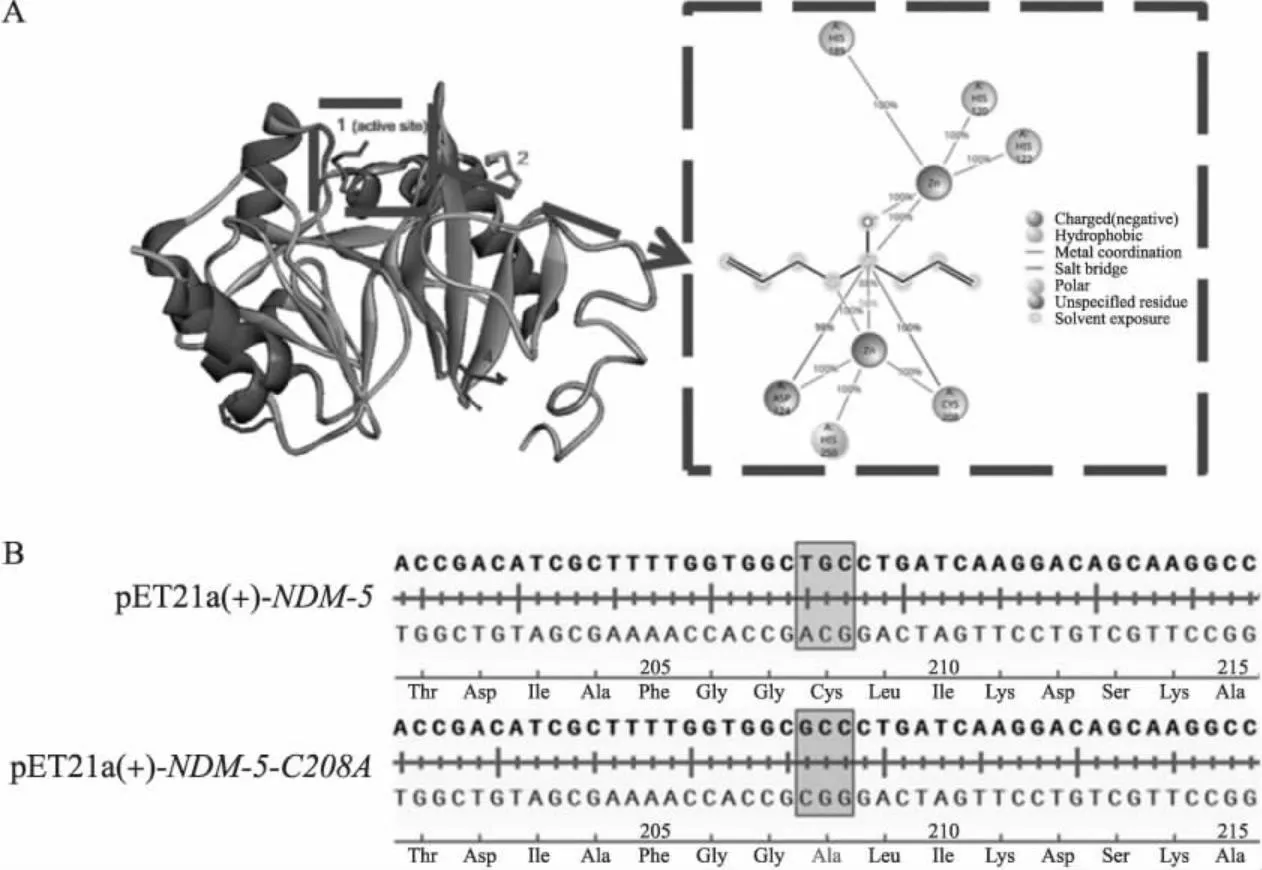
图1 大蒜辣素与NDM-5结合位点预测(A)及NDM-5-C208A转化子序列鉴定(B)Fig.1 Binding sites prediction of allicin with NDM-5(A)and sequence identification of NDM-5-C208A transformants(B)
2.2 不同抗生素和大蒜辣素对NDM-5-C208A突变菌株和野生型菌株的MIC
通过药敏试验检测转化子对6种抗生素的敏感性见表1。NDM-5野生型菌株 BL21(DE3)pET21a-NDM-5与NDM-5-C208A突变菌株BL21(DE3)pET21a-NDM-5-C208A均对氨苄西林和阿莫西林表现出耐药;NDM-5野生型菌株BL21(DE3)pET21a-NDM-5对头孢呋辛、头孢噻肟、头孢他啶和美罗培南表现为耐药,但是NDM-5的Cys208位点突变为Ala后,菌株对头孢呋辛、头孢噻肟、头孢他啶和美罗培南则会恢复敏感,表明NDM-5-C208位点对水解头孢类和碳青霉烯类抗生素非常关键。

表1 β-内酰胺类抗生素和大蒜辣素对重组菌株的MICTable 1 MIC of β-lactam antibiotics against recombinant strains
2.3 大蒜辣素对NDM-5菌株突变前后生长曲线的影响
通过测定生长曲线以判断大蒜辣素对大肠埃希菌BL21(DE3)pET21a-NDM-5和大肠埃希菌BL21(DE3)pET21a-NDM-5-C208A的生长是否有影响。从图2可知,大蒜辣素对大肠埃希菌BL21(DE3)pET21a-NDM-5的生长有一定的抑制作用,当大蒜辣素浓度为16 μg·mL-1时则可完全抑制其生长。显示大蒜辣素对NDM-5突变型大肠埃希菌的生长抑制存在剂量-效应关系,当大蒜辣素浓度为4 μg·mL-1时,处理组和对照组无显著差异(P>0.05),而当大蒜辣素浓度升高至8 μg·mL-1时则能完全抑制其生长。这表明大蒜辣素对野生型和NDM-5-C208A突变菌均有直接抑制作用。
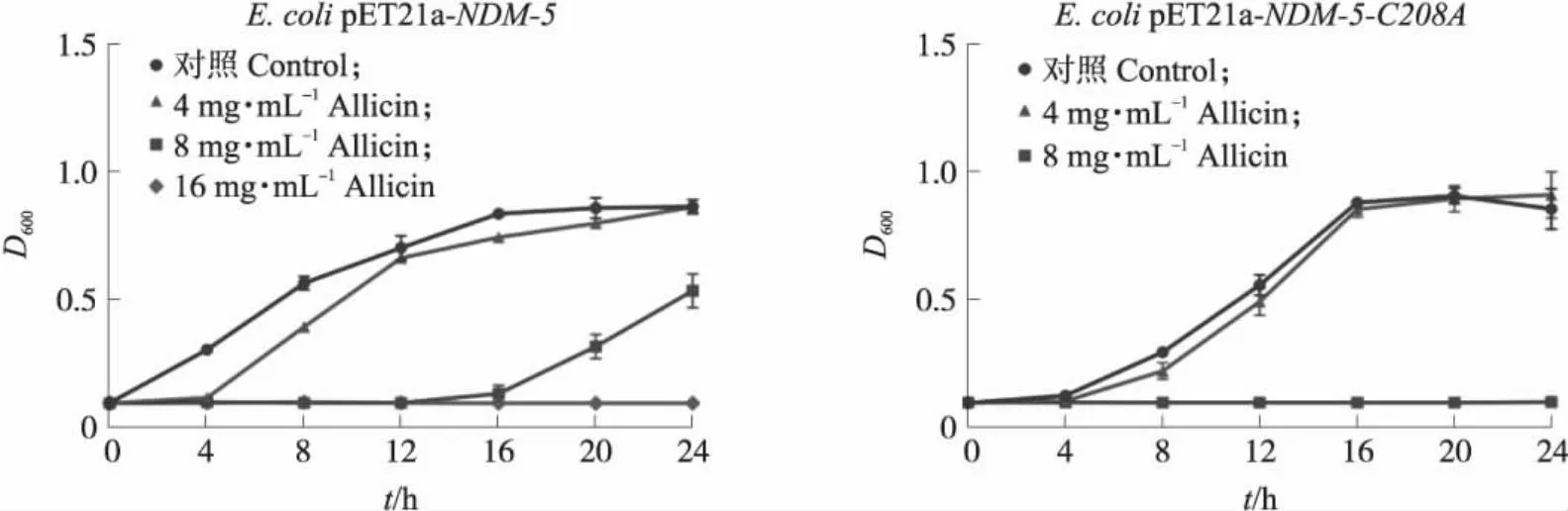
图2 不同质量浓度大蒜辣素处理后大肠埃希菌的生长曲线Fig.2 Growth curves of E.coli strains treated with different concentrations of allicin
2.4 NDM-5-C208A蛋白的纯化及活性测定
对突变体蛋白进行大量表达和纯化浓缩后,SDS-PAGE电泳分析验证蛋白纯度。图3-A显示蛋白相对分子质量符合预期24×103,且条带单一,纯度>90%,采用Nanodrop测定突变型蛋白浓度为3.8 mg·mL-1,表明突变体蛋白纯化成功,能满足后续试验要求。将纯化后的NDM-5和NDM-5-C208A进行活性测定。将NDM-5的水解活性设为100%,则NDM-5-C208A水解底物美罗培南的酶活性极显著下降(P<0.001),与野生型NDM-5相比,突变体的酶活性下降约85%(图3-B),表明Cys208位点是NDM-5维持水解活性的关键位点。

图3 NDM-5-C208A的表达纯化(A)及酶活性测定(B)Fig.3 Expression and purification of NDM-5-C208A(A)and the determination of the enzyme activity of NDM-5-C208A(B)M. 蛋白标准品Protein marker. ***P<0.001.
2.5 大蒜辣素对NDM-5和NDM-5-C208A的抑制效果
不同浓度大蒜辣素分别作用于NDM-5和NDM-5-C208A,将无大蒜辣素处理组的酶活性定义为100%,通过与各自的对照组比较计算其剩余的酶活性。从图4可知:10~40 μmol·L-1的大蒜辣素均对NDM-5酶活性有极极显著的抑制作用(P<0.000 1),并存在明显的剂量效应;不同浓度的大蒜辣素对NDM-5-C208A的酶活性影响均不显著(P>0.05)。
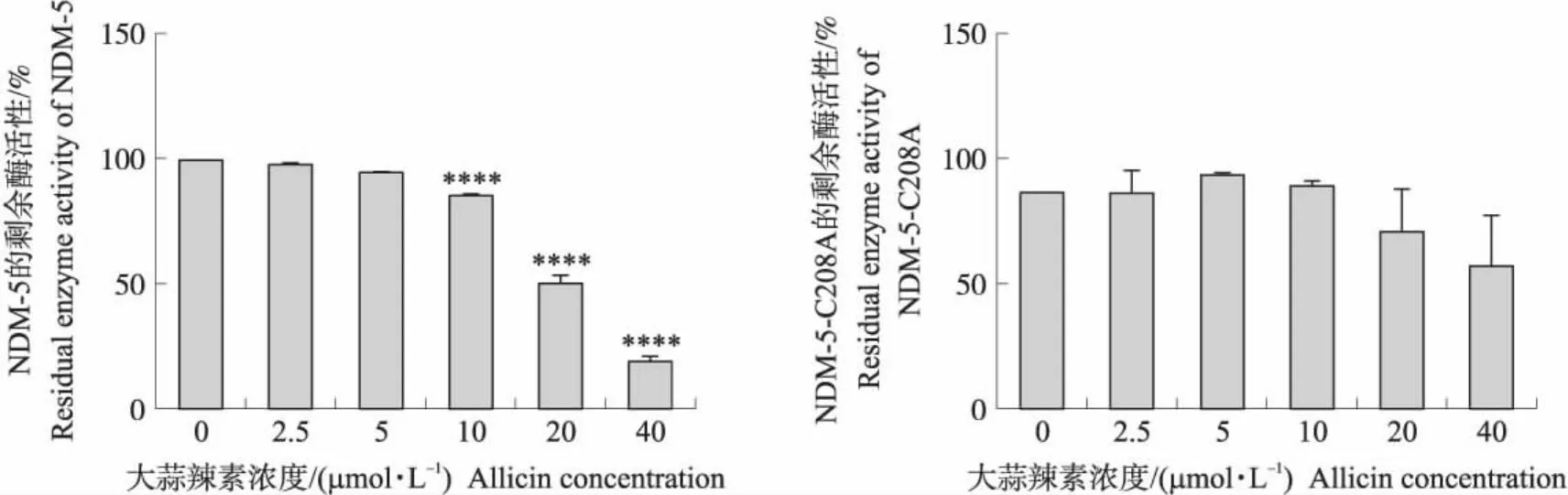
图4 不同浓度大蒜辣素处理后NDM-5和NDM-5-C208A的酶活性比较Fig.4 Residual enzyme activity of NDM-5 and NDM-5-C208A treated with different concentrations of allicin****P<0.000 1.
2.6 大蒜辣素联合美罗培南对NDM-5的Cys208位点突变前后菌株的联合抑菌作用比较
从图5可知,大蒜辣素联合美罗培南对大肠埃希菌BL21(DE3)pET21a-NDM-5的FICI为0.375,表示二者对其有协同抑菌作用,二者联用对突变菌BL21(DE3)pET21a-NDM-5-C208A的FICI为2,表现为独立作用,失去协同抗菌作用。

图5 美罗培南和大蒜辣素联用对NDM-5阳性菌株(A)及其C208A突变后菌株(B)的作用结果Fig.5 The effect of combination of meropenem and allicin on NDM-5 positive strain(A) and its C208A mutation strain(B)
时间杀菌曲线(图6)显示亚抑菌浓度的大蒜辣素与美罗培南单独使用均不能有效杀灭大肠埃希菌BL21(DE3)pET21a-NDM-5,但是二者即使采用亚抑菌浓度进行联用也能抑制细菌的生长并表现出了明显的杀菌效果;若菌株的NDM-5发生C208A突变后,大蒜辣素和美罗培南则无明显的联合杀菌效果。细菌体内试验再次证实NDM-5的Cys208是大蒜辣素对酶发挥抑制作用的关键位点。
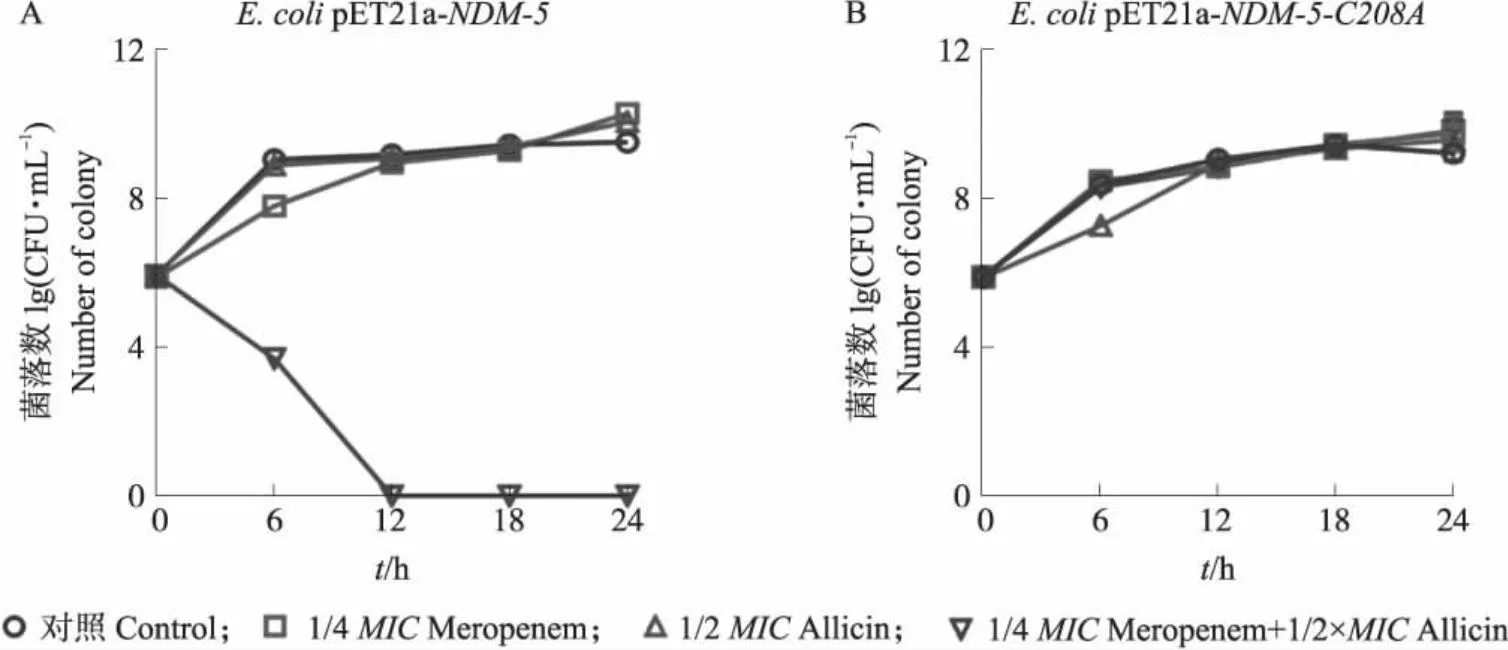
图6 大蒜辣素和美罗培南联合对NDM-5野生型菌株(A)及Cys208突变菌株(B)的时间杀菌曲线Fig.6 Time-dependent killing curve of the combination of allicin and meropenem against NDM-5 wild type strain(A)and its Cys208 mutation strain(B)
3 讨论
近年来,耐药菌的产生和传播以及相关有效药物的缺乏已成为威胁公众健康的重要问题[14]。碳青霉烯类抗生素是人医临床抗革兰阴性菌感染的“最后一道防线”[15]。但近些年来不断有研究显示人、动物及其所处环境中均能检测到介导细菌对碳青霉烯类耐药的NDM基因,并存在不同生态位的水平传播。人医临床中也发现碳青霉烯类抗生素逐渐失去了应有的治疗效果[16-18]。NDM可以水解除氨曲南之外的所有β-内酰胺类抗生素,因此,NDM在畜禽中的检出对兽医临床常用的青霉素类及专用的头孢类抗生素的活性也会产生重要影响。NDM导致的耐药已成为人医和兽医临床共同关注的焦点。
NDM具有典型的αβ/βα三明治结构,其中α-螺旋与β-折叠通过柔性的Loop环连接,该空间折叠结构特点使NDM对不同的β-内酰胺类抗生素都具有高度的适应性[19]。NDM的活性中心有2个Zn2+,各自可与3个氨基酸残基相互作用,Zn1与His120、His122和His189配位;Zn2则与Asp124、Cys208和His250配位,研究表明活性中心的残基对维持NDM酶水解活性至关重要,因此是较为理想的抑制剂潜在作用靶点[20]。NDM结构的解析为采用分子对接、蛋白结晶等技术用于预测和模拟受体-配体复合物结构以及结合位点提供重要基础[21]。本文则是基于模拟对接分析大蒜辣素与NDM-5的结合位点为活性保守残基Cys208,进一步通过定点突变方法成功构建出突变型载体pET21a-NDM-5-C208A,由此获得NDM-5的C208位点突变菌株,并证实C208A突变可导致NDM水解头孢类抗生素和碳青霉烯类抗生素的活性下降,后续的体外酶水解试验进一步佐证了该结果。Wang等[12]发现当Cys208被突变为惰性氨基酸丙氨酸(Ala)后,NDM的酶活性约下降了80%,本研究结果与之较为一致,均证实该残基对NDM-5水解活性的重要性以及外源化合物可通过干预该位点起到抑制酶活性的作用。本试验中发现构建的C208A突变菌株对氨苄西林与阿莫西林仍表现耐药,我们分析是由于表达载体pET21a携带氨苄西林抗性,因此NDM失去了水解活性,而质粒携带的抗性基因仍在发挥作用。我们后续将通过筛选其他抗性载体进行验证。

综上所述,本研究首次探讨了大蒜辣素对NDM-5的抑制作用及其相关作用位点,提示大蒜辣素有望以一种新型的碳青霉烯类抗生素佐剂用于产NDM的CRE菌株感染治疗,并具有较好的应用前景。

