高焦混合煤气重整制备高品质高炉喷吹还原气研究
王 兴 赵 伟 冉泽洲
(1.鞍钢股份有限公司数智发展部,2.东北大学工业智能与系统优化国家级前沿科学中心)
化石燃料作为全球的主要能源,大量燃烧会导致碳排放日益增加,面对全球变暖、海平面上升等问题日益加重,降低CO2排放量是当下亟待解决的问题[1]。钢铁行业是碳排放大户,我国钢铁行业碳排占全国碳排总量约15%[2- 10]。因此降低钢铁行业的碳排放具有重大的意义。
高炉—转炉长流程冶炼是我国钢铁生产的主要方式,其中高炉工序是碳排放最多的工序,约占长流程碳排放总量的67%[2],将炉顶的高炉煤气经过CO2脱除处理后进行再循环是高炉降碳的重点方向。邢奕等[11]研究表明氧气鼓吹高炉炉顶煤气循环工艺具有煤气回收与低碳排放双重功能,生产每吨粗钢可降低CO2约30%;王广等[12]认为炉顶煤气循环与富氢联合喷吹是最可行的低碳炼铁技术方案。甲烷干重整(DRM)可以同时利用CH4、CO2两种温室气体受到了研究人员的广泛关注[13-15]。该过程是将CH4与CO2转化成合成气的一个可行途径,合成气中CO和H2是高炉还原炼铁的主要还原介质,同时也是有价值的中间体,是费托合成等过程的原料[16]。在钢铁生产过程中,高炉煤气富含CO2,约为8%~12%,焦炉煤气富含CH4,约为20%~30%[17-18]。因此,可以将焦炉煤气与高炉煤气联合起来,进行混合重整生产高品质高炉喷吹还原气,达到降低高炉碳排放的目标。
文章对甲烷—二氧化碳重整过程进行了热力学探究,计算所有可能反应的吉布斯自由能变(ΔGr)和化学反应平衡常数,分析各个反应的热力学可行区间以及化学反应限度。进一步采取吉布斯自由能最小化方法,探究温度、压力等因素的影响,确定重整过程的最佳反应条件,为高焦炉煤气混合重整生产高品质还原气奠定理论基础。
1 方法
高炉煤气与焦炉煤气主要组分如表1所示。

表1 高炉煤气与焦炉煤气主要组分 %
计算相关反应的ΔGr与平衡常数,分析反应进行的可行性;采用吉布斯自由能最小化[18]的方法获取平衡组分,分析反应进程。考虑的平衡组分为CO、H2、C、H2O、CO、CH4。模拟条件设置为500~1 000 ℃,(0~20)×105Pa,n(CH4):n(CO2)=0.4~1.6,水蒸气添加量为0~0.7 kmol,探究了反应温度、反应压力、进料配比、水蒸气的加入对CH4转化率α1、CO2转化率α2、积碳率β1的影响,其中α1、α2、β1的定义见式(1)~(3)[19]。
α1=(n1-n2)/n1
(1)
α2=(n3-n4)/n3
(2)
β1=n5/(n1+n3)
(3)
式中:n1为初始CH4物质的量;n2为平衡时CH4物质的量;n3为初始CO2物质的量;n4为平衡时CO2物质的量;n5为平衡时C物质的量。
2 结果与讨论
2.1 甲烷干重整反应分析
甲烷干重整主要由5个反应决定[20-22],如表2所示。反应式R1为主反应,反应式R2~R5为副反应。反应式R2为逆水汽变换,反应R3、R4、R5为积碳与消碳反应。

表2 混合重整过程可能发生的反应
在n(CH4)=1 kmol、n(CH4)∶n(CO2)=1∶1、105Pa、500~1 000 ℃的模拟条件下,5个反应在不同反应温度下的ΔGr与化学平衡常数的变化规律,如图1所示。其中,图1(a)显示了温度对ΔGr的影响,随着温度升高,反应R1、R2、R3的ΔGr线性减小,当R1在640 ℃、R2在800 ℃及R3在540 ℃时,ΔGr=0 kJ;而反应R4、R5的ΔGr线性增加,当R4在700 ℃、R5在680 ℃时,ΔGr=0 kJ。热力学上,ΔGr<0 kJ,反应可行。研究的目的是获得尽量大的α1和α2,尽量小的β1,应该使得主反应R1进程大,而副反应R2~R5进程小,但由于R1热力学可行的温度区间是R3的子集,故积碳行为在热力学上是不可避免的。图1(b)为温度对化学平衡常数log(K)的影响,随着温度升高,R1、R2、R3的化学平衡常数log(K)增大,R4、R5的化学平衡常数log(K)逐渐减小,温度对log(K)的影响与对ΔGr的影响正好相反。温度升高有利于增加主反应R1的平衡常数,但同时也增加了副反应R3的平衡常数,但由于R1的斜率大于R3,所以提高温度,β1降低,后续将通过吉布斯自由能最小化的方法来证明这一结论的正确性。
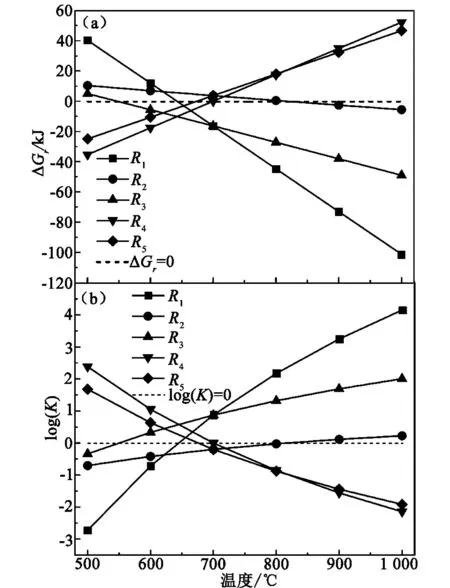
图1 温度对反应ΔGr及log(K)的影响
2.2 温度的影响
在压力105Pa、进料配比n(CH4)∶n(CO2)=1∶1、温度500~1 000 ℃的条件下,甲烷干重整过程α1、α2、β1随着温度变化规律如图2所示。图2(a)是α1、α2、β1的变化规律,随着温度升高,α1、α2升高,β1逐渐降低,即温度升高有利于降低积碳率。在低温区,α2几乎保持不变,当温度升高至600 ℃,α2增加速率显著提高,之后趋于稳定;α1则逐渐升高至趋于稳定;β1在低温区较为稳定地维持在一个较高的值(50%左右),随着温度升高到600 ℃,积碳率开始显著下降,当温度大于900 ℃时,β1降至2%以下。结合图1(a)可知,在温度较低时,热力学可行的反应为R3、R4、R5,随着温度的升高,热力学可行的反应为R1、R2、R3。这种规律同样反映在图2(b)中,在低温时,产物中C含量处于一个较高的值(1 kmol左右),CO2稳定于0.6 kmol左右,并且H2含量始终大于CO含量;升高温度,CO与H2的差越来越小,表明主反应R1逐渐成为优势反应。当温度为900 ℃时,α1、α2均在97%以上,β1在2%以下,该反应温度为较佳,后续研究也将选择900 ℃下进行。
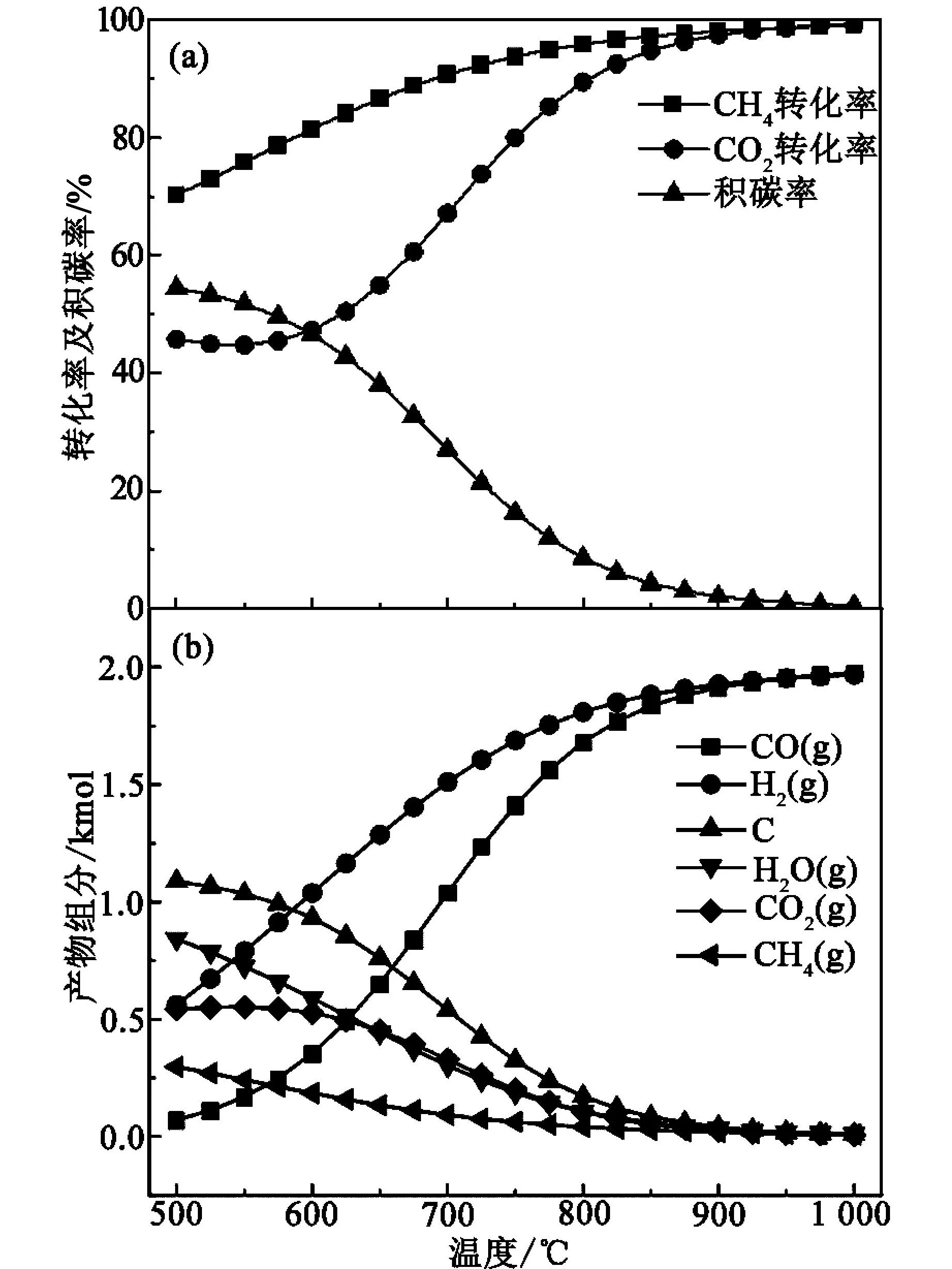
图2 温度对转化率、积碳率及平衡产物分布的影响
2.3 压力的影响
在温度900 ℃、进料配比n(CH4)∶n(CO2)=1∶1、改变压力(1~20)×105Pa的条件下,α1、α2、β1随压力变化规律以及平衡产物分布情况,如图3所示。图3(a)为α1、α2、β1的变化规律,随着压力升高,α1、α2下降幅度基本一致,β1升高。根据化学平衡移动原理可知,压力升高,R1和R3向左进行,而R4、R5向右进行,使得α1、α2下降,β1逐渐升高。需要注意的是,浓度也是主导反应进行方向的重要因素,由于R1向左进行使得CH4的浓度升高,浓度对反应平衡的影响大于压力对反应平衡的影响,进一步提高了β1。图3(b)为不同压力下反应体系平衡产物分布情况,随着压力升高,CO2、CH4及C的含量均逐渐升高。在105Pa的条件下,反应体系具有最大的α1、α2及最小的β1,为了工业操作的简便,常压为较佳的反应压力,后续研究在105Pa进行。
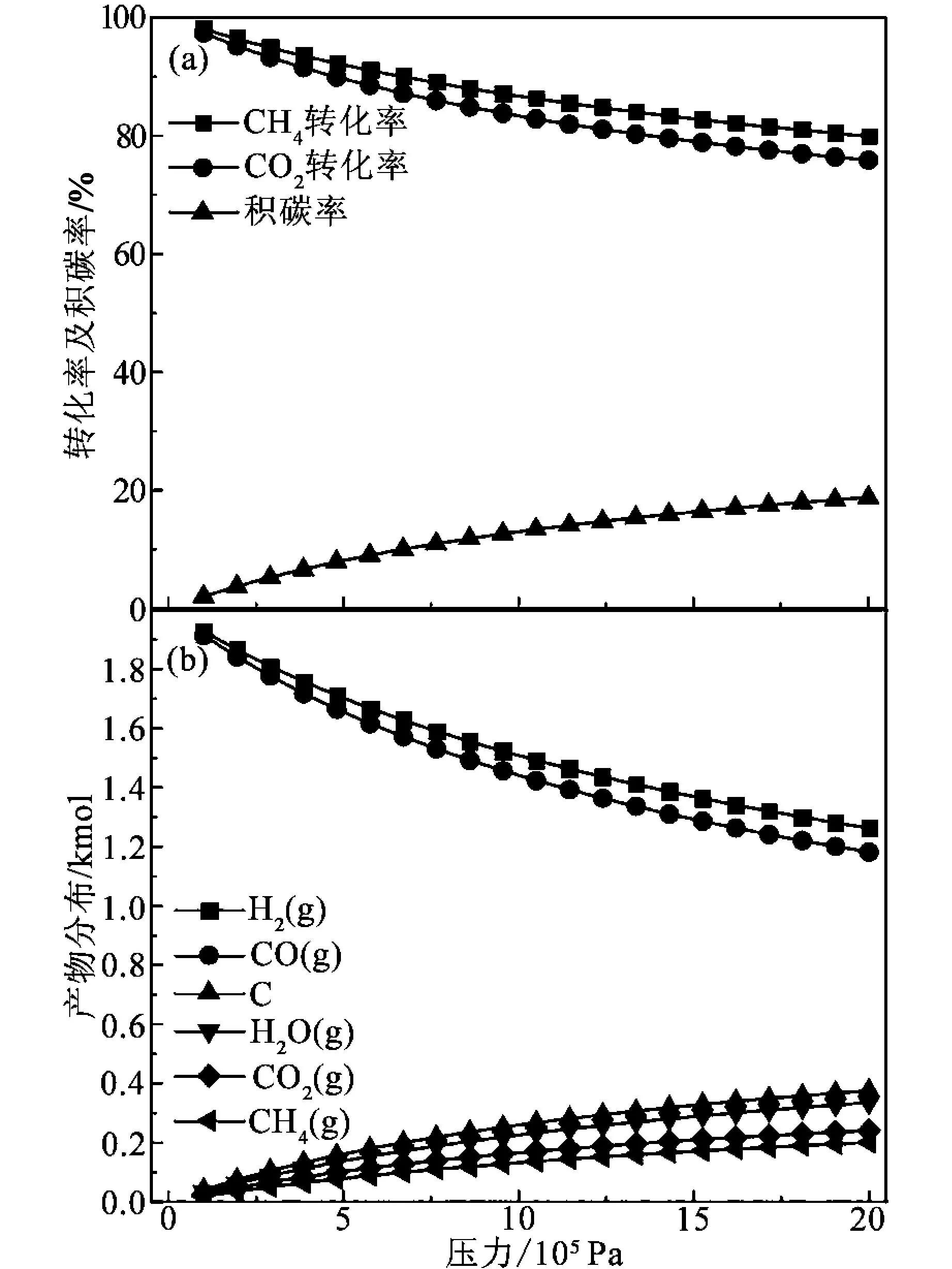
图3 压力对转化率、积碳率及平衡产物分布的影响
2.4 进料配比的影响
在温度900 ℃、压力105Pa、进料配比n(CH4)∶n(CO2)=0.4~1.6的条件下,α1、α2、β1随进料配比的变化规律如图4所示。当n(CH4)∶n(CO2)>1时,降低初始CH4含量,α1与α2均保持在一个较高的值(97%),而β1逐渐降低;当n(CH4)∶n(CO2)<1时,降低初始CH4含量,α1增长到99%以上,而α2则迅速下降,此时β1开始下降直至0%。原因是,当n(CH4)∶n(CO2) >1时,CH4的量减少,会降低R3的反应限度,从而使得平衡时C含量下降;当n(CH4)∶n(CO2)<1时,反应R1与R3均受到抑制,导致了α2迅速下降。因此,n(CH4)∶n(CO2)=1∶1为最佳条件。
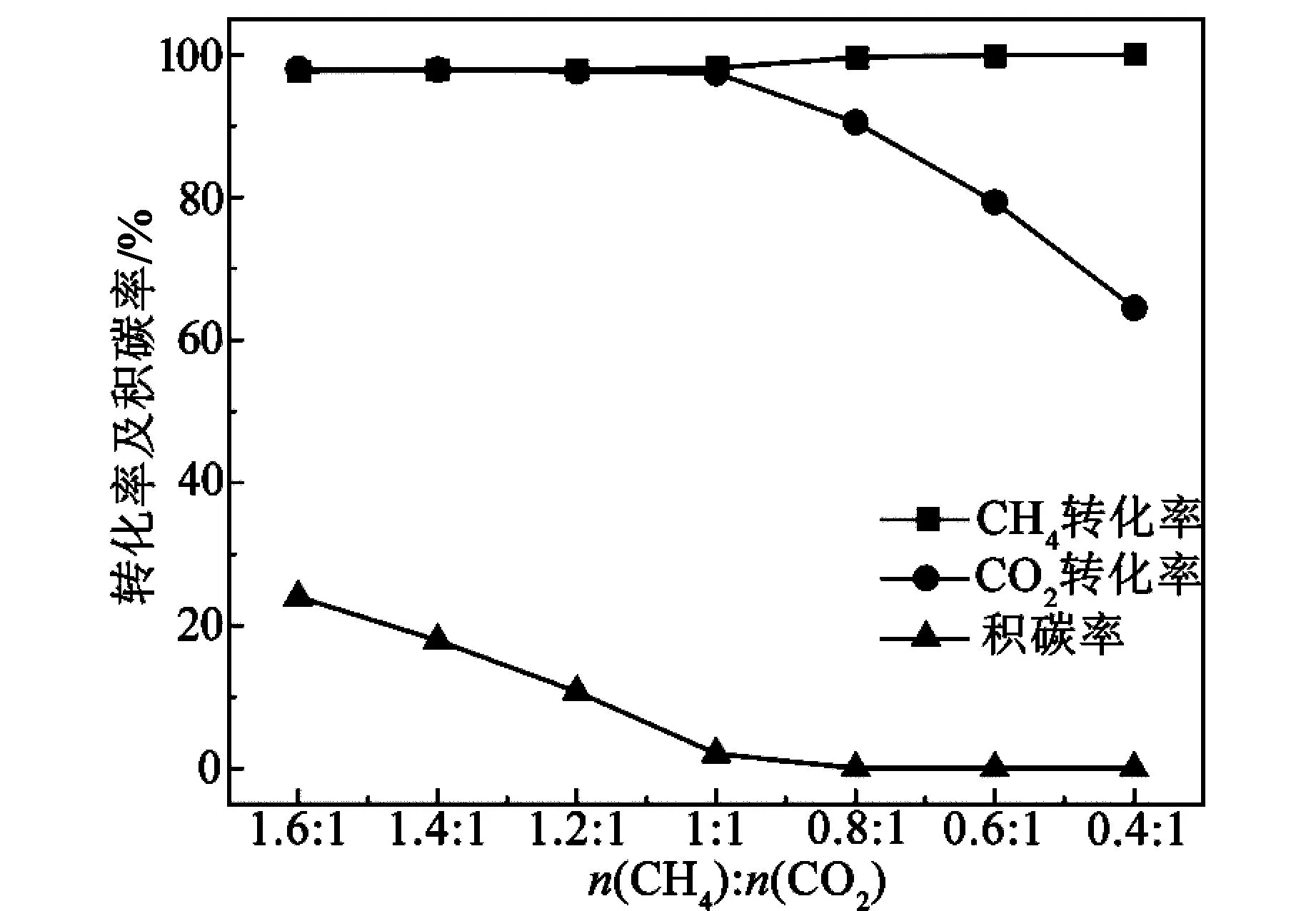
图4 进料配比对转化率及积碳率的影响
2.5 水蒸气的影响
在温度900 ℃、压力105Pa、进料配比n(CH4)∶n(CO2)=1的条件下,随着水蒸气加入量的增加,α1、α2、β1的变化规律如图5所示。当温度较低时,只要加入水蒸气,便可降低β1,并且随着水蒸气加入量增加,β1下降幅度变大;当温度较高时,水蒸气加入量较少,小于0.7 kmol时,反而会增加积碳率。这是由于低温时,反应R3、R4、R5以及R1与R2的逆反应热力学可行,水蒸气抑制了R5正向进行,使得平衡的C含量下降;高温时R1、R2、R3以及R4与R5的逆反应是热力学可行的,当水蒸气量较少时,R5的逆向进行造成积碳的减少不足以弥补R3正反应造成的积碳的增多;当水蒸气加入量较多时,R5逆反应的加强会降低平衡时的C含量。当温度大于800 ℃时,加入0.7 kmol的水蒸气便可以使得β1下降至0%。图5(b)为水蒸气的加入量对α1的影响,随着水蒸气加入量增加,α1降低,并且在低温时降低幅度很大,而高温时降低幅度不明显。这是由于低温时,水蒸气的加入抑制了R5的正向反应,进而进一步抑制了R1的正向反应。图5(c)为水蒸气的加入量对α2的影响,可以看出,加入水蒸气可以提高α2,但随着加入量的增加,α2增加的值减小,类似于α1,在低温时这种差异较大,在高温时差异减小,甚至会造成α1有所降低。综上所述,在900 ℃、105Pa、n(CH4)∶n(CO2)=1、n(CO2)=1 kmol的条件下,加入0.7 kmol的水蒸气可获得高α1、α2和低β1,此时对应高焦煤气比约为2.5,α1为99%,α2为96%,β1为0%。重整后还原性气体含量也大幅提高,具体见表3。相较于初始高炉煤气,CO含量增长13.74%~28.57%,H2含量增长7.33~9.24倍。
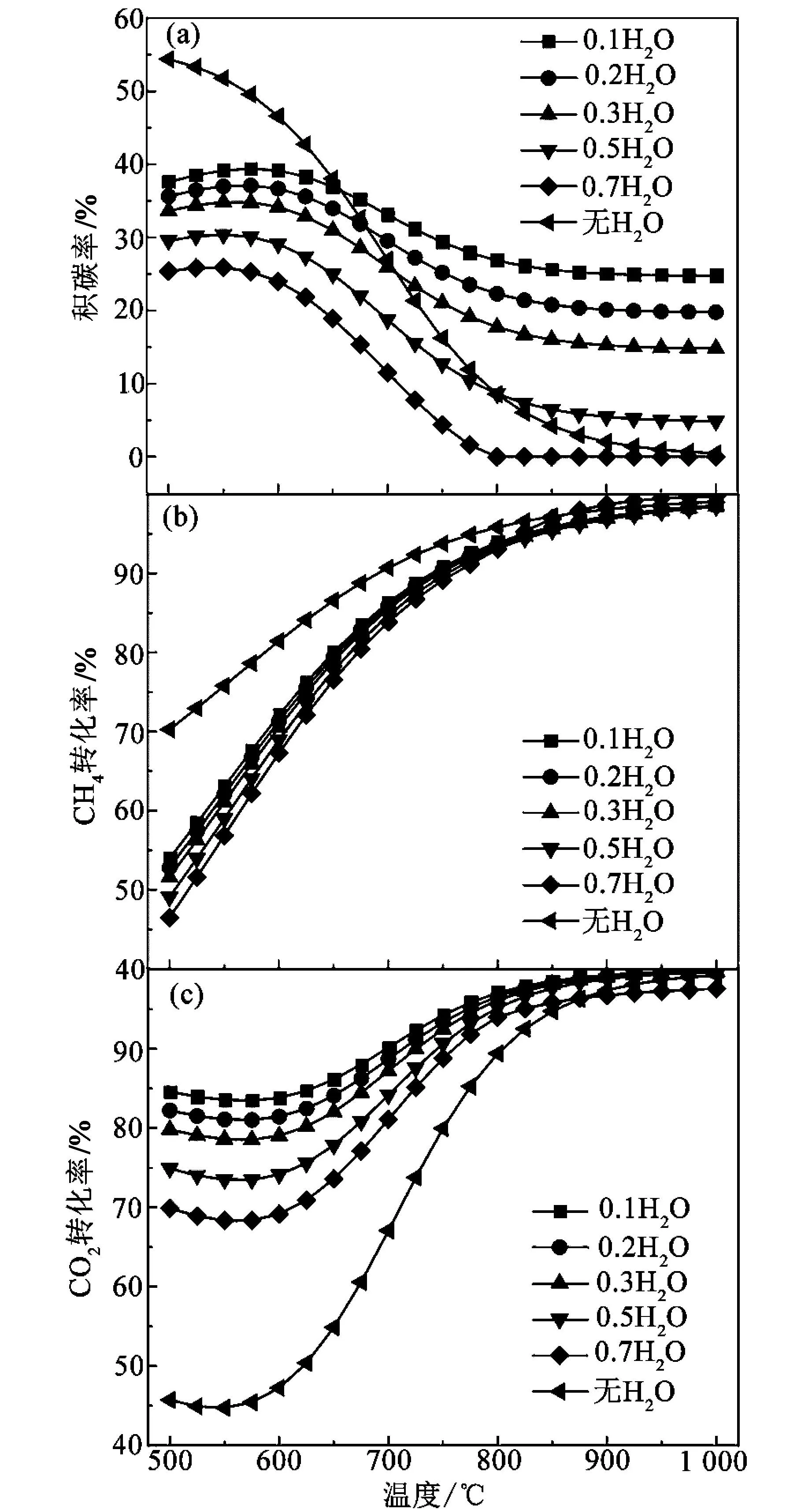
图5 水蒸气加入量对转化率及积碳率的影响

表3 还原性气体组分 %
3 结论
(1)升高温度,CH4转化率及CO2转化率增加,积碳率降低,当温度为900 ℃时,α1、α2均在97%以上,积碳率在2%以下;压力增加,CH4转化率及CO2转化率降低,积碳率增加。
(2)当n(CH4)∶n(CO2)>1时,降低初始CH4含量,α1、α2均保持在一个较高的值(97%),β1则逐渐降低;当n(CH4)∶n(CO2)<1时,降低初始CH4含量,α1增长到99%以上,而α2则迅速下降,此时β1开始下降直至0%。n(CH4)∶n(CO2)=1∶1为较佳反应条件。
(3)加入水蒸气量>0.7 kmol,可以获得高α1与α2、低β1,在900 ℃、105Pa、n(CH4)∶n(CO2)∶n(H2O(g))=1∶1∶0.7工况下,α1为99%,α2为96%,β1为0%。

