Box- Behnken响应面法结合多指标综合评分法优化俄色叶(变叶海棠)配方颗粒的提取工艺
蒋孟莲,徐俊,颜雨豪,杨转珍,杨永泓,康晋梅,陈怡璇,蔡晓洋,李敏
(成都中医药大学 药学院/现代中药产业学院/省部共建西南特色中药资源国家重点实验室,四川 成都 611137)
藏药材俄色叶为蔷薇科苹果属植物变叶海棠Malus toringoides (Rehd.)Hughes或花叶海棠Malus transitoria(Batal.)Schneid.的干燥叶及叶芽[1],具有攻坚化积、除腻涤滞、保肝利胆的功效,为甘孜藏族自治州民间的一味药食两用药材,其药用和食用历史悠久。俄色叶药材始载于《四部医典》[2],现已被《四川省藏药材标准》(2014年版)[1]收载。俄色叶中主要含有黄酮类成分,变叶海棠叶中总黄酮含量高于花叶海棠,且变叶海棠在四川省甘孜州地区的资源蕴藏量远大于花叶海棠,综合成分含量和资源蕴藏量,为保证俄色叶的可持续发展,因此本研究选择变叶海棠为研究对象。目前从俄色叶中已分离鉴别出20余种化合物,其黄酮类成分主要包括金丝桃苷、异槲皮苷、槲皮苷、根皮苷、槲皮素、根皮素、芦丁、紫云英苷[3- 5]等。其中根皮苷、根皮素、槲皮素具有降血糖、抗氧化、保肝[6- 8]、降血脂[9- 10]等作用。俄色叶中总黄酮含量约为同科属植物西府海棠叶中的2倍[11],其根皮苷含量约为湖北海棠叶中的6倍[12],为尖嘴林檎叶中的33倍[13]。因此俄色叶的主要活性成分为黄酮类成分。
随着中药配方颗粒需求日益增高,国家食品药品监督管理总局制定了《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》,对中药配方颗粒的制备工艺进行整体规定。但是各个生产企业仅根据自身的经验和企业现有的设施、辅料等进行具体品种生产,没有统一生产工艺参数,导致企业生产的同品种配方颗粒在规格、疗效上存在差异[14]。因此对中药配方颗粒制备工艺进行研究,并建立具体品种生产工艺具有重要意义,从而保障药品质量稳定和疗效。因此,本研究采用单因素结合Box- Behnken响应面法,筛选俄色叶(变叶海棠)配方颗粒的最佳提取工艺,为配方颗粒质量标准研究奠定基础。
1 实验材料与设备
1.1 实验材料
俄色叶(变叶海棠)药材采集自四川省甘孜州炉霍县,净制去除枝干杂质得到俄色叶(变叶海棠)饮片,经成都中医药大学李敏教授鉴定为蔷薇科苹果属植物变叶海棠Malustoringoide(Rehd.)Hughes.的干燥叶。
1.2 试剂
绿原酸(批号:Wkq20042702,四川省维克奇生物科技有限公司)、金丝桃苷(批号:Wkq21021904,四川省维克奇生物科技有限公司)、异槲皮苷(批号:Wkq21061105,四川省维克奇生物科技有限公司)槲皮苷(批号:Wkq21022402,四川省维克奇生物科技有限公司)、根皮素(批号:Wkq21020808,四川省维克奇生物科技有限公司)、根皮苷(批号:Wkq20070810,四川省维克奇生物科技有限公司)、槲皮素(批号:Wkq20061112,四川省维克奇生物科技有限公司,纯度均大于98%。乙腈、磷酸为色谱纯,水为超纯水。
1.3 仪器
UltiMate3000高效液相色谱仪(美国Thermo Fisher Scientific公司);BP121S旋转蒸发仪(德国Sartorius公司);MD- DG30E103全自动煎药壶(潮州市一壶百饮电器实业有限公司);BP121S十万分之一电子天平(德国Sartorius公司);KQ- 500DE数控超声波清洗器(昆山市超声仪器有限公司);SCIENTZ- 20F/A冷冻干燥机(宁波新芝)。
2 实验方法
2.1 俄色叶(变叶海棠)配方颗粒提取工艺评价指标
俄色叶(变叶海棠)配方颗粒提取工艺采用多指标综合评价法对9个质量指标进行综合评分,综合分析筛选出最佳参数,其中出膏率(X1)、总黄酮(X2)、根皮苷(X3)、根皮素(X4)、绿原酸(X5)、金丝桃苷(X6)、异槲皮苷(X7)、槲皮苷(X8)、槲皮素(X9)为指标,以各指标质量分数的最大值作为参照对数据进行标准化处理,得到综合评分公式:综合得分(Y)=(X1/X1max)×0.2+(X2/X2max)×0.2+(X3/X3max)×0.3+(X4/X4max)×0.05+(X5/X5max)×0.05+(X6/X6max)×0.05+(X7/X7max)×0.05+(X8/X8max)×0.05+(X9/X9max)×0.05。总黄酮含量参照俄色叶中药标准(SCYPBZ2021- 001)项下总黄酮的测定方法[1]。绿原酸、金丝桃苷、异槲皮苷、槲皮苷、根皮苷、槲皮素、根皮素7种成分含量参照课题组前期建立的含量测定方法[15]进行测定。
2.2 7种黄酮类成分含量测定方法
2.2.1 色谱条件
色谱条件 Insertsil ODS- 3 色谱柱(4.6 mm×250 mm,5 μm );流动相乙腈(A)- 0.1%磷酸(B),梯度洗脱(0- 5 min,12%- 15%A;5- 15 min,15%- 20% A;15- 28 min,20% A;28- 48 min,20%- 42% A;48- 50 min,42%- 50% A;50- 55 min,50%- 12% A);体积流量0.7 mL/min;柱温30℃;检测波长340 nm;进样量10 μL。
2.2.2 对照品溶液制备
取绿原酸、金丝桃苷、异槲皮苷、槲皮苷、根皮苷、槲皮素、根皮素各对照品适量,精密称定,分别置于不同25 mL量瓶中,用75%甲醇溶解并定容,制备各单一对照品母液。分别取一定量的各对照品母液,置于同一10 mL量瓶中,用75%甲醇稀释制成绿原酸、金丝桃苷、异槲皮苷、槲皮苷、根皮苷、槲皮素质量浓度分别为0.125 mg/mL、0.35 mg/mL、0.86 mg/mL、0.38 mg/mL、9.3 mg/mL、0.01 mg/mL和0.85 mg/mL的混合对照品溶液。
2.2.3 供试品溶液的制备
取俄色叶药材细粉(过四号筛)约0.5 g,精密称定,置于具塞锥形瓶中,精密加入75%甲醇25 mL,密塞,称定质量,超声(功率:500 W,频率:40 kHz)处理45 min,放冷,用75%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.4 系统适应性试验
按照“2.2.1”项下色谱条件测定混合对照品溶液、俄色叶供试品溶液和阴性样品溶液,结果表明样品中各成分分离度和理论板数均较好,且阴性无干扰,见图1。
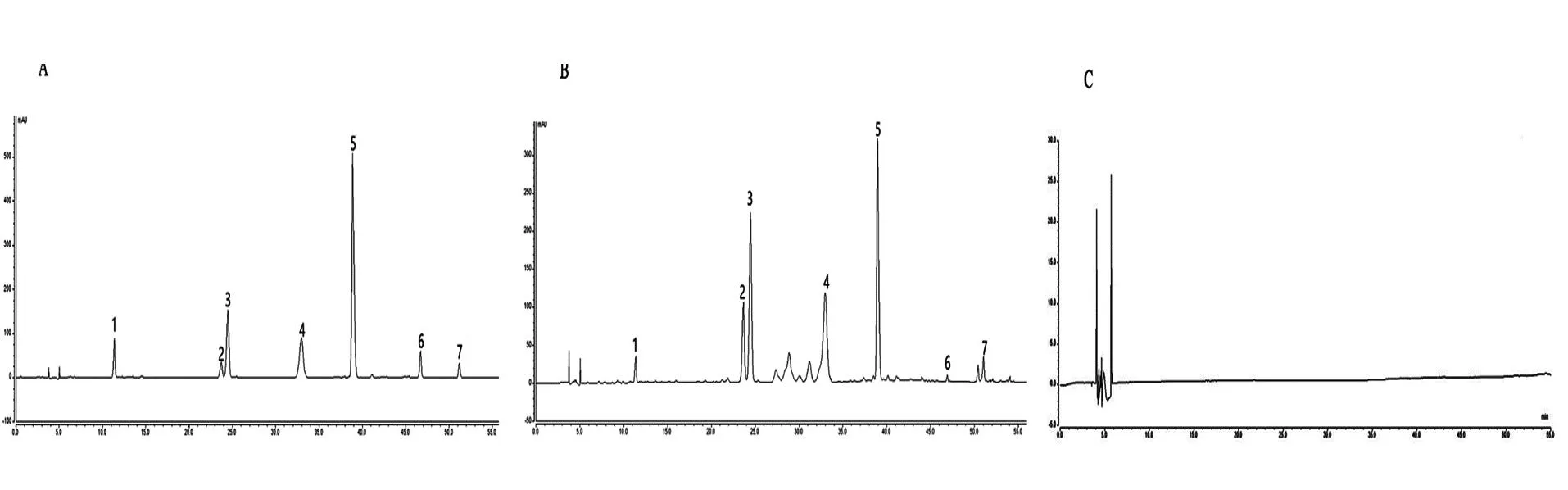
注:A- 混合对照品,B- 俄色叶样品,C- 阴性对照;1- 绿原酸,2- 金丝桃苷,3- 异槲皮苷,4- 槲皮苷,5- 根皮苷,6- 槲皮素,7- 根皮素
2.3 单因素试验
2.3.1 浸泡时间考察
参考标准汤剂的制备方法,取俄色叶饮片50 g,按料液比1:15,提取时间30 min,提取次数2次,分别考察浸泡0 min、15 min、30 min、45 min、60 min对提取效果的影响,结果见表1。由表可知,浸泡30 min后,各成分变化微弱,故确定30 min为最佳浸泡时间。
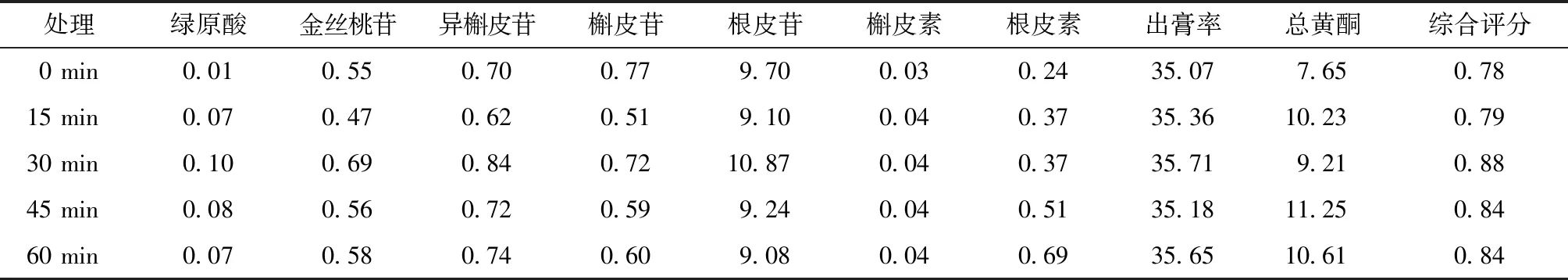
表1 不同浸泡时间考察 %
2.3.2 料液比考察
取俄色叶饮片50 g,浸泡30 min,提取时间30 min,提取次数2次,分别考察料液比1:10、1:15、1:20、1:25、1:30对提取效果的影响,结果见表2。
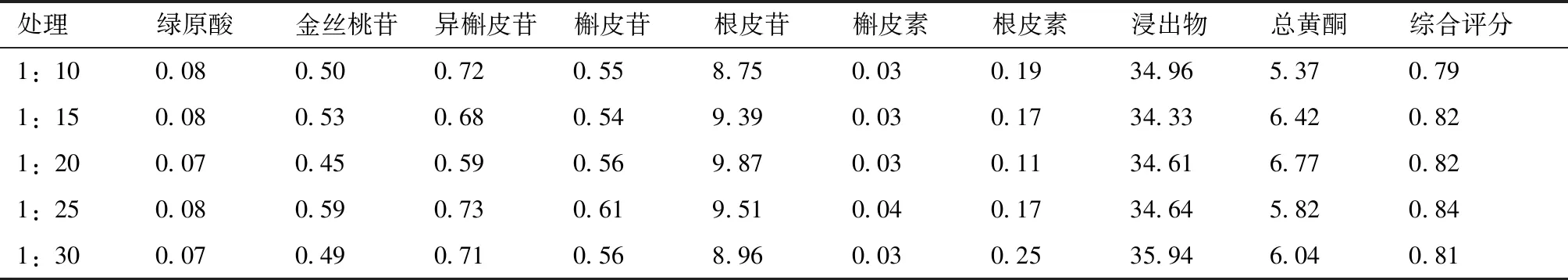
表2 不同料液比考察 %
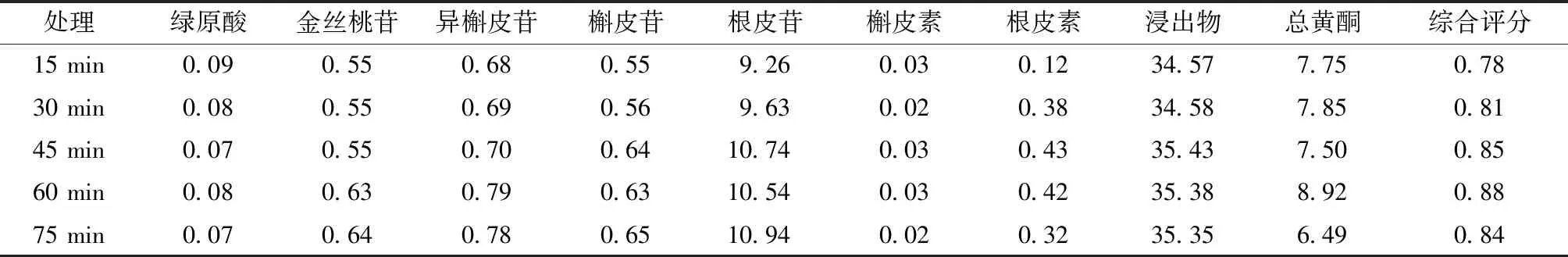
表3 不同提取时间考察 %
由表可知,随着提取时间的增加,综合评分呈现先升高后降低的趋势,在提取60 min时综合评分最高,故确定60 min为最佳提取时间。
2.3.4 提取次数考察
取俄色叶饮片50 g,按料液比1∶15,浸泡30 min,提取45 min,分别考察提取次数1次、2次、3次对提取效果的影响,结果见表4。
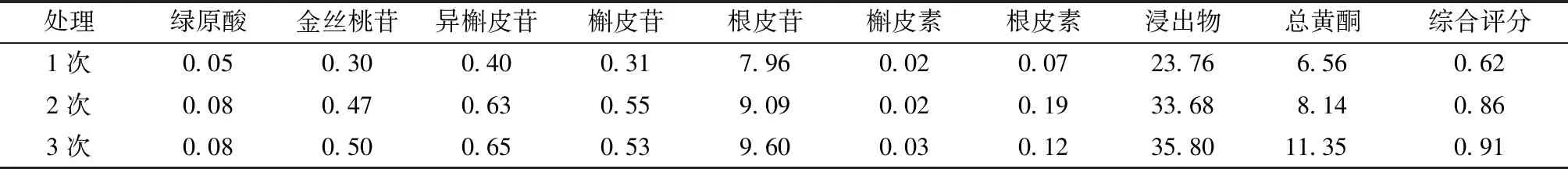
表4 不同提取时间考察 %
由表可知,随着提取次数的增加,综合评分逐渐升高,提取次数为3次时,综合评分最高,故选择3次为最佳提取次数。
综合单因素实验结果,初步确定提取工艺参数为取俄色叶饮片加水煎煮两次,第一次加15倍量水,浸泡30 min,煎煮60 min;第二次加13倍量水,煎煮60 min;第三次加13倍量水,煎煮60 min,滤过,即得。
2.4 响应曲面试验
2.4.1 Box- Behnken响应曲面试验
响应曲面试验以浸泡时间(X1)、料液比(X2)、提取时间(X3)、提取次数(X4)4个因素作为自变量,利用Design- Expert8.0.6软件按照Box- Behnken的中心组合实验设计,选择5个中心实验点,得到29个实验点,进行4因素3水平试验。以综合评分为响应值,通过响应面分析提取工艺的优化,得到最佳提取工艺,实验设计见表5,实验结果见表6。
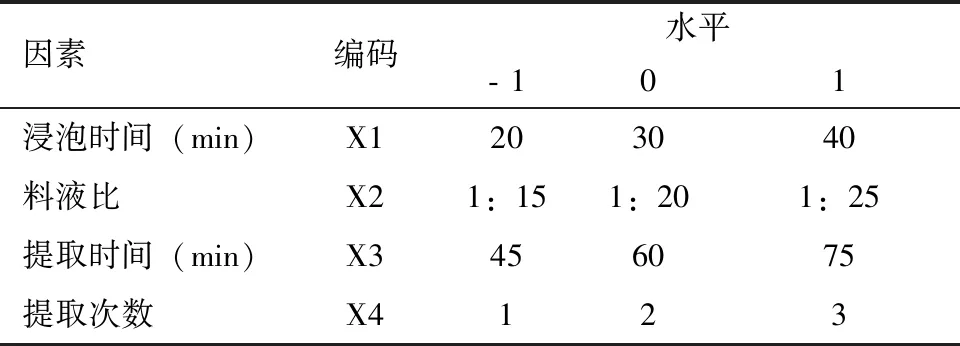
表5 因素设计表

表6 Box- Behnken实验结果
以提取工艺中综合得分为因变量,对浸泡时间、料液比、提取时间、提取次数各因素进行多元回归拟合,得到二项式拟合的复相关系数r2=0.8872,模型P<0.05,达显著水平,说明模型拟合度良好,使用此方程可以代替真实的试验点进行分析。由表7可知,回归方程失拟性检验P=0.1913>0.05,无显著性差异,说明该方程与实际情况拟合良好,模型的残差可能是随机误差产生,可用此模型来分析预测最佳提取工艺。由方差分析得到多元回归拟合方程为综合得分=0.71-0.011A+0.013B+5.912E-003C+0.089D+0.024AB+0.029AC-0.045AD+5.639×10- 3BC+5.684×10- 3BD-0.046CD-0.016A2+0.035B2+8.531×10- 3C2-0.027D2。
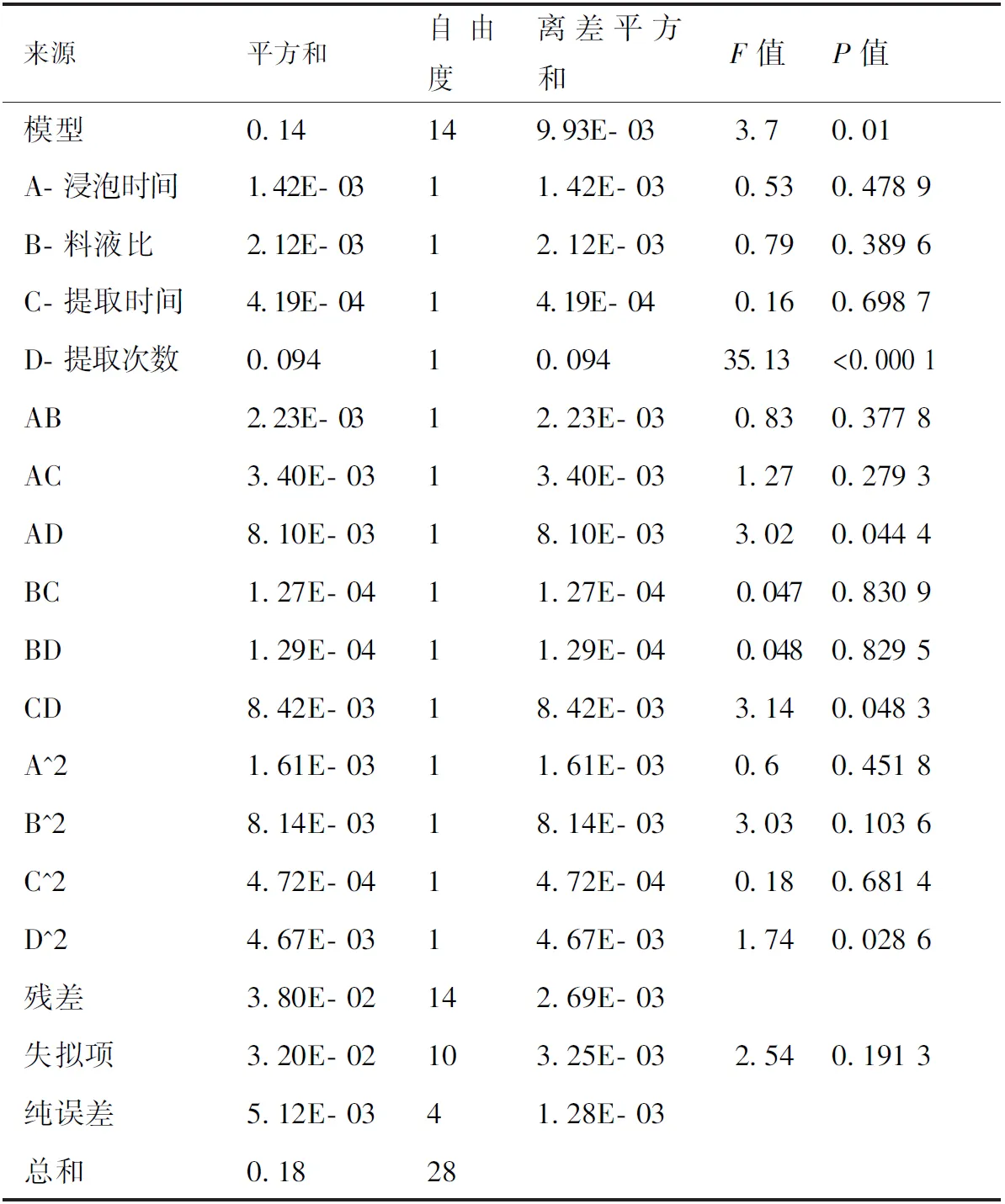
表7 响应面方差分析
从F值的大小可知,单因素对提取的影响顺序为D>B>A>C,即提取次数>料液比>浸泡时间>提取时间;且回归模型中1次项A、B、C不显著,D显著;2次项均显著;交互项AB、AC、BC、BD不显著,AD、CD显著,说明不同的提取工艺与综合得分之间不是简单的线性关系。通过DesignExpert8.0.6软件对各因素之间的交互作用进行响应面分析,绘制响应面曲线图,响应曲面陡峭程度越大,则对综合得分的影响也越大,结果见图2。
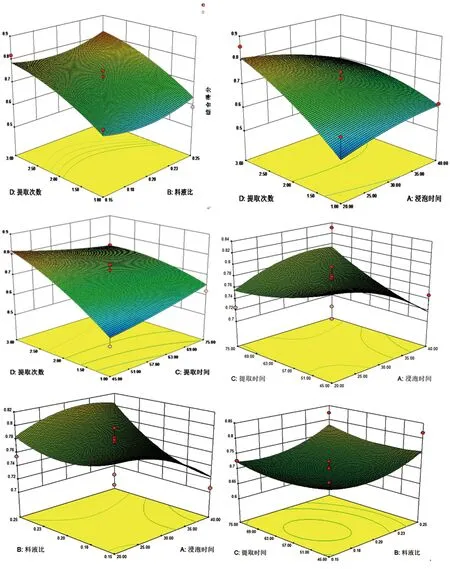
图2 基于响应曲面法不同因素对综合得分的影响
根据响应曲面结果筛选出最佳提取工艺为按料液比1:15加水,浸泡27.85 min,提取3次,每次45 min。结合实际生产能耗和其他生产成本控制因素,以及最接近标准汤剂原则,确定更合理的提取工艺,将最佳提取工艺条件修正为取俄色叶饮片加水煎煮两次,第一次加15倍量水,浸泡30 min,煎煮45 min;第二次加13倍量水,煎煮45 min,滤过,即得。
2.5 提取工艺验证试验
根据“2.3.1”优选出的最佳工艺制备3批样品,测定样品中多种成分的含量,并进行综合评分,见表8。由最佳提取工艺所得提取液的测定结果可知,实测OD值与预测值0.938的相对误差较小(3.08%),表明本实验所建立的回归模型准确可靠,优化得到的最佳加工工艺重现性好。
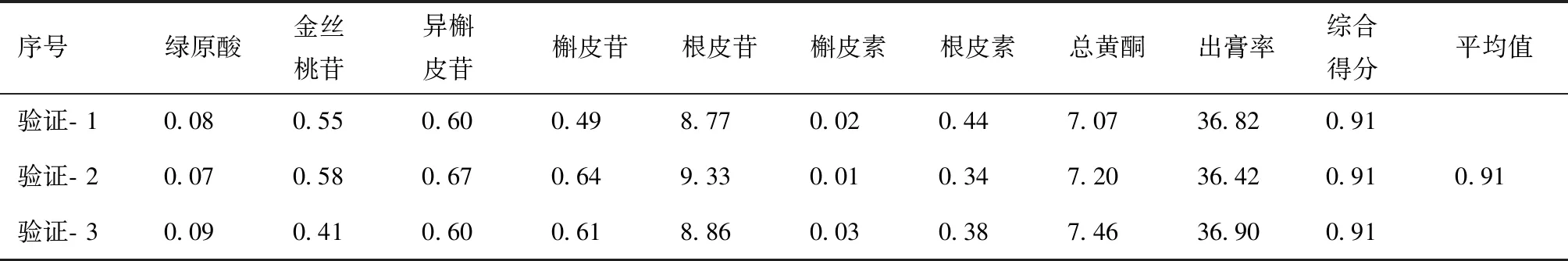
表8 验证试验结果 %
3 讨论
3.1 俄色叶(变叶海棠)标准汤剂及配方颗粒指标成分的选择
目前《四川省藏药材标准》(2014年版)中仅对俄色叶项下总黄酮和根皮素含量做出规定,但研究表明,俄色叶中已能分离鉴别出20余种化合物[16],其黄酮类成分根皮苷、根皮素、槲皮素具有多种重要生物活性,因此黄酮类成分的含量对保证俄色叶药材质量和药效十分重要。本实验选择绿原酸、金丝桃苷、异槲皮苷、槲皮苷、根皮苷、槲皮素、根皮素这7个黄酮类成分作为评价指标,能够更好地评价俄色叶(变叶海棠)配方颗粒的提取工艺。
3.2 俄色叶(变叶海棠)配方颗粒提取工艺的确定
本实验首先采用单因素实验对俄色叶配方颗粒提取工艺的浸泡时间、提取时间、料液比、提取次数四因素进行考察,初步确定为浸泡30 min,料液比1:15,提取时间60 min,提取次数3次。标准汤剂制备工艺研究表明饮片的吸湿率为200%,故在对料液比进行考察时,针对饮片吸湿对水的损耗,第二次加水量均在第一次加水的基础上减少2倍水。随后采用响应曲面法对筛选出的提取工艺进行综合实验,分析不同因素对配方颗粒提取率的综合影响,结合现代实际生产情况,对正交实验确定的条件进行修正为取俄色叶饮片加水煎煮两次,第一次加15倍量水,浸泡30 min,煎煮45 min;第二次加13倍量水,煎煮45 min,滤过,即得。
综上分析,本文采用单因素结合Box- Behnken响应曲面实验,以7种黄酮类成分含量、总黄酮、出膏率的综合评分为考察指标,优选俄色叶(变叶海棠)配方颗粒最佳提取工艺为:加水煎煮两次,第一次加15倍量水,浸泡30 min,煎煮45 min;第二次加13倍量水,煎煮45 min,滤过,合并煎液。四川省藏药资源丰富,而且在许多高原疾病上面具有显著优势,但是目前许多藏药的研究开发仍较为薄弱,需要加强对其化学成分、作用机制等方面的研究[17]。本文仅对俄色叶(变叶海棠)配方颗粒的提取工艺进行了研究,后续还需建立其配方颗粒的质量标准评价方法,以完善整个俄色叶(变叶海棠)配方颗粒的质量控制体系。

