大黄鱼C型凝集素受体Clec4e的分子鉴定及凝集特性
张鑫洛, 王永阳, 吴子良, 黄小红,,陈新华, 张伟妮,*
(1. 海水养殖生物育种全国重点实验室,福建省海洋生物技术重点实验室,福建 福州 350002;2. 福建农林大学,中西兽医结合与动物保健福建省高校重点实验室,福建 福州 350002)
大黄鱼(Larimichthys crocea)俗称黄花鱼,属鲈形目(Perciforms)石首鱼科(Sciaenidae)黄鱼属(Larimichthys),主要分布在黄海南部、东海南部及南海北部海域。据《2021年中国渔业统计年鉴》,2020年我国大黄鱼产量达25.4万t,占海水鱼类养殖总产量的14.51%,稳居养殖海水鱼类之首[1]。然而,大黄鱼也是病害极其多发的鱼类,长期遭受溶藻弧菌(Vibrio alginolyticus)[2]、变形假单胞菌(Pseudomonas plecoglossicida)[3]、刺激隐核虫(Cryptocaryon irritans)[4]和虹彩病毒(Iridovirus)[5]等病原的感染,遭受了重大的经济损失。因此,探究大黄鱼抗病原感染的分子机制,制定有效的免疫防治方案,是其产业可持续发展的重要策略。
鱼类作为低等脊椎动物,具有发达的先天性免疫和相对完善的获得性免疫。当外界病原体入侵时,先天免疫作为第一道防线发挥着重要作用[6-8]。而先天性免疫的激活依赖于模式识别受体(pattern recognition receptors,PRRs),如Toll样受体(Toll-like receptors,TLRs)、NOD样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)、RIG-I样受体(retinoic acid-inducible gene-Ilike receptors,RLRs)以及凝集素受体等,它们识别病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),如脂多糖、肽聚糖、鞭毛蛋白、核酸等,从而激活免疫系统来清除病原或维持内环境的稳态[9]。凝集素受体是一种以非共价可逆地结合碳水化合物的非酶蛋白或糖蛋白,最早在植物提取物中发现,具有血凝活性,现已证实广泛存在于各种生物体中[10]。动物凝集素受体通常被分为五大类∶C型(Ca2+依赖型)、S型(又称半乳糖凝集素)、I型、P型以及正五聚体蛋白[11]。其中,C型凝集素受体(C-type lectin receptor,CTLR)是最早发现的动物凝集素之一,也是凝集素家族中种类和数量最多的一个家族,主要通过识别和结合病原微生物表面的脂多糖、肽聚糖、甘露糖及葡聚糖等糖类结构的PAMPs激活宿主先天性免疫[6]。部分CTLR含有跨膜结构域,作为膜受体发挥作用,部分CTLR也可作为分泌蛋白发挥作用。在功能上,CTLR被证实可参与多种免疫过程,包括病原体识别[12]、细胞黏附[13]、吞噬[14]、抗原递呈细胞与T细胞的相互作用[15]、T淋巴细胞的活化与调控[16-17]等,甘露糖结合凝集素还具有激活补体的功能[13]。
目前,已经在硬骨鱼中鉴定出大量的CTLR,并证实其参与了宿主抗细菌感染的防御。如香鱼(Plecoglossus altivelis)CTLR—PaCD209L能够结合革兰氏阳性和阴性菌,用抗体阻断PaCD209L后,单核/巨噬细胞的吞噬作用和杀菌活性显著降低[18];半滑舌鳎(Cynoglossus semilaevis)的CTLR (CsCD94)与细菌孵育后降低了该菌的体外存活率[19];许氏平鲉(Sebastes schlegelii)SsLec1具有抑制细菌感染的作用[20];嗜水气单胞菌(Aeromonas hydrophila)感染后草鱼(Ctenopharyngodon idella)甘露糖受体gcMR在肝脏、脾脏、头肾和肠道中的表达均显著上调[21]。在大黄鱼中已被鉴定的CTLR有LcNTC和LcDC-SIGN,前者是一种具有广谱细菌凝集活性的分泌型CTLR,在肝脏、脾脏和头肾中的表达量经副溶血弧菌(V. parahaemolyticus)刺激后均显著升高[22];后者为膜型CTLR,具有红细胞凝集活性和对半乳糖的偏好性,对2种食源性致病菌大肠杆菌(Escherichia coli)和蜡样芽孢杆菌(Bacillus cereus)具有凝集作用[23]。在大黄鱼基因组数据库中已注释的CTLR家族成员达20多种[24],因而有必要对大黄鱼CTLR的分子特征及功能进行深入研究。
我们前期从溶藻弧菌感染的大黄鱼头肾组织转录组[25]及头肾巨噬细胞转录组中,均发现一个CTLR基因—C型凝集素结构域家族4成员E基因(C-type lectin domain family 4 member E gene,Clec4e)的表达显著上调。Clec4e又称巨噬细胞诱导的C型凝集素(the macrophage-inducible C-type lectin,Mincle),主要分布在单核/巨噬细胞表面[26-27]。哺乳类Clec4e已被证实能够识别细菌、真菌等病原[28-30],而在鱼类中鲜见报道。为此,本实验以大黄鱼Clec4e为研究对象,分析其分子特征,探究其在不同组织与免疫细胞中的表达分布、细菌感染后表达模式的变化,及其凝集活性和糖结合特异性,实验结果为进一步揭示硬骨鱼CTLR在先天免疫中的生物学功能奠定基础。
1 材料与方法
1.1 实验材料
本研究所用大黄鱼购自宁德市富发水产有限公司,体长(15±3) cm,体重(50±10) g;小鼠(Mus musculus)、新西兰白兔(Oryctolagus cuniculus)购自闽侯县吴氏实验动物贸易有限公司;无乳链球菌(Streptococcus agalactiae)、嗜水气单胞菌、变形假单胞菌、溶藻弧菌、副溶血弧菌和坎氏弧菌(V.campbellii)均为实验室保藏水产病原菌。本研究获得了福建农林大学实验动物管理和使用伦理委员会批准,实验过程中操作人员严格遵守福建农林大学实验动物伦理规范,并按照福建农林大学实验动物管理和使用伦理委员会制定的规章制度执行。
Pfu DNA 聚合酶、Trans1-T1 Phage Resistan感受态细胞、Trans BL21(DE3)化学感受态细胞、pEASY®-Basic Seamless Cloning and ASSembly Kit同源重组试剂盒均购自北京全式金生物技术股份有限公司;表达载体pET-32a购自德国默克集团;RNA提取试剂盒、反转录试剂盒购自上海普洛麦格生物产品有限公司;琼脂糖凝胶回收试剂盒、质粒小提试剂盒购自OMEGA公司;DNA Marker、Protein Marker购自宝日医生物技术(北京)有限公司;实时荧光定量PCR试剂2×SYBR Green Mix购自南京诺唯赞生物科技股份有限公司;琼脂糖亲和层析介质(Ni)购自GE公司;限制性内切酶及其缓冲液购自ThermoFisher公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术股份有限公司;异丙基-β-D-硫代半乳糖苷、重组凝血酶购自北京索莱宝科技有限公司;培养基BHI、TSB、2216E均购自青岛海博生物技术有限公司。
1.2 引物
本实验所用基因LcClec4e(登录号∶ON241310.1)和Lcβ-actin(登录号∶XP_027140724.1)的引物均由福州博尚生物技术公司合成,具体信息见表1。

表1 引物信息Tab. 1 Primers information
1.3 LcClec4e基因克隆及生物信息学分析
前期通过对溶藻弧菌感染的大黄鱼头肾组织及头肾巨噬细胞转录组分析发现Clec4e基因表达上调,因此,基于大黄鱼基因组数据库中Clec4e基因序列设计了一对特异性引物LcClec4e-F/R (表1)。以大黄鱼头肾总RNA反转录得到的第一链cDNA为模板,以LcClec4e-F/R为引物,使用Pfu DNA聚合酶进行PCR扩增,PCR体系参考Pfu DNA聚合酶说明书。PCR程序∶95 °C预变性5 min;95 °C 30 s,56 °C 30 s,72 °C 1 min,35个循环;72 °C 5 min。PCR产物回收后与Blunt simple克隆载体连接后,转化T-1感受态细胞,挑取阳性克隆进行测序。
通过BLAST (http://blast.ncbi.nlm.nih.govBlast.cgi) 进行序列同源性比对;利用ExPASy (http://web.expasy.org/compute_pi/)预测蛋白质的分子量(MW)和等电点(pI),SMART (http://smart.emblheidelberg.de/)预测蛋白质的保守结构域;利用TMHMMServerv.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜区;利用DNAMAN8.0进行氨基酸多重序列比对;利用MEGA 7.0中的最大似然法构建系统发育树。构建系统发育树所用物种氨基酸序列的GenBank登录号见表2。

表2 大黄鱼与其他鱼类Clec4e氨基酸序列Tab. 2 The amino acid sequences of L. crocea and other fish Clec4e
1.4 LcClec4e在大黄鱼组织与免疫细胞中的表达分析
取健康的大黄鱼3尾,丁香酚麻醉后,使用真空采血管(抗凝)进行尾静脉采血,剖取各组织(头肾、脾脏、鳃、肝脏、头肾、肠、胃、肌肉、皮肤、脑和心脏),大黄鱼原代头肾巨噬细胞(primary head kidney macrophages,PKM)、原代头肾淋巴细胞(primary head kidney lymphocytes,PKL)和原代头肾粒细胞(primary head kidney granulocytes,PKG)的分离参照本课题组先前的方法[31]。组织和细胞RNA提取方法均按照试剂盒Promega LS1040操作说明进行,反转录反应参照Eastep®RT Master Mix操作说明进行。以反转录产物为模板,qLcClec4e-F/R为引物,qLcβ-actin为内参进行实时荧光定量 PCR,反应体系∶9.8 μL cDNA(1∶100,体积比),0.1 μL qLcClec4e-F/qLcβactin-F,0.1 μL qLcClec4e-R/qLcβ-actin-R,10 μL 2×qPCR SYBR Green Master Mix,总体积20 μL。实时荧光定量PCR程序∶95 °C 15 min;95 °C 10 s,58 °C 20 s,72 °C 32 s,40个循环。每个样品3个重复。
将分离后的PKM、PKL和PKG分别培养在6孔细胞培养板中,每孔细胞数为2×106个,28 °C培养5 h后,使用终浓度为1×107CFU/mL的灭活溶藻弧菌刺激,分别在1、2、4、8和16 h收集细胞,实时荧光定量PCR检测LcClec4e基因表达水平的变化。
采用2−△△CT法[32]计算LcClec4e的相对表达量,并用SPSS17.0进行统计学分析。
1.5 构建LcClec4e胞外域(LcClec4e-ex)的原核表达载体
LcClec4e-ex基因克隆以LcClec4eORF的克隆载体为模板、LcClec4e-ex-F/R为引物,扩增LcClec4e-ex,PCR体系见Pfu DNA聚合酶说明书,PCR程序∶95 °C 5 min;95 °C 30 s,62 °C 30 s,72 °C 30 s,35个循环;72 °C 10 min。1.5%的琼脂糖凝胶电泳检测。
原核表达载体的线性化使用EcoR I与Hind Ⅲ限制性内切酶对质粒pET-32a进行双酶切线性化操作。酶切体系∶1 μLEcoR I,1 μLHindⅢ,5 μL 10×Fast Digest Buffer,质粒5 μg,无核酸酶水补齐50 μL。酶切反应条件∶37 °C 2 h。酶切完毕后使用胶回收试剂盒进行DNA纯化,操作步骤见OMEGA D2500-02说明书。
LcClec4e-ex连接线性化pET-32a连接反应体系∶5 μL 2×Basic Assembly Mix,4 μL线性化pET-32a,1 μLLcClec4e-ex,总体积10 μL;程序∶50 °C 15 min。将连接产物加入50 μL刚解冻的T-1感受态细胞,轻柔混匀,置于冰上30 min。42 °C热休克45 s,立即置于冰上2 min。加入250 μL LB培养基,37 °C 200 r/min培养1 h,取200 μL菌液均匀涂抹在氨苄抗性的LB固体培养基上,37 °C过夜培养。挑取单菌落使用通用引物进行菌落PCR,将阳性单克隆测序。
1.6 LcClec4e-ex的重组表达与纯化
重组LcClec4e-ex(rLcClec4e-ex)的表达将测序正确的LcClec4e-ex原核表达载体转化至Trans BL21(DE3)感受态细胞。挑取长势良好的单菌落进行菌落PCR鉴定,将阳性单菌落接种至LB/Amp+液体培养基,200 r/min 37 °C培养至OD600为0.4~0.6。加入终浓度为0.1 mmol/L IPTG诱导剂,200 r/min 16 °C过夜诱导。离心收集诱导表达的菌体,用磷酸盐缓冲溶液(PBS)重悬洗涤 2次,高压破碎,4 °C 12000×g离心10 min,将上清和沉淀分别进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测。
rLcClec4e-ex的纯化向菌体破碎后的上清中加入适量体积的琼脂糖亲和层析介质(Ni),4 °C轻摇20 min使Ni介质充分结合目的蛋白。将上清蛋白与Ni介质转移至层析柱中并使液体流尽。向Ni柱中加入杂蛋白洗涤缓冲液(Tris 20 mmol/L,NaCl 0.2 mol/L,咪唑100 mmol/L,pH 7.4),考马斯亮蓝G250检测流出液,直至考马斯亮蓝G250几乎不变蓝,则说明杂蛋白已被完全洗涤。向Ni柱中加入目的蛋白洗脱缓冲液(Tris 20 mmol/L,NaCl 0.2 mol/L,咪唑300 mmol/L,pH 7.4),用考马斯亮蓝G250检测流出液,直至考马斯亮蓝G250几乎不变蓝,则说明目的蛋白已被完全洗脱。SDS-PAGE检测目的蛋白纯度。根据说明书用BCA法测定蛋白浓度(BCA蛋白浓度测定试剂盒,上海碧云天生物技术股份有限公司)。
rLcClec4e-ex融合标签的切除将纯化的目的蛋白透析至酶切缓冲液(20 mmol/L Tris-HCl,150 mmol/L NaCl,pH 8.0)。根据蛋白浓度加入适量的重组凝血酶37 °C酶切2 h。将蛋白溶液与Ni介质轻摇孵育20 min,收集流出液。
1.7 凝集实验
参照已有文献[22]的方法。使用抗凝采血管取小鼠、新西兰白兔和大黄鱼血液,2000×g离心15 min去除上层血浆,用10倍红细胞体积的TBS(20 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.4)重悬,2000×g离心5 min,弃上清液加入适量TBS配制成2%(体积百分比)红细胞悬液。
将无乳链球菌接入BHI培养基37 °C振荡培养;嗜水气单胞菌用LB培养基,变形假单胞菌用TSB培养基,溶藻弧菌、副溶血弧菌和坎氏弧菌用2216E培养基,28 °C振荡培养。待菌液OD600达到约0.6 ,6000×g离心 5 min,收集菌体,TBS 洗涤 3次,每次5 min,重悬菌体,将浓度调整为2.0×108CFU/mL。
红细胞凝集实验在V型96孔血凝板中进行,细菌凝集实验在96孔细胞培养板进行。将rLcClec4e-ex (1.2 mg/mL)梯度稀释,每孔加入50 μL,再向每孔加入50 μL血细胞/细菌并充分混匀,室温放置40 min。对溶解在TBS-Ca (20 mmol/L Tris-HCl,150 mmol/L NaCl,10 mmol/L CaCl2,pH 7.4)中的rLcClec4e-ex蛋白进行同样的处理以检测rLcClec4e-ex的凝集活性是否为Ca2+依赖性。同时用同浓度的rTrxA标签蛋白做为阴性对照。镜检观察血细胞/细菌凝集效果,记录最小凝集浓度。实验重复3次。
1.8 糖抑制实验
为检测rLcClec4e-ex的糖类特异性结合能力,以变形假单胞菌为实验菌,选取D-葡萄糖、D-果糖、D-甘露糖、D-麦芽糖、D-半乳糖、D-海藻糖、α-乳糖、蔗糖和脂多糖等9种糖类,进行糖抑制实验。在96孔板加入25 μL梯度稀释的上述糖类,再加入25 μL rLcClec4e-ex(浓度为对变形假单胞菌的最小凝集浓度)混合物于室温孵育30 min后,加入50 μL的变形假单胞菌悬液(2.0×108CFU/mL),轻轻吹打混匀,室温孵育1 h。镜检每种糖类是否对凝集具有抑制作用,并记录最小抑制浓度。实验重复3 次。
2 结果
2.1 LcClec4e的序列分析
LcClec4e的cDNA全长为1546 bp,包含一个309 bp的5′-非翻译区(untranslated region,UTR),一个771 bp的开放阅读框(ORF),一个466 bp的3′-UTR。LcClec4eORF编码254个氨基酸残基的蛋白质,预测的分子量和理论等电点分别为24.3 ku和4.99。推断的LcClec4e蛋白包含一个跨膜区域(transmembrane region,47-69位氨基酸)和一个糖识别结构域(carbohydrate recognition domain,CRD,117~249位氨基酸)(图1)。以LcClec4e氨基酸序列在现有数据库中进行BLASTP比对,结果显示,LcClec4e与黄姑鱼等鲈形目鱼类Clec4e序列的一致性较高,约为81.89%~92.58%。多序列比对结果显示,各序列间具有较高的相似性,LcClec4e具有CTLR典型序列WIGL,6个高度保守的半胱氨酸残基,碳水化合物识别基序EPN和WFD以及2个Ca2+结合位点(图2)。系统进化分析显示,鱼类Clec4e聚成一簇,远离鸟类和哺乳类组成的分支,其中LcClec4e与黄姑鱼Clec4e的亲缘关系最近(图3)。

图1 LcClec4e 序列分析跨膜区域和糖识别结构域分别蓝色和粉红色突出显示;方框表示跨膜区;下划线表示糖识别结构域。Fig. 1 Sequence analysis of LcClec4eTransmembrane region and carbohydrate recognition domain are shown in blue and pink, respectively; transmembrane region is shown with square frame; carbohydrate recognition domain is shown with underline.
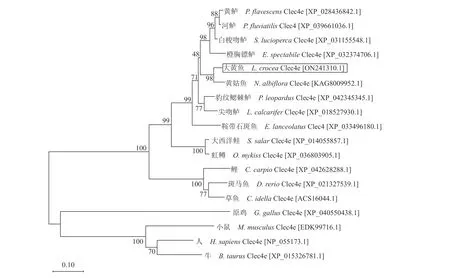
图3 最大似然法构建的Clec4e系统发育树标尺(0.1)代表遗传距离;节点处的数字是用 bootstrapping 算法进行 1000 次重复计算出的自展值(%)。Fig. 3 Maximum likelihood phylogenetic tree constructed based on Clec4e amino acid sequencesThe scale bar (0.1) represents the genetic distance; Numbers beside the internal branches indicate bootstrap values based on 1000 replications.
2.2 LcClec4e在大黄鱼不同的组织和免疫细胞中的表达特征
LcClec4e在所检测的10种组织中均有表达,其中在肝脏中表达最高、在肠中表达最少(图4-a)。同时,LcClec4e在所检测的3种原代免疫细胞中也均有表达,在原代头肾巨噬细胞(PKM)中表达最高,其次是原代头肾淋巴细胞(PKL),在原代头肾粒细胞(PKG)中表达最低(图4-b)。经灭活溶藻弧菌刺激后,LcClec4e在3种免疫细胞中的表达都显著上调,在PKG与PKM中的相对表达量在4和8 h达到最高,随后均出现下调趋势,而在PKL中则是持续表达上调(图5)。

图4 LcClec4e在大黄鱼组织(a)和免疫细胞(b)中的表达谱(a) 1. 肠,2. 脑,3. 胃,4. 脾脏,5. 鳃,6. 头肾,7. 心脏, 8. 肌肉,9. 皮肤,10. 肝脏,(n=3);(b) 1. 原代头肾粒细胞,2. 原代头肾淋巴细胞,3. 原代头肾巨噬细胞(n=3)。Fig. 4 Expression profiles of LcClec4e in tissues and immune cells(a) 1. intestine, 2. brain, 3. stomach, 4. spleen, 5. gills, 6. head kidney, 7. heart, 8. muscle, 9. skin, 10. liver (n=3); (b) 1. primary head kidney granulocytes, 2. primary head kidney lymphocytes, 3. primary head kidney macrophages (n=3).

图5 灭活溶藻弧菌刺激后免疫细胞中LcClec4e的表达水平变化(a)原代头肾粒细胞,(b)原代头肾巨噬细胞,(c)原代头肾淋巴细胞;n=3, “*”P< 0.05,“**”P < 0.01。Fig. 5 Expression changes of LcClec4e in immune cells after stimulation with inactivated V. alginolyticus(a) primary head kidney granulocytes, (b) primary head kidney macrophages, (c) primary head kidney lymphocytes; n=3, * P <0.05 and ** P <0.01.
2.3 LcClec4e-ex的原核表达
PCR扩增出胞外段LcClec4e-ex,回收目的片段,得到约400 bp的片段,与预期大小一致。重组质粒pET-32a-rLcClec4e-ex诱导表达和纯化的结果显示,融合蛋白的大小为28 ku (含分子量为11.8 ku的TrxA标签蛋白),符合蛋白预期大小(28.6 ku)(图6)。表达菌株经诱导后超声破碎,SDS-PAGE分别检测上清液与沉淀,发现rLcClec4e-ex大量存在上清液中,少量存在沉淀中。大量诱导表达取破碎的菌液上清液进行Ni柱亲和层析纯化后,将纯化的rLcClec4e-ex的融合标签切除,再次Ni柱亲和层析纯化后,SDS-PAGE检测几乎无杂带。

图6 rLcClec4e-ex的表达与纯化M. 蛋白 marker;1. 上清液中的总蛋白;2. 纯化后的蛋白;3. 酶切后的蛋白。Fig. 6 Expression and purification of rLcClec4e-ex proteinM. protein marker; 1. total protein in the supernatant; 2. the purified protein; 3. protein after enzyme digestion.
2.4 rLcClec4e-ex的凝集活性
纯化的rLcClec4e-ex在TBS-Ca中能凝集小鼠和新西兰白兔的红细胞,对大黄鱼红细胞无凝集作用(图版Ⅰ);细菌凝集实验显示,rLcClec4e-ex能凝集嗜水气单胞菌、变形假单胞菌、溶藻弧菌和坎氏弧菌,对副溶血弧菌和无乳链球菌无凝集作用(图版Ⅱ);在没有Ca2+的情况下,rLcClec4e-ex对各种红细胞和细菌均无凝集作用,可见其对红细胞和细菌的凝集作用为Ca2+依赖型。同时,在rTrxA处理的对照中没有观察到凝集现象。rLcClec4e-ex对红细胞和细菌的最小凝集浓度见表3。

表3 rLcClec4e-ex对红细胞/细菌的最小凝集浓度Tab. 3 The minimal agglutinating concentration of rLcClec4e-ex against RBCs/bacteria
2.5 rLcClec4e-ex的糖类结合特异性
糖抑实验结果显示,D-葡萄糖、D-果糖、D-甘露糖、D-麦芽糖、α-乳糖和脂多糖预处理均可抑制rLcClec4e-ex对变形假单胞菌的凝集作用;而蔗糖、D-半乳糖和D-海藻糖不能抑制rLcClec4eex对该菌的凝集活性。各种糖的最小抑制浓度见表4。

表4 糖类对rLcClec4e-ex凝集变形假单胞菌的最小抑制浓度Tab. 4 Minimal inhibition concentration of sugar on the agglutination of rLcClec4e-ex toward P. plecoglossicida
3 讨论
C型凝集素受体(CTLR)作为模式识别受体(PRR),通过识别并结合病原体表面糖类结构的病原相关分子模式(PAMPs),在先天性免疫中发挥着重要的作用。本研究从大黄鱼中克隆并鉴定了LcClec4e,并检测了其在不同的组织与免疫细胞中的表达谱和凝集特性。结果显示,LcClec4e是一个具有跨膜结构的受体,无信号肽,属于CTLR家族中Ⅱ型亚家族的成员[33]。多序列比对的结果表明,LcClec4e的氨基酸序列与许多鱼类Clec4e具有较高的同源性,都具有CTLR标志性保守基序WIGL,在其C端有一个典型的碳水化合物结合域(CRD),该CRD不仅包含4个保守的半胱氨酸残基(C1-C4),并且在该CRD序列的N端出现了2个额外的半胱氨酸残基(C0和C0’),说明LcClec4e的CRD属于“长型”(long-form)[33],它们是维持和稳定CRD的重要基础[34]。同其他鱼类的CTLR一样,LcClec4e CRD包含了结合Ca2+所必需的残基与典型的糖结合基序EPN以及WFD,表明LcClec4e具有碳水化合物亲和性[35]。值得注意的是,WND是哺乳动物CTLR结合碳水化合物的一个极其重要的基序[34],鱼类Clec4e通常表现为一个类似的基序WFD,而无脊椎动物CTLR中,WND基序又可突变为FRD[36]或WSD[37]。可见,CTLR的保守基序可能由于进化差异在不同物种间产生突变。系统进化分析显示,LcClec4e与其他鱼类Clec4e处于同一分支中,表明本研究克隆得到的LcClec4e确实为Clec4e的同源基因,且LcClec4e与同为石首鱼科的黄姑鱼Clec4e的序列一致性最高,为92.58 %。以上结果表明LcClec4e具有结构的保守性,提示其功能也具有保守性。
LcClec4e在大黄鱼所检测的10种组织中均有表达,呈组成型分布,且在肝脏中表达量最高。在已报道的鱼类CTLR中,有的在脾脏或鳃中表达量最高,如虹鳟[38]、大西洋鲑[39]、鲤[21]CTLR和大黄鱼LcNTC[22],也有的主要在肝脏中表达,如点带石斑鱼(E. coioides)[40]、牙鲆(Paralichthys olivaceus)[41]和大菱鲆(Scophthalmus maximus)[42]的CTLR。除此之外,斑马鱼CTLR4在卵巢中表达量最高[43],半滑舌鳎CsCTL1在肾脏中表达量最高[44],香鱼PaCTL在脑中表达量最高[18]。上述结果表明CTLR在不同鱼类中的表达谱存在明显差异,可能是由于鱼种差异或生存环境不同所导致的。此外,LcClec4e基因在大黄鱼原代头肾巨噬细胞(PKM)、原代头肾粒细胞(PKG)和原代淋巴细胞(PKL)均有表达,用灭活溶藻弧菌处理后,LcClec4e在3种免疫细胞中的表达量都极显著上调,提示LcClec4e参与了大黄鱼抗细菌感染的免疫应答过程。
少数CTLR的凝集作用为非Ca2+依赖型[45-47],本实验发现,大黄鱼Clec4e的胞外段(rLcClec4eex)对红细胞和细菌的凝集均为Ca2+依赖型,这与多数CTLR是相同的[48]。在本研究中,rLcClec4eex能够凝集小鼠和兔的红细胞,却无法凝集大黄鱼红细胞,这与大黄鱼膜型LcDC-SIGN的红细胞凝集特性相同[49],说明高等与低等脊椎动物红细胞表面糖类分子之间存在差异。而大黄鱼分泌型LcNTC[22]对人、兔和大黄鱼红细胞均具有凝集活性,可见CTLR的凝集活性也与蛋白本身结构和特性有关。细菌凝集实验进一步证明rLcClec4eex对嗜水气单胞菌、变形假单胞菌、溶藻弧菌和坎氏弧菌均具有凝集作用,而对副溶血弧菌和无乳链球菌没有凝集效果,表明其可能主要在抵御革兰氏阴性菌入侵的免疫防御中发挥作用。CTLR对红细胞和细菌的凝集基于其与细胞表面特定碳水化合物的结合。本研究中糖抑制实验结果显示,rLcClec4e-ex对多种糖类均具有广泛的结合力,包括D-葡萄糖、D-果糖、D-甘露糖、D-麦芽糖、α-乳糖和脂多糖,表明LcClec4e可能是这些糖类物质的受体。尖吻鲈Clec4e已被认为是脂多糖的受体之一,脂多糖通过与其结合,诱导TNF-α和IL-6的表达[50]。与纳氏海蟾鱼(Thalassophryne nattereri)的Nattectin[45]不同的是,虽然LcClec4e也具有典型的糖特异性结合基序EPN,但rLcClec4eex不能结合D-半乳糖,这可能与其缺乏半乳糖特异性结合基序QPD有关。
4 结论
本研究从大黄鱼中鉴定了一种新的C型凝集素受体Clec4e,其组成型表达在检测的大黄鱼各组织和免疫细胞中,灭活溶藻弧菌可极显著上调LcClec4e在免疫细胞中的表达水平;重组LcClec4e对红细胞和革兰氏阴性水产病原菌均表现出凝集活性,且为Ca2+依赖型。此外,还证实重组LcClec4e对细菌的凝集基于其与各种碳水化合物的结合。本实验结果提示,LcClec4e可能作为一种PRR通过与菌体表面的糖类PAMPs结合来识别病原菌,并参与大黄鱼抗细菌感染的免疫应答。
(作者声明本文无实际或潜在的利益冲突)

