瓜蒌皮注射液治疗高同型半胱氨酸颈动脉粥样硬化的效果及机制研究
甄庆强,朱冬霞,刘永昌,孙 岩
颈动脉粥样硬化(carotid atherosclerosis, CAS)是指颈动脉内膜下脂质沉积导致动脉管壁增厚、管腔狭窄、血管弹性减退的血管疾病[1]。CAS 是导致缺血性脑卒中的病因之一,也是影响患者卒中后认知功能的因素[2]。来自中国台湾省的10 年随访研究表明,CAS 病变程度可以预测患者的认知能力[3]。降脂、稳定斑块、血管紧张素受体拮抗剂等药物是目前治疗CAS 的一线药物[4-5],但治疗效果和药物依从性不尽如人意。本课题组前期研究发现,中药瓜蒌皮提取物可降低同型半胱氨酸(homocysteine, Hcy)诱导的动脉粥样硬化模型大鼠的血清Hcy 水平,抑制动脉平滑肌细胞增殖速度[6],但瓜蒌皮提取物对高Hcy 颈动脉粥样硬化的治疗效果尚不明确。本研究拟通过观察他汀类药物联合瓜蒌皮注射液治疗高Hcy 颈动脉粥样硬化的效果,利用网络药理学和生物信息学思路挖掘瓜蒌皮注射液治疗CAS 的潜在机制,并设计动物实验加以验证,为CAS 的治疗提供新思路。
1 资料与方法
1.1 临床研究
1.1.1 研究对象 选取2019 年1 月—2021 年1 月于济南市人民医院住院治疗的高Hcy 颈动脉粥样硬化患者120 例。纳入标准:1)符合颈动脉粥样硬化诊断标准,颈动脉狭窄率≤50%[7-8];2)Hcy 水平>10 μmol/L[9];3)能配合本研究并完成随访者。排除标准:1)服用叶酸、维生素B6 及维生素B12 等降低血清Hcy 水平的药物;2)颈动脉粥样硬化伴重度狭窄需要手术干预或近3 个月内接受颈动脉手术者;3)严重肝肾功能不全者;4)合并急性心脑血管意外或恶性肿瘤者。本研究已获医院伦理委员会批准(批准号:济医伦批SWYX:No.2019-002)。采用随机数字表法将本组患者分为观察组和对照组,每组60例。两组患者年龄、性别、体质量指数(BMI)、病程、合并糖尿病、合并冠心病、合并高血压人数、使用他汀类药物类别及他汀药物剂量比较差异无统计学意义(P>0.05,表1)。
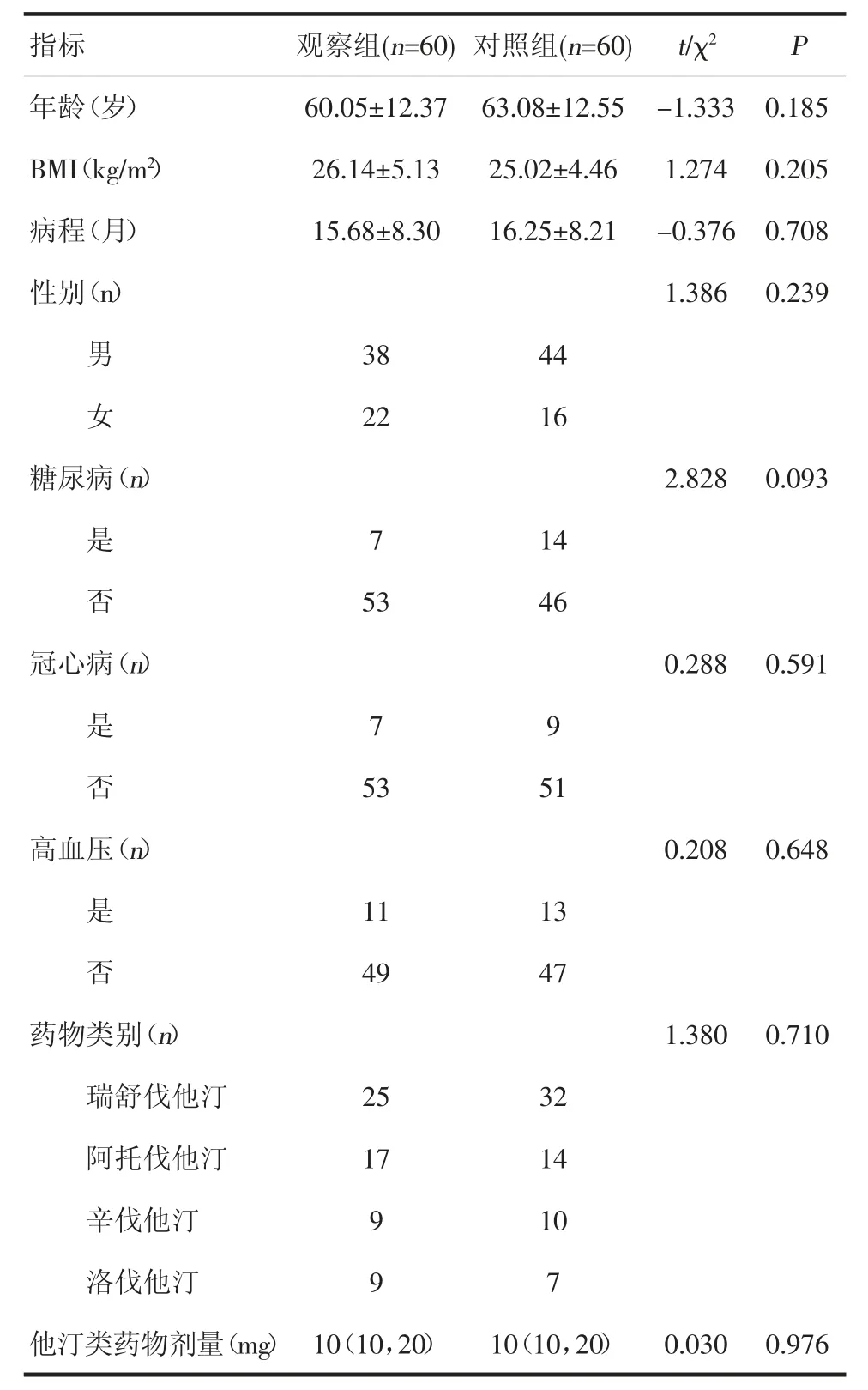
表1 两组患者基线资料比较
1.1.2 治疗方案 对照组患者给予基础治疗:应用他汀类药物稳定斑块;应用抗血小板聚集药物抑制血小板聚集。观察组在基础治疗基础上,给予瓜蒌皮注射液(国药准字Z20027540)治疗,8 mL 加入5%葡萄糖注射液250 mL 中静脉滴注,1 次/d,治疗周期为3 周。
1.1.3 观察指标 1)检测两组患者治疗前后总胆固醇(total cholesterol, TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、Hcy 水平;2)采用双侧颈动脉各测量3 次取平均值的方法,使用彩色多普勒超声仪测量颈总动脉颈动脉内膜中层厚度(intima mesosphere thickness, IMT)。
1.2 实验研究
1.2.1 瓜蒌皮干预CAS 的靶点筛选 利用中药系统药理学数据库和分析平台检索瓜蒌皮的有效成分,参照既往文献,将符合药物口服生物利用度和药物相似度类药比的成分纳入研究[10]。登录高通量基因表达数据库(gene expression omnibus, GEO),下载包含CAS 基因数据的数据集GSE100927,利用R 软件limma 数据包[11]对数据进行分析,获得差异表达基因。将瓜蒌皮作用靶点与CAS 差异表达基因取交集,获取瓜蒌皮干预CAS 的靶点。
1.2.2 瓜蒌皮干预CAS“药物-靶点-疾病”网络构建和关键靶点筛选 使用Cytoscape 3.9.2 软件绘制瓜蒌皮干预CAS 的“药物-靶点-疾病”的网络。使用STRING 平台[12]和Cytoscape 3.9.2 软件绘制瓜蒌皮干预CAS 靶点的蛋白-蛋白相互作用(proteinprotein interaction, PPI)网络,以cytoHubba 插件[13]中节点度值(degree)为标准,筛选瓜蒌皮干预CAS 的关键靶点,进行信号通路富集分析。
1.3 动物实验
1.3.1 实验动物 30 只6 周龄无特殊病原体(specific pathogen free, SPF)级SD 雄性大鼠,体质量200~220 g,购自济南朋悦实验动物繁育有限公司[合格证号:370726231100053607,生产许可证号:SCXK(鲁)20220006]。实验大鼠饲养于SPF 级动物房(室温23~25 ℃、相对湿度7%),自由饮水、摄食。
1.3.2 实验试剂 兔多克隆抗体核因子(NF)-κB p65、兔多克隆抗体肿瘤坏死因子(TNF)-α、兔多克隆抗体基质金属蛋白酶9(MMP-9)、兔多克隆抗体血管细胞黏附因子-1(VCAM-1)购自北京博奥森生物技术有限公司(批号:AI00133231、AI10202348、AH27187919、AB12157553);SABC 免疫组化试剂盒(武汉博士德生物工程有限公司,批号:SA1142);蛋白浓度测定试剂盒(美国AMERSHAM 公司,批号:RPN2232);水合氯醛(上海源叶生物科技有限公司,批号:R21454)。
1.3.3 实验动物分组及造模方法 将30 只实验大鼠随机分为空白组、模型组和治疗组,每组10 只,分笼饲养。参照代渊等[14]、靳宏光等[15]造模方法复制高同型半胱氨酸血症动脉粥样硬化大鼠模型:1.5%蛋氨酸水溶液按照10 mL/kg 体重灌胃,2 次/d;同时给予高糖高脂饲料(南京协同生物)喂养2 周后,按照3 mL/kg 体重腹腔注射10%水合氯醛麻醉,游离并显露腹主动脉,于主髂动脉分叉处穿刺,置入球囊,上行至肾动脉水平以上,调节压力泵压力至6~8个标准大气压,缓慢抽动球囊3 次,撤出球囊,用7-0无损伤尼龙线缝合穿刺点,检查无出血后,逐层缝合关闭腹腔。术后即刻给予青霉素10 万单位皮下注射、术后3 d 内每天给予青霉素10 万单位预防感染。6 周后,模型组和治疗组各随机选1 只大鼠,自尾静脉取血,检测Hcy 水平,水合氯醛麻醉后取腹主动脉,石蜡包埋、切片、镜下观察。Hcy >15 μmol/L,主动脉内膜欠光滑,平滑肌排列紊乱、增生,视为造模成功(图1)。根据人与动物的每公斤体重剂量折算系数,计算得到大鼠瓜蒌皮注射液给药剂量为0.83 mL/kg,生理盐水给药剂量为10 mL/kg。以上述给药剂量为标准,对照组和模型组大鼠每天自尾静脉注射相应剂量的生理盐水,治疗组大鼠每天自尾静脉注射相应剂量的瓜蒌皮注射液,1 次/d,连续给药7 d。
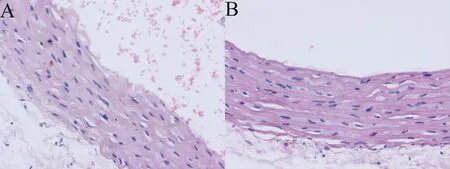
图1 大鼠主动脉HE 染色结果(×400)
1.3.4 指标检测 1)取材:给药7 d 后,麻醉3 组大鼠,将腹主动脉取出并均分为两份,分别保存于4%多聚甲醛和液氮中;颈椎脱臼处死大鼠。2)免疫组化法检测大鼠腹主动脉NF-κB p65、TNF-α、MMP-9 和VCAM-1 蛋白水平:采用Image J 软件进行平均积分光密度(optical density, OD)值分析。3)蛋白免疫印迹(Western Blot)法测定大鼠腹主动脉中NF-κB p65、TNF-α、MMP-9、VCAM-1 蛋白水平,使用Image J 进行灰度值分析。
1.4 统计分析 采用SPSS 26.0 软件对数据进行统计学分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t 检验,前后比较采用配对t 检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较及前后比较采用非参数检验;计数资料以例表示,组间比较采用χ2检验;P<0.05 表示差异有统计学意义。
2 结果
2.1 临床研究
2.1.1 两组患者血脂水平比较 治疗前,两组患者TC、TG、LDL-C 和Hcy 水平差异无统计学意义(P>0.05)。治疗后,对照组患者TC 水平较治疗前差异无统计学意义(P>0.05);TG、LDL-C 和Hcy 水平较治疗前下降,差异有统计学意义(P<0.05);观察组患者TC、TG、LDL-C 和Hcy 水平较治疗前下降,且低于对照组,差异有统计学意义(P<0.05,表2)。
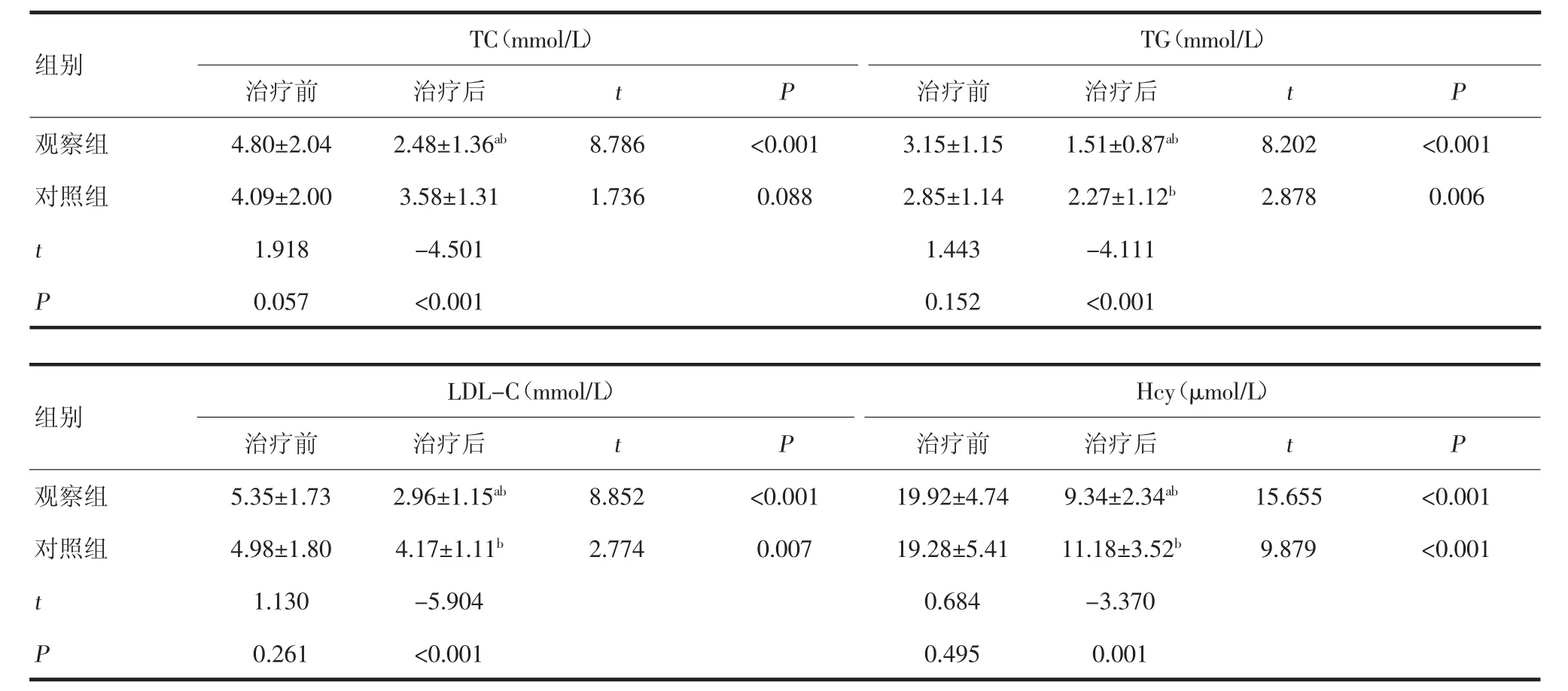
表2 两组患者血脂水平比较
2.1.2 两组患者IMT 比较 治疗前,两组患者IMT差异无统计学意义(P>0.05)。治疗后,观察组和对照组患者IMT 较治疗前均下降,且观察组患者IMT 水平低于对照组,差异有统计学意义(P<0.05,表3)。

表3 两组患者IMT 比较(mm)
2.2 实验研究
2.2.1 瓜蒌皮干预CAS 的靶点筛选 获得瓜蒌皮有效成分11 个,靶点422 个。获得CAS 相关差异表达上调基因1248 个,差异表达下调基因887 个,绘制火山图和热图进行可视化。将瓜蒌皮作用靶点与CAS 差异表达基因取交集,获取瓜蒌皮干预CAS 的靶点61 个,其中差异表达上调基因38 个,差异表达下调基因23 个(表4,图2)。
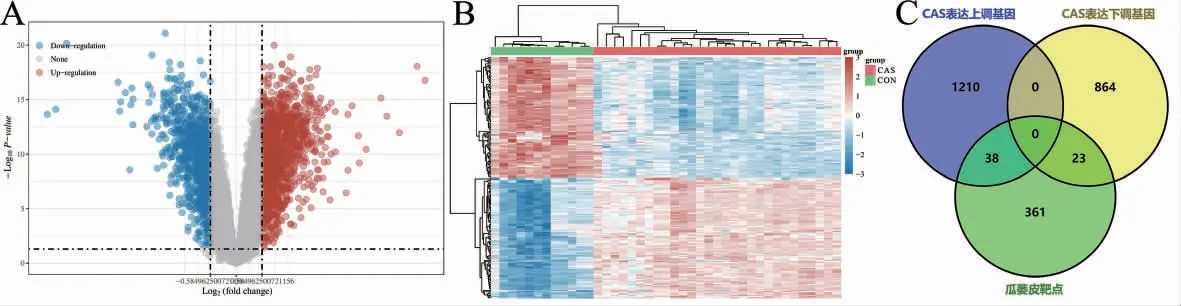
图2 瓜蒌皮干预CAS 的靶点筛选

表4 瓜蒌皮干预CAS 的靶点
2.2.2 瓜蒌皮干预CAS“药物-靶点-疾病”网络构建和关键靶点筛选 使用Cytoscape 3.9.2 软件构建瓜蒌皮干预CAS“药物-靶点-疾病”网络和PPI 网络进行可视化,以节点度值为条件筛选瓜蒌皮干预CAS 的关键靶点。富集分析结果表明,瓜蒌皮干预CAS 的关键靶点显著富集在TNF 信号通路、NF-κB信号通路等通路上(图3)。
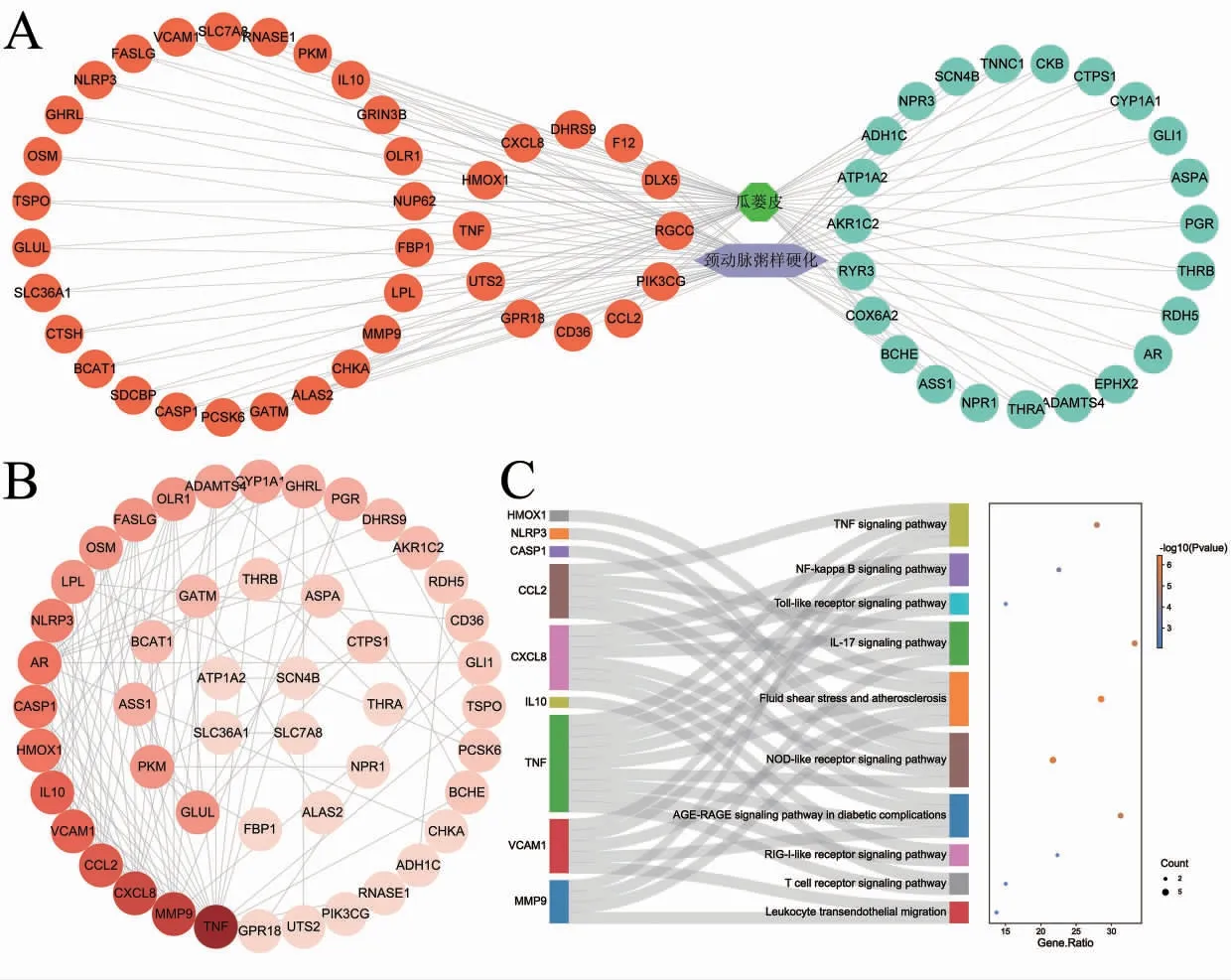
图3 瓜蒌皮干预CAS"药物- 靶点- 疾病"网络构建和关键靶点筛选
2.3 大鼠腹主动脉TNF-α、NF-κB p65、VCAM-1、MMP-9 表达量测定
2.3.1 免疫组化结果 模型组和治疗组大鼠腹主动脉TNF-α、MMP-9 表达均高于空白组,差异有统计学意义(P<0.05);治疗组和空白组NF-κB p65、VCAM-1 表达差异无统计学意义(P>0.05);与模型组相比,治疗组TNF-α、NF-κB、VCAM-1、MMP-9 表达下降,差异有统计学意义(P<0.05,图4)。

图4 瓜蒌皮注射液对大鼠腹主动脉各指标蛋白表达的影响
2.3.2 Western Blot 法检测结果 模型组和治疗组腹主动脉TNF-α、MMP-9 蛋白表达量均高于空白组,差异有统计学意义(P<0.05);治疗组和空白组NF-κB p65、VCAM-1 表达差异无统计学意义(P>0.05);与模型组相比,治疗组TNF-α、NF-κB、VCAM-1、MMP-9 表达量下降,差异具有统计学意义(P<0.05,图5)。

图5 瓜蒌皮注射液对大鼠腹主动脉各指标蛋白表达的影响(Western Blot 法)
3 讨论
瓜蒌皮是葫芦科植物栝楼(双边栝楼)的果皮,其功效主要包括清化热痰、宽胸散结等[16]。现代药理学研究发现,瓜蒌皮富含木犀草素等黄酮类化合物、苏氨酸等氨基酸、β-谷甾醇等甾醇以及大量挥发油[17],其提取液可通过抗动脉粥样硬化、保护血管内皮细胞等途径治疗心血管疾病[18]。刘思妤等[19]研究发现,瓜蒌皮乙醇提取物能显著减少人脐静脉内皮细胞中细胞内活性氧、TNF-α 和白细胞介素-6等促炎症细胞因子表达水平,发挥抗炎、抗氧化作用。杨震等[20]研究证实,瓜蒌皮可降低高血脂合并急性心肌缺血模型大鼠超氧化物歧化酶、脂质过氧化物、过氧化氢酶、总抗氧化能力和氧化型低密度脂蛋白水平,改善氧化应激状态,保护心血管。
既往研究证实,高胆固醇血症、高LDL-C 水平、高Hcy 水平与颈动脉粥样硬化密切相关[21-23]。颈动脉内中膜厚度是CAS 严重程度的重要指标,Hcy水平与颈动脉内中膜厚度及斑块形态和面积线性相关[23-25]。本研究结果表明,他汀类药物可降低合并高Hcy 的CAS 患者TG、LDL-C、Hcy 水平。联合应用瓜蒌皮提取物,可显著降低CAS 伴高Hcy 血症患者TC、TG、LDL-C 和Hcy 水平,治疗效果优于单用他汀类药物。表明瓜蒌皮提取物可通过调节血脂和Hcy 水平等途径改善CAS。同时,他汀类药物联合应用瓜蒌皮提取物可减小颈动脉内中膜厚度,延缓CAS 进展。
本研究通过生物信息学和网络药理学研究思路挖掘了瓜蒌皮干预CAS 的潜在机制,并设计实验加以验证。结果提示,瓜蒌皮干预CAS 的关键靶点显著富集在TNF/NF-κB 信号通路上。炎性反应贯穿动脉粥样硬化的发病过程。单核细胞等炎性相关细胞通过TNF-α、白细胞介素-6 等因子参与活性氧簇介导的细胞损伤,并向巨噬细胞转化[26];斑块内的巨噬细胞吞噬脂质,当脂质累积过多超过巨噬细胞的处理能力时,巨噬细胞泡沫化,形成泡沫细胞[27];斑块内活化的炎症细胞分泌基质金属蛋白酶,降解细胞外基质和斑块的纤维帽,降低斑块的稳定性,增加其破裂的几率[28-29]。TNF/NF-κB 信号通路是经典的炎症反应通路。动物实验验证,动脉粥样硬化模型大鼠腹主动脉组织TNF-α、NF-κB p65、VCAM-1、MMP-9 表达显著上调,瓜蒌皮注射液可抑制上述指标的表达,提示其可以通过抑制TNF/NF-κB 信号通路的激活发挥抗动脉粥样硬化的作用。

