痴呆健脑方调控NEK7/NLRP3炎症小体通路防治血管性痴呆
李伟峰,秦合伟,姬令山,董新刚
(1.河南中医药大学,河南 郑州 450002;2.河南中医药大学第二附属医院,河南 郑州 450002;3.河南中医药大学第一附属医院,河南 郑州 450008)
血管性痴呆(vascular dementia,VD)是由一系列脑血管疾病所引发的认知障碍综合征,是第二大痴呆类型[1-2],多呈波动性临床症状和阶梯式病情进展,目前尚无公认有效的治疗方法[3]。本病发病机制尚不十分明确,但关于炎症因子参与疾病进程、炎症反应诱发病理改变是VD主要发病机制之一的认识已被学者广泛认可[4]。基于全国名老中医药专家经验,本课题组前期已开展了益肾祛痰活血法治疗VD的评价研究[5]和小样本临床验证[6]。本研究主要从炎症反应、细胞凋亡角度出发,观察痴呆健脑方对VD模型大鼠凋亡相关蛋白及炎症因子表达的影响,以明晰痴呆健脑方的作用机制。
1 材料
1.1 动物 SD雄性大鼠200只,体质量(250±20)g,购自郑州市惠济区华兴实验动物养殖场[动物生产许可证号:SCXK(豫)2020-0010]。所有动物饲养于河南省中医院动物实验中心[动物使用许可证号:SYXK(豫)2016-0009],于(22±1)℃恒温、60%~75%恒湿、12 h循环照明的环境下饲养,自由摄食、饮水。本实验设计方案经河南省中医院动物实验伦理委员会审核通过,伦理审核编号:20190712。
1.2 药物 痴呆健脑方组成:熟地黄20 g,党参、白术各15 g,山茱萸、远志、茯苓、桃仁、川芎、石菖蒲、生姜各10 g,肉桂8 g。方中所有中药饮片均来源于河南省中医院药剂科。盐酸多奈哌齐片(国药准字 H20070181)由卫材(中国)药业有限公司生产。
1.3 试剂 荧光定量PCR试剂盒(批号 A8203-6):TaKaRa公司;蛋白提取试剂盒(批号 P0027):碧云天公司;NIMA相关激酶7(NIMA-related kinase 7,NEK7)抗体(批号 ab8178)、Nod样受体家族含pyrin结构域蛋白3 (Nod-like receptor family, pyrin domain-containing protein 3,NLRP3)抗体(批号 ab8066)、含CARD结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)抗体(批号 ab8011)、半胱氨酸天冬氨酸特异蛋白酶 (cysteinyl aspartate specific proteinase-1, Caspase-1)抗体(批号 ab8191)、消皮素D (gasdermin D,GSDMD)抗体(批号 ab8011)、白细胞介素(interleukin, IL)-1β ELISA试剂盒(批号 ab4605)、IL-6 ELISA试剂盒(批号 ab178013)、IL-18 ELISA试剂盒(批号 ab215539)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号 ab181421):英国Abcam公司;2.5%戊二醛溶液(批号 H44021172):广东恒健制药有限公司。
2 方法
2.1 动物模型复制 采用改良双侧颈总动脉分次结扎法[7]复制大鼠VD模型。大鼠术前禁食禁水12 h,称质量,在保持18~29 ℃的室温条件下,通过腹腔注射4%戊巴比妥钠(50 mg/kg)麻醉,麻醉后将大鼠仰卧固定于手术台上,对术区进行无菌操作后,将大鼠固定,暴露颈部,取颈正中切口切开1.5~2 cm,暴露右侧颈总动脉和迷走神经,分离迷走神经和颈总动脉,以1号手术线将右侧颈总动脉永久性结扎致脑缺血,缝合伤口,3 d后拆除颈部手术线。以相同的方法结扎大鼠左侧颈总动脉并缝合。术后,每只大鼠腹腔注射2 U庆大霉素,每日1次,连续5 d。假手术组大鼠进行做麻醉和颈总动脉分离,不结扎。术后将大鼠置于干净鼠笼中,保温,适应性喂养1周后,进行Morris水迷宫训练5 d,筛选VD大鼠。模型复制7 d后,采用Morris水迷宫试验筛选VD大鼠,以首次跨越平台时间(逃避潜伏期)明显延长、跨越平台次数明显少于正常大鼠作为模型复制成功的标准。
2.2 分组及干预 选取模型复制成功的100只大鼠,按照随机数字表法分为5组,各组大鼠分别给予相应干预方法,每日1次,连续干预1个月。①假手术组:手术后不结扎颈总动脉,不进行药物干预;②模型组:给予生理盐水灌胃;③多奈哌齐组:给予盐酸多奈哌齐每日3 mg/kg(相当于60 kg成人临床用量的6.3倍)灌胃;④痴呆健脑方高剂量组:给予痴呆健脑方每日32 g/kg(相当于60 kg成人临床用量的23.3倍)灌胃;⑤痴呆健脑方中剂量组:给予痴呆健脑方每日16 g/kg灌胃。
2.3 观察指标
2.3.1 空间学习记忆能力检测 干预1个月后采用Morris水迷宫检测大鼠空间学习记忆能力,主要内容包括定位航行试验及空间探索试验。
2.3.2 大鼠海马神经元形态学观察 将大鼠脑组织置于10%中性甲醛中,在4 ℃下静置24 h。用乙醇梯度洗脱,二甲苯透明,石蜡包埋,切取4 μm冠状切片,制作石蜡切片。采用苏木精—伊红(hematoxylin-eosin staining,HE)染色,光学显微镜下观察大鼠海马区神经元形态。
2.3.3 TUNEL法检测大鼠海马神经元凋亡指数 大鼠禁食12 h,称质量,麻醉后断头处死,冰上迅速开颅取出全脑,分离海马,多聚甲醛浸泡固定24 h,先后依次进行组织脱水、组织透明、浸蜡、包埋、切片、捞片、烤片、脱蜡、漂洗、孵育、洗涤、复染核,用含有抗荧光淬灭剂的封片液封片,荧光显微镜下观察大鼠海马神经元凋亡情况。
2.3.4 透射电子显微镜观察大鼠海马神经元形态 采用醋酸双氧铀/枸橼酸铅双染色法染色后,在JEM-1011透射电子显微镜下进行观察,使用Soft Imaging Solutions Gmb H病理影像系统采集图像,图像放大倍数为20 000倍,每只大鼠随机拍摄5张图像。观察大鼠海马神经元形态。
2.3.5 Real-time PCR法检测大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD mRNA表达水平 取大鼠海马组织标本100 mg,提取总RNA,测定总RNA的浓度和纯度,电泳,逆转录,将荧光染料SYBR Green与目的基因和内参GADPH的引物混匀后,上机检测。反应参数:95 ℃ 30 s,1个循环;95 ℃ 5 s,55 ℃ 10 s,40个循环。采用2ΔΔCT法计算目的基因的表达水平,以GAPDH为内参。
2.3.6 Western blot法检测大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD蛋白表达水平 取大鼠海马组织,用试剂盒提取蛋白后,采用BCA蛋白定量法测定蛋白浓度;采用6%~15% SDS聚丙烯酰胺凝胶进行蛋白电泳,蛋白分离后采用恒定电流200 mA转膜至PVDF膜上;室温下5%脱脂奶粉封闭2 h,用相应的一抗,按照1∶1 000稀释,4 ℃孵育过夜;洗涤后换HRP标记二抗,按照1∶5 000稀释,室温孵育2 h,TBST洗涤3次,洗涤后显影;使用Image J(版本号:v1.8.0;版权所有者:美国国立卫生研究院)分析条带灰度值,测定目的条带和内参β-actin的灰度值,结果以样本灰度值与内参灰度值的比值表示。
2.3.7 ELISA法检测各组大鼠海马IL-1β、IL-6、IL-18、TNF-α水平 严格按照ELISA试剂盒说明书测定IL-1β、IL-6、IL-18、TNF-α水平。

3 结果
3.1 5组大鼠空间学习记忆能力比较 与假手术组比较,模型组大鼠逃避潜伏期明显延长(P<0.05),穿越平台次数明显减少(P<0.05),目标象限时间比明显降低(P<0.05);与模型组比较,多奈哌齐组,痴呆健脑方高、中剂量组大鼠逃避潜伏期明显缩短(P<0.05),穿越平台次数明显增加(P<0.05),目标象限时间比明显升高(P<0.05);痴呆健脑方高剂量组和中剂量组各项指标比较,差异无统计学意义(P>0.05)。见表1。

表1 5组大鼠空间学习记忆能力比较
3.2 5组大鼠海马神经元形态比较 假手术组大鼠海马神经元整体形态规整,分布均匀,神经元之间紧密,结构完整,排列整齐,层次明显,神经元型圆,核仁形态大小正常且清晰,神经元无明显缺失。模型组大鼠海马神经元整体形态不规则,神经元间隙大小不一,排列紊乱、不紧密,多数神经元结构不完整,层次较差,神经元细胞核固缩、碎裂、溶解,核仁消失,胞质减少,可见大量坏死的神经元,神经元缺失明显。多奈哌齐组大鼠海马神经元整体形态较模型组规整,神经元连接相对紧密,间隙相对均匀,神经元结构较明显,排列整齐,可见相对清楚的神经元细胞核,个别神经元细胞核固缩、碎裂,坏死的神经元较少。痴呆健脑方高剂量组和中剂量组大鼠海马大部分神经元分布均匀,形态规整,神经元间隙均匀,神经元型圆,神经元结构明显,层次清楚,核仁形态大小正常,神经元细胞核固缩、碎裂极少,坏死的神经元极少。

注:A.假手术组;B.模型组;C.多奈哌齐组;D.痴呆健脑方高剂量组;E.痴呆健脑方中剂量组
3.3 5组大鼠海马神经元凋亡率比较 假手术组大鼠海马组织内仅可见个别棕褐色的凋亡神经元,而模型组可见大量核染色的凋亡神经元,模型组神经元凋亡率明显高于假手术组(P<0.05);多奈哌齐组大鼠海马神经元凋亡率明显低于模型组(P<0.05);痴呆健脑方高剂量组大鼠海马内可见部分核呈棕褐色的凋亡神经元,痴呆健脑方高、中剂量组神经元凋亡率明显低于模型组(P<0.05);痴呆健脑方高、中剂量组神经元凋亡率比较,差异无统计学意义(P>0.05)。见表2、图2。

注:A.假手术组;B.模型组;C.多奈哌齐组;D.痴呆健脑方高剂量组;E.痴呆健脑方中剂量组;箭头示凋亡神经元

表2 5组大鼠神经元凋亡率比较
3.4 5组大鼠海马超微结构比较 假手术组大鼠海马神经元形态正常,核膜结构完整,细胞核染色均匀,核仁形态正常,细胞器结构正常,线粒体呈椭圆形,神经纤维排列整齐。模型组大鼠海马神经元呈现不同程度的变性坏死,形状不规则,神经元体积缩小,核固缩,核仁消失,细胞质减少,细胞器形态改变,线粒体和内质网肿胀。神经纤维排列走行紊乱,形态不规则。多奈哌齐组大鼠海马变性或坏死的神经元数量较少,线粒体结构相对完整,神经纤维排列走行相对清晰。痴呆健脑方高、中剂量组大鼠海马超微结构和神经元形态结构基本正常,变性或坏死的神经元极少,细胞器形态大致正常,线粒体形态结构基本完整,神经纤维排列走行整齐清晰。见图3。
3.5 5组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD mRNA表达水平比较 与假手术组比较,模型组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD mRNA表达水平均明显升高(P<0.05);与模型组比较,多奈哌齐组,痴呆健脑方高、中剂量组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD mRNA表达水平均明显降低(P<0.05);痴呆健脑方高、中剂量组上述5种mRNA水平比较,差异均无统计学意义(P>0.05)。见表3。
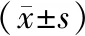
表3 5组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD mRNA表达水平比较
3.6 5组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD蛋白表达水平比较 与假手术组比较,模型组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD蛋白表达水平均明显升高(P<0.05);与模型组比较,多奈哌齐组,痴呆健脑方高、中剂量组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD蛋白表达水平均明显降低(P<0.05);痴呆健脑方高、中剂量组上述5种蛋白表达水平比较,差异均无统计学意义(P>0.05)。见表4、图4。

注:A.假手术组;B.模型组;C.多奈哌齐组;D.痴呆健脑方高剂量组;E.痴呆健脑方中剂量组

注:A.假手术组;B.模型组;C.多奈哌齐组;D.痴呆健脑方高剂量组;E.痴呆健脑方中剂量组

表4 5组大鼠海马NEK7、NLRP3、ASC、Caspase-1、GSDMD蛋白表达水平比较
3.7 5组大鼠海马IL-1β、IL-6、IL-18、TNF-α水平比较 与假手术组比较,模型组大鼠海马IL-1β、IL-6、IL-18、TNF-α水平明显升高(P<0.05);与模型组比较,多奈哌齐组,痴呆健脑方高、中剂量组大鼠海马IL-1β、IL-6、IL-18、TNF-α水平均明显降低(P<0.05);痴呆健脑方高、中剂量组上述4种炎症因子水平比较,差异均无统计学意义(P>0.05)。见表5。

表5 5组大鼠海马IL-1β、IL-6、IL-18、TNF-α水平比较
4 讨论
VD属中医学“呆病”范畴,为本虚标实之证,痰浊、瘀血痹阻脑络,日久致肾精亏虚是本病的基本病机。如《辨证奇闻·呆》曰:“痰不化,胃衰则土不制水,痰不消,于是痰积胸中,盘踞心外,使神明不清,呆成。”《医林改错·脑髓说》曰:“高年无记性者,脑髓渐空。”
神经炎症是VD发病机制的重要组成部分[10]。过度炎症反应可导致神经元、神经胶质细胞死亡,触发炎症级联反应,加剧VD的发展;抑制炎症反应有助于神经元存活,改善本病的临床症状与预后[11]。一方面,脑缺血神经损伤后,激活炎症反应导致脑血管痉挛、加重脑组织缺血低氧和损伤[12];另一方面,炎症反应产生的抑炎细胞因子通过抑制炎症因子合成和相关受体表达,清除细胞碎片,重塑脑组织,进而提升认知功能,改善VD症状[13]。有研究[14-15]证实,通过抑制VD大鼠海马小胶质细胞活化,降低IL-1β、IL-18、TNF-α等因子释放,可减轻海马神经元损害,改善学习记忆能力。
NLRP3炎症小体作为神经炎症反应的重要介质,介导了神经元损伤和神经炎症反应[16],细胞内K+浓度的降低是NLRP3炎症小体激活的常见通路;作为K+的特定传感器,NEK7是NLRP3炎症小体激活过程中的重要调节物质,与NLRP3炎症小体相互作用,从而激活NLRP3炎症小体[17]。细胞焦亡是一种不同于凋亡和坏死的新型程序性细胞死亡方式,以细胞不断胀大直至膜破裂为主要表现,激活强烈的炎症反应[18]。NOD样受体蛋白形成炎症小体通路是细胞焦亡的重要通路,通过激活Caspase-1促使细胞焦亡从经典途径发生,诱导下游炎症细胞因子(IL-1β、IL-18等)的分泌、成熟与释放,以及GSDMD孔的形成[19-20],进而导致VD的发生和加剧,因此,NEK7/NLRP3炎症小体通路参与了VD的进程。
痴呆健脑方由薯蓣丸、通窍活血汤化裁而来,方中熟地黄、山茱萸、肉桂益肾填髓,石菖蒲、远志、茯苓化痰开窍,桃仁、川芎活血通经,党参、白术、生姜益气温中,诸药合用,共奏化痰通经、益肾填精之功[21]。多奈哌齐为目前治疗轻、中度VD的一线常用药物[22-24],但其临床疗效有待于进一步评价[25]。本研究结果表明,痴呆健脑方能有效改善VD大鼠空间学习记忆能力,抑制大鼠海马神经元凋亡,痴呆健脑方组虽可见部分核染色凋亡神经元,但神经元凋亡率明显低于模型组。痴呆健脑方组大鼠海马神经元形态结构相似,神经元核固缩、碎裂及坏死神经元极少;与模型组比较,神经元整体形态规则,间隙均匀致密,结构层次分明。痴呆健脑方组海马NEK7、NLRP3、ASC、Caspase-1、GSDMD mRNA和蛋白表达水平较模型组降低,IL-1β、IL-6、IL-18、TNF-α水平较模型组降低。痴呆健脑方对VD大鼠模型干预作用无剂量依赖性。
综上,痴呆健脑方可改善VD大鼠海马的微环境,从而提高认知、记忆功能,这一作用可能是通过靶向调节NEK7/NLRP3炎症小体通路相关蛋白表达水平,减少神经元凋亡后下游相关炎症因子表达,抑制炎症反应而实现的。

