色素通路相关基因在红背和黑背中华蜜蜂成年工蜂背板中的表达模式分析
王若虹, 杨振慧, 周诗文, 吴雨珈, 李秋方,2, 梁立强,石丹丹, 杨尚宁, 苗刘畅, 苏松坤,*, 聂红毅,*
(1. 福建农林大学蜂学与生物医药学院, 福州 350002; 2. 恩施土家族苗族自治州农业科学院, 恩施 445000)
昆虫体色的变化是十分普遍而且高度多样化的现象,这是其长期进化过程中为适应复杂的环境产生的。体壁的颜色是各种色素如黑色素、眼色素和喋呤色素等以及尿酸盐颗粒沉着的体现,色素之间不同的组合模式形成了各自独特的体色模式(高云等, 2020)。昆虫表皮内或皮细胞层下方各种色素分子是造成体壁成色的原因之一,形成的色素颗粒会随着不同的生理状态而有所变动,以此来改变表皮的颜色。为适应环境变化,昆虫复杂的体色变化受到多种因子的影响,各代谢通路中的1种或多种色素前体或酶含量的改变都会影响体色。在果蝇Drosophila和家蚕Bombyxmori中,yellow-y突变导致表皮呈现为黄色(Wittkoppetal., 2002; Futahashietal., 2008);家蚕柠檬蚕突变体中SPR突变导致幼虫体表墨蝶呤的积累从而呈现黄色(Mengetal., 2009);家蚕由于犬尿氨酸羟化酶cinnabar缺失形成白卵突变体w-1,其成虫眼色呈现为白色而非黑褐色(Quanetal., 2002)。在昆虫中,色素在体色形成、防御、体温调节和觅食等方面具有重要作用(Wittkopp and Beldade, 2009; Kronforstetal., 2012)。
由于果蝇和家蚕中存在较多的色素突变体以及已有的成熟的遗传操作工具,因此对果蝇和家蚕色素形成机制所开展的研究工作较多。昆虫的体色主要由黑色素、蝶呤、眼色素及尿酸盐颗粒共同决定(孙明霞等, 2020)。作为膜翅目的蜜蜂,具有婚飞交配和清理行为的特性,导致大量的突变体很难保存,因此,色素形成机制方面的研究工作较少。不同蜂种的蜜蜂以及相同蜂种不同生态型之间在体色上都会产生差异。目前蜜蜂属蜜蜂共有9种,其中我国主要饲养中华蜜蜂Apisceranacerana(东方蜜蜂Apiscerana指名亚种)和西方蜜蜂A.mellifera。中华蜜蜂是我国独有的蜜蜂种质资源,已经进化出适应当地生态环境的9种生态型:北方中华蜜蜂、华中中华蜜蜂、华南中华蜜蜂、长白山中华蜜蜂、阿坝中华蜜蜂、海南中华蜜蜂、滇南中华蜜蜂、云贵中华蜜蜂和西藏中华蜜蜂,这些中华蜜蜂腹部的体色呈现地域多样性,但胸部背板基本均呈现黑色(薛运波, 2020)。廖文新(2019)在福建三明市蜂场首次发现了一群胸部背板棕红色的中华蜜蜂,之后称为红背中华蜜蜂。红背中华蜜蜂的发现丰富了中华蜜蜂遗传资源,为蜜蜂着色分子机制的研究提供了较好的生物材料,然而,截止目前为止,红背中华蜜蜂的形态及其着色差异的分子机制尚未报道。
本研究运用体视显微镜观察红背中华蜜蜂和黑背中华蜜蜂的体表颜色差异;通过同源比对鉴定中华蜜蜂色素通路相关基因,包括黑色素通路苯丙氨酸羟化酶(phenylalanine hydroxylase, PAH)基因、酪氨酸羟化酶(tyrosine hydroxylase, TH)基因、多巴脱羧酶(dopa decarboxylase, DDC)基因、NBAD合成酶基因ebony、NBAD水解酶基因tan、芳烷基胺乙酰转移酶(arylalkylamine-N-acetyltransferase, aaNAT)基因、多巴色素转移酶基因yellow-y和酚氧化酶基因laccase2,蝶呤通路GTP环化水解酶Ⅰ(GTP cyclo-hydrolase Ⅰ, GTPCH Ⅰ)基因、墨蝶呤还原酶(sepia pterin reductase, SPR)基因和6-丙酮酰基四氢生物蝶呤合酶(6-pyruvoyl-tetrahydropterin synthase, PTPS)基因,眼色素通路色氨酸氧化酶基因vermilion、犬尿氨酸羟化酶基因cinnabar,以及尿酸盐转运相关的尿酸盐颗粒转运基因BLOS2、Hermansky-Pudlak综合征5的同源基因HPS5、半型ABC转运蛋白基因OK(okusatranslucent)、转运尿酸盐颗粒基因Varp(VPS9-ankyrinrepeat-containingprotein);利用荧光定量PCR检测以上色素通路及尿酸盐转运相关的基因在红背中华蜜蜂中的表达量变化。这些结果为阐明红背中华蜜蜂色素形成的分子机制提供大量可靠的数据,同时也为中华蜜蜂的分子选育提供理论指导。
1 材料与方法
1.1 实验蜂群
蜂群饲养于福建农林大学蜂学与生物医药学院实验蜂场,其中红背中华蜜蜂蜂王来自福建省三明市;分别选取3群群势强且健康的红背中华蜜蜂和黑背中华蜜蜂(正常个体)用于后续实验。
1.2 主要仪器及试剂
连续变倍体视显微镜(奥特光学SZ680)、紫外分光光度计(NanoDrop 2000)、冷光源(至宸F-150C)、荧光定量PCR仪(美国Bio-Rad公司)以及购自于Vazyme公司的Hiscript®Ⅱ Q RT SuperMix for qPCR (+gDNA Wiper)和ChamQ Universal SYBR qPCR Master Mix。
1.3 红背和黑背中华蜜蜂成年工蜂的形态观察与样本收集
为了准确控制取样时间,将红背中华蜜蜂和黑背中华蜜蜂蜂群中成熟封盖子脾装入蜂王产卵控制器中,然后置于恒温培养箱(温度31 ℃,相对湿度61%),待其羽化出房。收集出房后6 h内的红背中华蜜蜂和黑背中华蜜蜂用于形态观察和后续分子检测。将刚羽化出房的红背中华蜜蜂和黑背中华蜜蜂分别放入1.5 mL离心管中,通入CO2麻醉10 min ,置于体视显微镜下观察拍照;同时分别将60头刚出房的红背中华蜜蜂和黑背中华蜜蜂迅速放入液氮中冷冻保存。解剖红背中华蜜蜂和黑背中华蜜蜂的胸部背板和腹部体壁组织,12只胸部背板为1组,各5组;6只腹部体壁组织为1组,各4组,用于后续荧光定量PCR检测。
1.4 中华蜜蜂色素通路相关基因的鉴定
分别用黑腹果蝇D.melanogaster的DDC(GenBank登录号: NP_724164.1),PAH(GenBank登录号: NP_523963.2)和tan(GenBank登录号: NP_001285042.1);西方蜜蜂的aaNAT(GenBank登录号: XP_026299012.1),TH(GenBank登录号: NP_001011633.1),ebony(GenBank登录号: XP_016772147.2),yellow-y(GenBank登录号: NP_001091693.1),laccase2(GenBank登录号: XP_006562317),SPR(GenBank登录号: XP_016770924.1),PTPS(GenBank登录号: XP_006571389.1),cinnabar(GenBank登录号: XP_026296051.1),HPS5(GenBank登录号: XP_003250103.1);赤拟谷盗Triboliumcastaneum的vermilion(GenBank登录号: NP_001034499.1);家蚕的GTPCHI(GenBank登录号: NP_001138797.1),BLOS2(GenBank登录号: XP_021207937.2),OK(GenBank登录号: XP_012551185.2),Varp(GenBank登录号: NP_001166968.1), 受体型鸟苷酸环化酶(receptor-type guanylate cyclase, GC-I)基因(GenBank登录号: NP_001036870.1)氨基酸序列作为参考序列,利用BLAST(NCBI)在东方蜜蜂基因组数据库(GenBank登录号: ACSNU-2.0)中进行检索,最后选择相似度和得分最高的序列作为中华蜜蜂的同源序列。利用Primer Premier 6.0软件对中华蜜蜂中参与黑色素、眼色素、蝶呤通路和尿酸盐转运相关基因的同源基因设计特异性引物(表1)。

表1 引物信息
1.5 色素通路相关基因的荧光定量PCR检测
利用Trizol法分别提取1.3节刚出房红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板和腹部体壁组织RNA,取1 μg总RNA参照Hiscript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)操作说明反转录为cDNA,对1.4节筛选的色素通路相关同源基因表达量进行检测;中华蜜蜂Actin作为相对定量的内参基因;荧光定量PCR反应体系(10 μL): 2×ChamQ SYBR Color qPCR Master Mix (Low ROX Premixed) 5 μL, 上下游引物(10 μmol/L)各0.2 μL,cDNA模板1 μL,ddH2O3.6 μL。反应程序:
95 ℃预变性30 s; 95 ℃变性15 s, 60 ℃ 30 s, 39个循环。每个样本3个技术重复。
1.6 数据分析
以2-ΔΔCt法计算基因的相对表达量,GarphPad Prism 8软件处理实验数据,采用数据分析中的独立样本T检验(independent samplesT-test)进行显著性分析。
2 结果
2.1 刚出房红背中华蜜蜂和黑背中华蜜蜂的形态
与黑背中华蜜蜂相比,红背中华蜜蜂个体的胸部背板呈现棕红色,其他部位并无明显变化(图1: A);在背板放大图中,可以明显看到两者胸部背板上的绒毛都是淡黄色,只有背板表皮存在颜色差异(图1: B)。
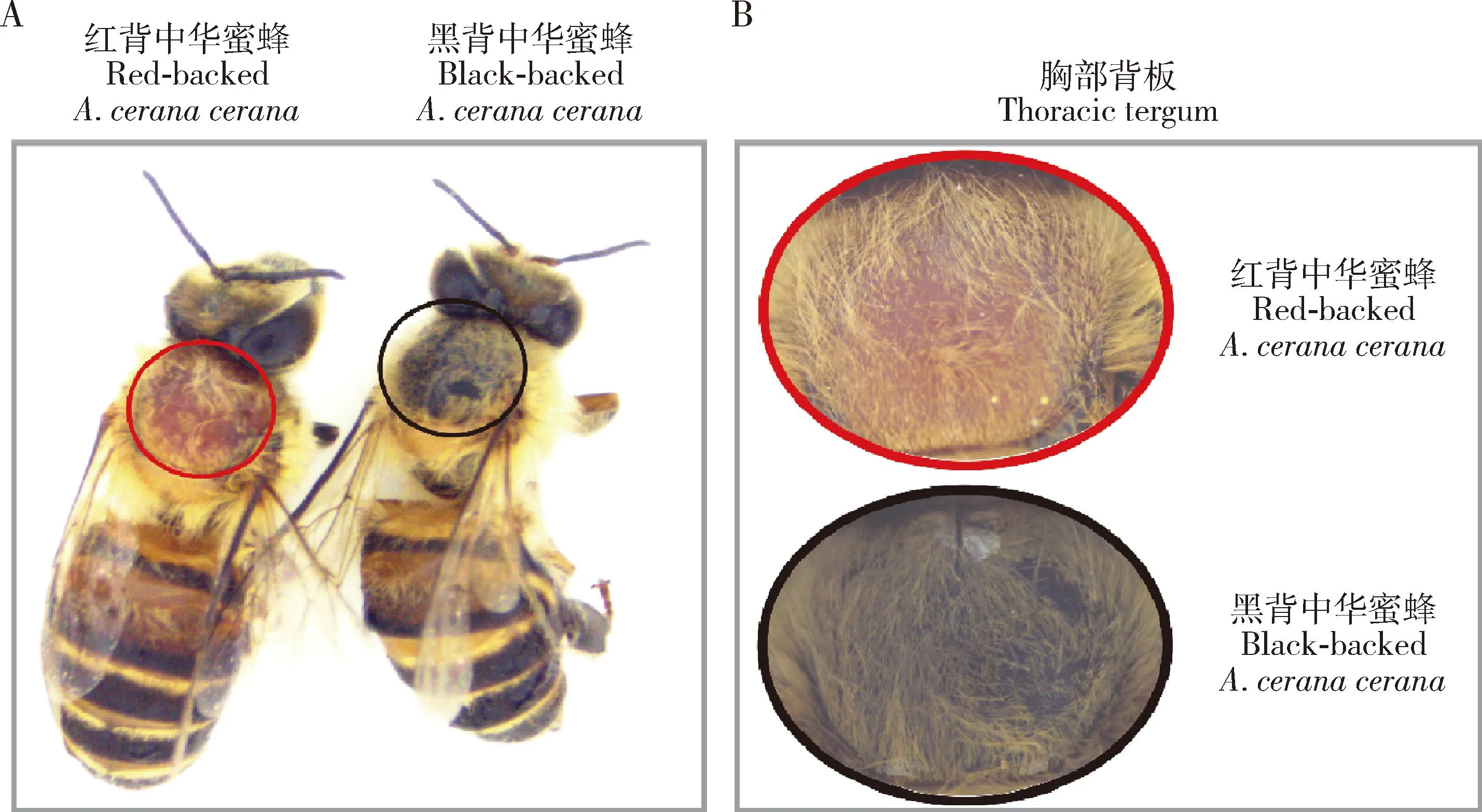
图1 红背中华蜜蜂和黑背中华蜜蜂成年工蜂形态观察
2.2 黑色素代谢通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中的表达模式
荧光定量PCR检测结果表明(图2),tan在红背中华蜜蜂胸部背板中的表达量显著低于黑背中华蜜蜂胸部背板中的表达量(P<0.05),而laccase2在红背中华蜜蜂胸部背板中的表达量则较黑背中华蜜蜂胸部背板中的表达量显著上调(P<0.05);TH,ebony和yellow-y在红背中华蜜蜂胸部背板中表达量较黑背中华蜜蜂的均略有增加,PAH,DDC和aaNAT在红背中华蜜蜂胸部背板中表达量较黑背中华蜜蜂的均略有下调。
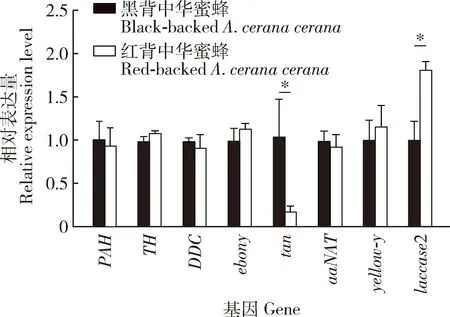
图2 黑色素代谢通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中相对表达量
2.3 蝶呤通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中的表达模式
结果显示(图3),相较于黑背中华蜜蜂,红背中华蜜蜂胸部背板中SPR表达量显著下调(P<0.05),GTPCHI和PTPS则略有上调,GC-I略有下调,但都无显著差异(P>0.05)。

图3 蝶呤通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中的相对表达量
2.4 眼色素通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中的表达模式
结果显示(图4),vermilion和cinnabar在红背中华蜜蜂胸部背板中表达量较黑背中华蜜蜂的均显著下调(vermilion:P<0.01;cinnabar:P<0.05)。
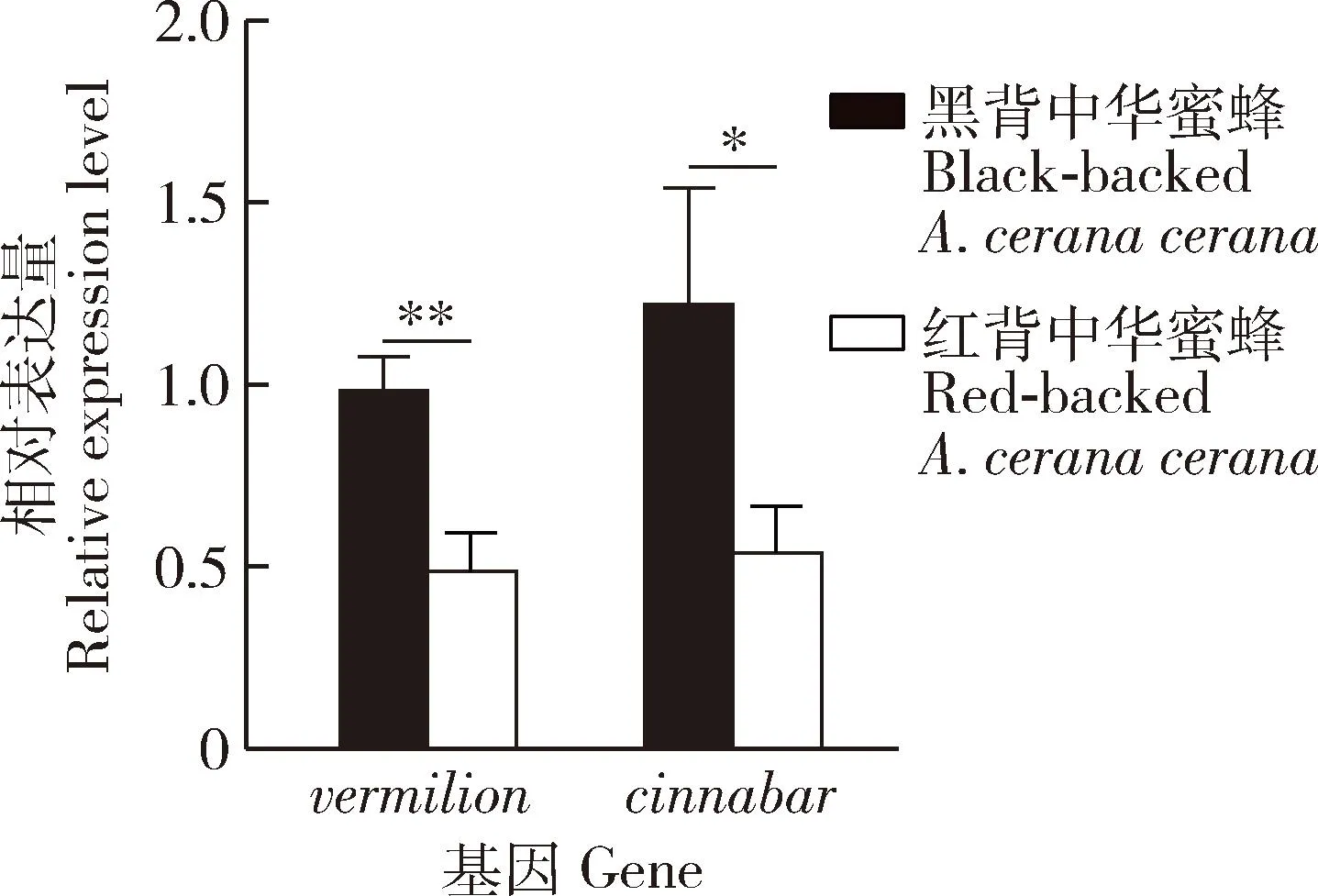
图4 眼色素通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中相对表达量
2.5 尿酸盐转运相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中的表达模式
结果显示(图5),BLOS2在红背中华蜜蜂胸部背板中表达量显著低于黑背中华蜜蜂胸部背板中的表达量(P<0.01),而OK在红背中华蜜蜂胸部背板中的表达量则较黑背中华蜜蜂胸部背板中的表达量显著上调(P<0.05),HPS5和Varp在红背中华蜜蜂胸部背板中的表达量较黑背中华蜜蜂的均略有下调(图5)。
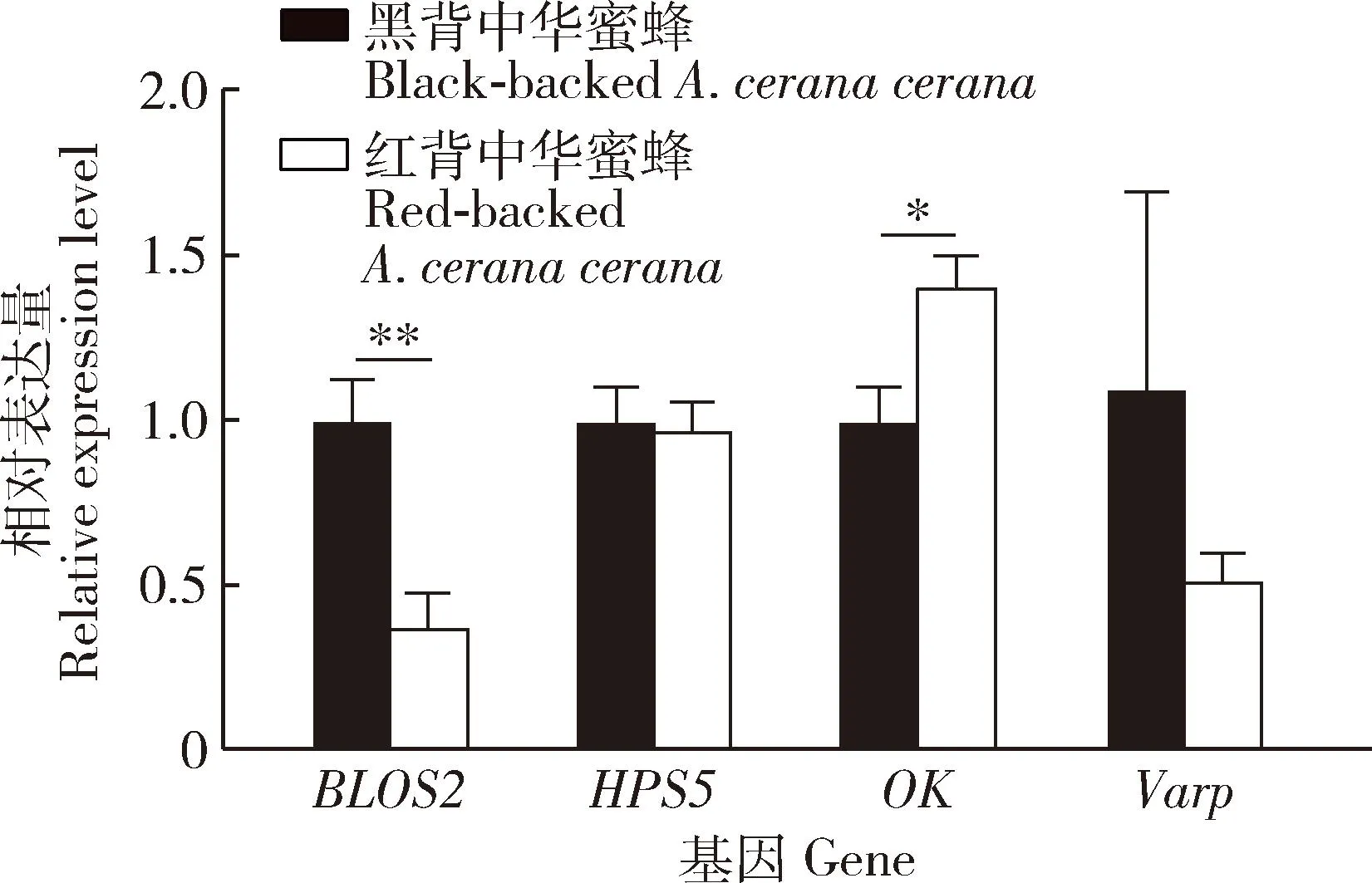
图5 尿酸盐转运相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板中相对表达量
2.6 色素通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂腹部体壁中的表达模式
为了确定红背中华蜜蜂和黑背中华蜜蜂成年工蜂胸部背板色素相关差异表达基因在腹部体壁中是否也存在差异,利用荧光定量PCR分别检测红背中华蜜蜂和黑背中华蜜蜂腹部体壁色素通路相关基因(tan,laccase2,SPR,vermilion,cinnabar,BLOS2和OK)的相对表达量。结果表明,OK在红背中华蜜蜂腹部体壁中的相对表达量显著低于黑背中华蜜蜂的(P<0.05),其他基因表达量无显著变化(P>0.05)(图6)。
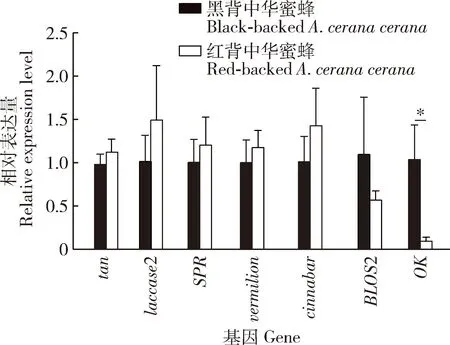
图6 色素通路相关基因在红背中华蜜蜂和黑背中华蜜蜂成年工蜂腹部体壁中的相对表达量
3 讨论与结论
本研究全面比较了红背中华蜜蜂和黑背中华蜜蜂的形态差异,并检测了黑色素、蝶呤、眼色素通路和参与尿酸盐转运的相关基因在红背中华蜜蜂和黑背中华蜜蜂胸部背板中相对表达量。这些结果为阐明红背中华蜜蜂色素形成的分子机制提供大量可靠的数据。
黑色素通路是参与昆虫着色的重要通路,昆虫中多巴胺是合成黑色素的主要前体物质,ebony催化多巴胺合成N-β-丙酰多巴胺(N-β-alanyl dopamine, NBAD),tan水解NBAD形成多巴胺,NBAD 经laccase 2氧化生成NBAD骨质参与表皮鞣化,呈现棕色表皮(Sugumaranetal., 1999; Sugumaran, 2002);此外,家蚕tan的突变导致红眼纹(rouge,ro)突变体产生,在幼虫体表形成红褐色的斑纹(Futahashietal., 2010)。本研究检测到红背中华蜜蜂在黑色素通路tan的表达量较黑背中华蜜蜂的显著下调,laccase2的表达量显著上调(图2),推测红背中华蜜蜂胸部背板有更多的多巴胺参与NBAD合成,并进一步被氧化形成红褐色表皮。
由蝶呤合成的蝶呤类色素是可在昆虫表皮和蝶类翅中呈现红色、黄橙色的一类色素物质(Wijnenetal., 2007)。SPR是合成四氢生物喋呤(tetrahydrobiopterin, BH4)所必需的,柠檬蚕(lem)是一种幼虫体色突变体,色素分离鉴定实验表明,SPR活性降低使得幼虫时期积累着大量的墨蝶呤和墨蝶呤脱氨产物,最终呈现黄体色表皮(Mengetal., 2009)。SPR不同程度地突变,使SPR活性也会发生相应程度的降低。我们检测到红背中华蜜蜂背板中蝶呤色素通路SPR的表达量较黑背中华蜜蜂的显著下调(图3), 基于此, 我们推测这将使得红背中华蜜蜂背板呈现类似柠檬色或某种过渡状态的体色。
眼色素在昆虫中影响复眼、体表以及蝶类翅膀的着色,产生黑色或褐色的眼睛和红色的表皮或翅。已有的研究发现,敲除乳草长蝽Oncopeltusfasciatics的vermilion以及敲除丽蝇蛹集金小蜂Nasoniavitripennis的cinnabar都可产生红色眼睛的成虫后代(Lietal., 2017; Redingetal., 2023)。本研究检测到红背中华蜜蜂胸部背板中眼色素通路相关基因vermilion和cinnabar表达量都显著下调(图4),推测可能是眼色素的生物合成减少形成了中华蜜蜂红褐色的胸部背板。此外,昆虫眼色素分为2类,暗眼色素 (ommin)和淡眼色素 (ommatins)(Figonetal., 2020)。暗眼色素普遍存在于昆虫的眼睛中,少数昆虫的表皮中也有分布,而淡眼色素存在于昆虫的排泄物、眼睛、表皮和翅中(Linzen, 1970, 1974; Nijhout, 1997)。家蚕野生型都含暗眼色素色素和淡眼色素色素,家蚕的re突变体通过定位克隆确定是由re(编码MFS转运蛋白)基因变异产生re突变体,可能导致了暗眼色素合成缺陷,从而形成深红色卵(Osanai-Futahashietal., 2012);家蚕pe突变体由于cardinal(吩噁嗪酮合成酶)基因突变不表达使得xanthommatin色素合成异常,形成红色眼睛和白色或淡粉色的卵,而非正常的深色(Osanai-Futahashietal., 2016);褐飞虱Nilaparvatalugens红眼突变体头部眼黄素的含量显著低于褐色眼野生型(蒋鹏凌, 2013),这些报道都表明眼色素的减少都会呈现红体色。
在昆虫中,尿酸以尿酸盐颗粒的形式储存在昆虫体内,逐渐向幼虫表皮迁移和积累,影响昆虫表皮的着色(Tasakietal., 2017)。尿酸盐颗粒在家蚕幼虫真皮细胞的积累使得体壁变成白色或者不透明,保护幼虫不受紫外线的伤害(Huetal., 2013)。柞蚕Antheraeapernyi2龄幼虫BLOS2基因RNA干扰后幼虫体壁出现了少量相对不同程度浅色状,可能是柞蚕的天然体色遮盖或者其他基因的影响并未出现明显的大面积半透明或透明个体(马月月等, 2020);家蚕OK的RNA干扰也会导致半透明体色(Wangetal., 2013)。在本研究中,我们检测到红背中华蜜蜂的胸部背板尿酸盐转运相关基因BLOS2表达量显著下调、OK表达量显著上调(图5),腹部体壁中OK表达量显著下调(图6),然而胸部背板和腹部体壁并未出现透明、半透明体色,可能是因为BLOS2和OK以及其他尿酸盐转运相关基因共同作用导致体色未发生透明状,也可能是由黑色素、蝶呤、眼色素和尿素颗粒共同作用的结果。
综上所述,我们检测到红背中华蜜蜂胸部背板中部分黑色素、蝶呤、眼色素及尿酸盐转运相关基因表达量均发生了显著变化(图2-5), 而在腹部体壁中没有显著差异(图6),暗示这些基因在红背中华蜜蜂胸部背板色素形成过程发挥重要的作用。研究发现家蚕鹑斑(quail,q)突变体5龄第1天幼虫时表皮呈现粉红色,而对照组则为白色;色素含量测定分析发现q突变体中黑色素、眼色素及喋呤色素均发生异常增加(Katoetal., 2006; Nieetal., 2014),这种变化与红背中华蜜蜂检测到色素通路相关基因表达量变化结果(图2-4)相似。通过定位克隆发现q的突变基因为GC-1(Yuasaetal., 2016)。通过荧光定量PCR检测,我们发现GC-1在红背中华蜜蜂背板中表达量有降低,但是不存在显著差异(图3),这些结果暗示红背中华蜜蜂中可能存在与家蚕q突变体不同的分子调控机制。红背中华蜜蜂的性状可以稳定传递给后代,但是控制该性状的基因尚不明确。后续可以配制红背中华蜜蜂纯系材料,通过图位克隆的方法锁定其突变基因,比较红背中华蜜蜂和黑背中华蜜蜂的遗传差异,阐明突变的分子机制。同时,文献报道昆虫的体色也受到环境因素的调节,如视觉、嗅觉和触觉、温度、光照周期等刺激以及内分泌因素(激素、信息素等) (陈兵等, 2023; Huangetal., 2023),红背中蜂是否受到环境因素的调节需要后续进一步研究,这也将有助于深入挖掘和培育优良的中蜂遗传资源。

