基于UPLC-Q-Exactive-Orbitrap-MS、网络药理学和实验验证探讨裸花紫珠抗H1N1活性成分及其作用机制
杨 颖,邵骏菁,许金珂,陈 岩,田景振*,侯 林*
1山东中医药大学药学院,济南 250355;2山东中医药大学 青岛中医药科学院,青岛 266000;3济宁医学院基础医学院,济宁 272067;4山东省疾病预防控制中心,济南 250014
中药裸花紫珠是马鞭草科植物裸花紫珠(CallicarpanudifloraHook.& Arn.)的干燥叶。裸花紫珠主要分布于海南、广西、广东等地区,道地产区为海南省五指山区[1]。裸花紫珠是2020版《中华人民共和国药典》唯一新增中药材,其单方制剂裸花紫珠片和裸花紫珠胶囊被广泛地用于治疗血热毒盛所致的呼吸道、消化道出血及细菌感染性炎症。植物化学家已经从裸花紫珠中鉴定出300余种化合物,包括苯丙素类、黄酮类、三萜类、二萜类、环烯醚萜类、挥发油类等[1-4]。现代药理学研究证实裸花紫珠具有抗炎、抗血栓、抗肿瘤、抗菌和保肝等活性[5-9]。在筛选具有抗病毒活性的中药的过程中,发现裸花紫珠提取物具有良好的抗病毒(如甲型流感病毒H1N1型(H1N1)、肠道病毒71型等)活性[10,11]。甲型流感病毒感染是肺炎相关死亡病例的常见病因。严重的甲型流感病毒感染会引起双侧肺部浸润和低氧血症,即急性呼吸窘迫综合征,是甲型流感病毒导致死亡的主要原因之一[12,13]。本实验围绕裸花紫珠的抗H1N1活性展开,利用超高效液相色谱-四级杆-静电场轨道阱联用(UPLC-Q-Exactive-Orbitrap-MS)对裸花紫珠有效部位的化学成分进行鉴定,利用网络药理学对裸花紫珠抗H1N1的作用机制进行预测,并进行实验验证,初步探讨裸花紫珠抗H1N1的作用机制。
1 材料与方法
1.1 主要试剂
中药裸花紫珠由江西普正药业股份有限公司提供,经吴永忠研究员鉴定为马鞭草科植物裸花紫珠Callicarpanudiflora的干燥叶,标本存放于青岛中医药科学院药库,标本号为QKY221104。
磷酸奥司他韦颗粒(批号0582201015,广东东阳光药业股份有限公司);DMEM细胞培养液、胎牛血清、细胞消化液(EDTA-0.25%胰酶)、PBS、双抗、Opti-MEM培养基均为Gibco品牌(批号分别为812207、10270-106、2323363、BYHC1713、HYT11280 746、31985070);TPCK胰蛋白酶(Sigma,批号T8802)。
石油醚、乙酸乙酯、正丁醇(分析纯,科隆化学试剂有限公司);异氟烷(易弗宁,批号20220202);肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、血清免疫球蛋白G(IgG)、白介素1β(IL-1β)ELISA试剂盒(上海酶联生物科技有限公司,批号均为11/2021);标准品毛蕊花糖苷、阿魏酸、咖啡酸、木犀草苷、金圣草(黄)素和异槲皮苷采购自上海源叶(批号分别为Y21A9H59554、H25M6L1、Y25O8C46530、Y05D8H4 9919、Y10J11W118163、P25J9F65872,纯度均为>98%);柚皮素、木犀草素、槲皮素、齐墩果酸购自大连美仑(批号分别为M0506AS、M0525AS、01023AS、D0701AS,纯度均为>98%)。
TIANamp Virus DNA/RNA Kit(北京天根生化科技有限公司,W0229);BeyoFast-SYBR Green One-Step实时荧光定量聚合酶链式反应(Real-time PCR)Kit(上海碧云天生物技术有限公司,批号:110821220208);H1N1引物F:5′-GTATGGACCTGCCGTAGC-3′,R:5′-GCTTCCACCAGGGTTCTC-3′;GA PDH引物F:5′-GGATGCTGCCCTTACCC-3′,R:5′-GTTCACACCGACCTTCACC-3′(北京擎科生物科技股份有限公司)。
1.2 细胞与病毒
犬肾细胞(MDCK细胞,作为H1N1的宿主)、H1N1(病毒株为A/Puerto Rico/8/1934),均由山东省医学科学院提供。
1.3 动物
6周龄BALB/c雌性小鼠50只,体重15~18 g,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2021-0006,实验单位动物使用许可证号SYXK(鲁)2017-0022。本研究在山东中医药大学动物护理使用专业委员会(山东济南,伦理审批号:SDUTCM20220415022)的监管下进行。
1.4 主要仪器
超高效液相色谱-四级杆-静电场轨道阱联用仪(赛默飞世尔科技公司,Thermo Fisher Ultimate 3000型及Q Exactive型);质谱工作站(赛默飞世尔科技公司,Xcalibur 3.0型);小动物麻醉机(瑞沃德,R500IR);十万分之一天平(赛多利斯,CPA225D);低速离心机(安徽中科中佳科学仪器有限公司,SC-3610);生物安全柜、CO2培养箱均采购自上海力申科学仪器公司(型号分别为HFsafe-1200TE、HF90);酶标仪(Bio Tek,EPOCH2T);倒置显微镜(OLYMPUS CKX41);Real-time PCR仪(瑞士ROCHE公司,Light Cycler 480 Ⅱ型)。
1.5 实验方法
1.5.1 裸花紫珠不同萃取物的制备
取适量裸花紫珠药材,粉碎,过40目筛,浸泡30 min,依次用8倍量的95%乙醇、75%乙醇和水进行提取,每种溶剂提取2 h,合并三种溶剂的提取液,浓缩至1 g/mL。依次用石油醚、乙酸乙酯和正丁醇萃取,每种试剂萃取三次。合并萃取液,旋转蒸发至稠浸膏状,烘干,得到石油醚、乙酸乙酯、正丁醇和萃余水四种萃取物。
1.5.2 体外抗病毒活性研究
将不同浓度的上述四种萃取物和磷酸奥司他韦接种至MDCK细胞,培养48 h。利用MTT试剂盒检测四种萃取物和磷酸奥司他韦对MDCK细胞的50%细胞毒浓度(CC50)。选择细胞存活率大于90%的最大药物浓度作为药物的非细胞毒浓度。H1N1感染MDCK细胞的过程是在含有1 000 U/mL青霉素、100 μg/mL链霉素和2 μg/mL TPCK-胰酶的Opti-MEM培养基中进行。取96孔板,每孔接种浓度为1×105细胞/mL的细胞悬液100 μL,培养24 h(37 ℃,5% CO2)。将细胞板弃去细胞培养液且用PBS清洗两次,每孔分别加入100 μL不同浓度的各个萃取物或磷酸奥司他韦溶液和100 μL H1N1病毒稀释液(由TCID50为1×106的病毒原液稀释100倍得到)。培养48 h后用MTT试剂盒检测细胞存活率,并按照Reed-Muench法计算四种萃取物和磷酸奥司他韦对H1N1的半数抑制浓度(IC50)[14,15]。同时计算选择指数(SI,CC50/IC50)用来判断药物效果的安全范围,SI越大安全范围越大。
1.5.3 化学成分分析
1.5.3.1 混合对照品溶液和样品溶液的制备
用甲醇溶解适量的对照品包括毛蕊花糖苷、阿魏酸、咖啡酸、木犀草苷、金圣草(黄)素、异槲皮苷、柚皮素,木犀草素、槲皮素和齐墩果酸,然后转移至10 mL容量瓶中,加甲醇至刻线,摇匀。在12 000 r/min的条件下离心5 min,用0.22 μm的微孔滤膜过滤,得到混合对照品溶液。
精密称取裸花紫珠乙酸乙酯萃取物(the ethyl acetate extraction part ofCallicarpanudiflora,EACN)0.1 g,加甲醇溶解后转移至容量瓶,继续加甲醇定容至10 mL,摇匀。在12 000 r/min的条件下离心5min,用0.22 μm的微孔滤膜过滤,得到样品溶液。
1.5.3.2 色谱条件
色谱柱:Acquity UPLC®HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);流动相:乙腈(A)-0.1%乙酸水(B),梯度洗脱:0~35 min,5%→21% A;35~40 min,21%→26% A;40~45 min,26%→35% A;45~50 min,35%→55% A;50~55 min,55%→75% A;55~60 min,75%→85% A。流速:0.3 mL/min;柱温箱温度:35 °C;进样体积:5 μL。
1.5.3.3 质谱条件
正离子模式的喷雾电压设置为3 500 V,负离子模式为3 000 V;毛细管温度350 ℃,辅助气体加热器温度350 ℃;扫描方式:全MS(分辨率70 000)和MS/MS(分辨率17 500)。扫描范围:M/z 80-1 200;阶跃归一化碰撞能量为20、40和60 eV。UPLC-Q-Orbitrap-MS的仪器控制、数据采集和分析使用Xcalbur软件3.0(Thermo Fisher,CA,USA)进行。对于不能用对照品标出的化合物,根据数据库MassBank(https://massbank.eu/)、FooDB数据库(https://foodb.ca)和文献数据[2,16]中的高精度准分子离子、同位素分布和碎片模式进行了初步鉴定。
1.5.4 EACN中化学成分相关靶点和H1N1相关靶点的获取
为了获取EACN中化学成分的靶点,我们利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)和Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)[17,18],逐个检索表1中的化学成分。在PubChem数据库中将“activity”设置为“active”,“taxids”设置为“9606”,在Swiss Target Prediction数据库中设置筛选条件为“homo spines”,Probability*>0.05。合并两个数据库筛选的结果并通过UniProt数据库(http://www.uniprot.org/)将靶标转换为基因符号。H1N1的相关靶点来自于GeneCards数据库(https://www.genecards.org/)、DisGeNET数据库(http://www.disgenet.org/)和OMIM数据库(https://omim.org/)三个数据库[19,20]。利用Venny 2.1版平台(https://bioinfogp.cnb.csic.es/tools/venny/index.html)获取“H1N1”相关靶点与EACN相关靶点交集。
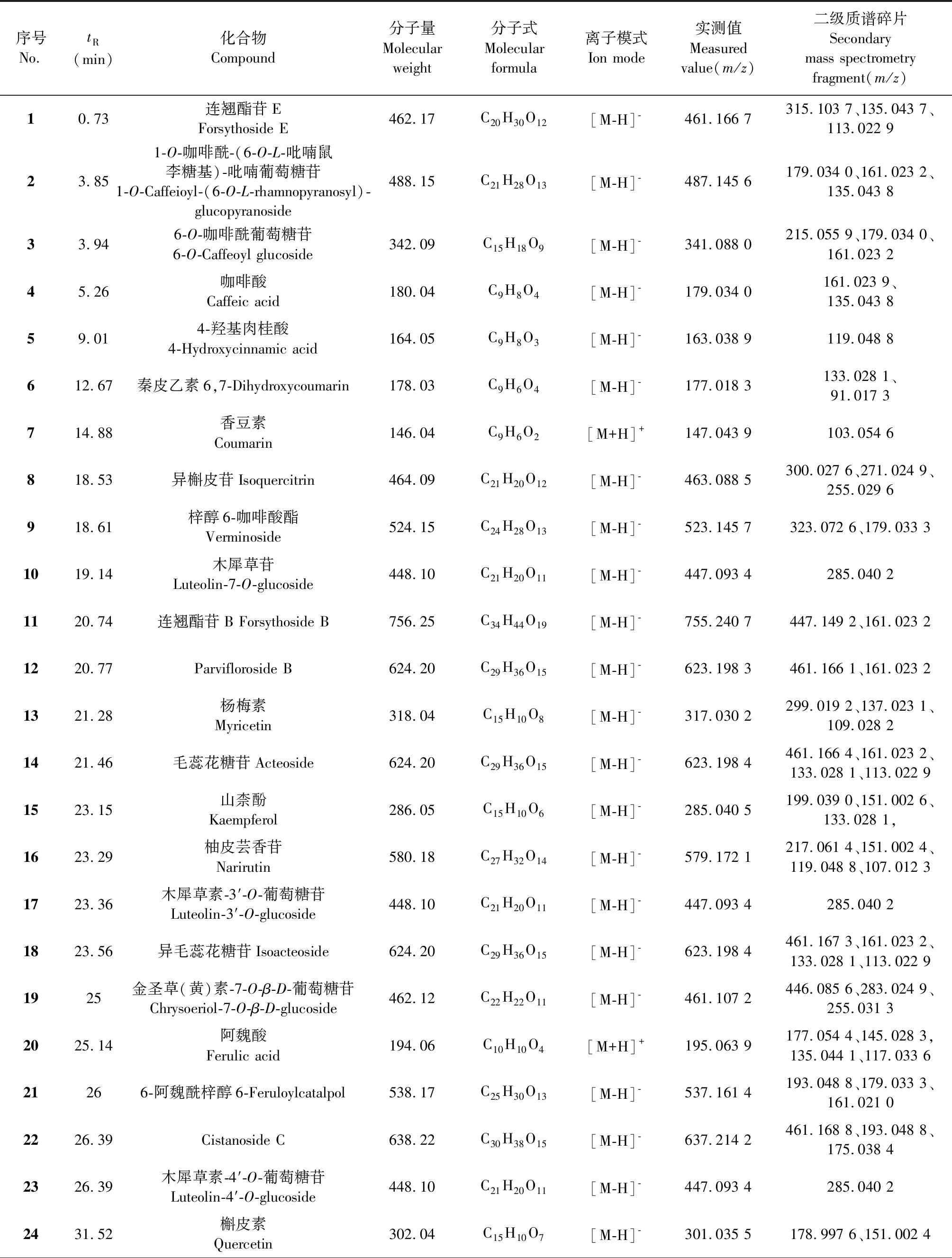
表1 EACN中鉴定出的化学成分
1.5.5 GO、KEGG富集分析和网络的构建
将活性成分与H1N1的重叠靶点导入至Metascape平台(http://www.metascape.org/)进行基因本体(gene ontology,GO)功能富集分析,探讨药物作用的生物学过程,描述基因靶点的功能,包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC);同样对上述基因进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,探讨药物作用的生物通路,得到潜在靶点所富集的信号通路。GO和KEGG富集分析条件均为P<0.05,最小count为3。富集结果通过在线可视化平台(http://www.bioinformatics.com.cn/)进行可视化。利用Cytoscape 3.6.0对药物-成分-靶点-通路-疾病网络进行可视化,字体的大小按照度值进行展示,度值越高的节点,字体越大。
1.5.6 EACN体内抗H1N1研究
将小鼠随机分为5组,每组10只,分别为空白对照组(control,Con)、模型对照组(model,Mod),磷酸奥司他韦组(oseltamivir phosphate,OP,1.25 mg/mL),EACN高剂量组(EACN-H,7.8 mg/mL)、EACN低剂量组(EACN-L,3.12 mg/mL)。适应性饲养3 d后,利用小动物麻醉机对小鼠进行麻醉,每只小鼠滴鼻给予20 μL H1N1病毒稀释液,空白对照组滴鼻给予等体积PBS,2 h后灌胃给药(0.2 mL/只),每天称定小鼠体重。在给药6 d后,利用小动物麻醉机对小鼠进行麻醉,并使得小鼠在规定时间内安乐死,采集外周血并摘取肺组织,称定质量,计算肺指数(肺指数=肺质量/小鼠体质量×100%)。将肺组织分为两份,一份用4%甲醛固定,经脱水、组织透明、浸蜡、包埋、切片、烘干后进行HE染色以观察肺部病变。另一份肺组织经组织匀浆并离心后,上清液用TIANamp Virus DNA/RNA Kit提取病毒RNA,并利用BeyoFastTMSYBR Green One-Step Real-time PCR Kit对提取到的RNA进行反转录和扩增。将小鼠外周血置于EP管中,4 ℃下过夜后在4 ℃、3 000 r/min条件下离心20 min,取上清,ELISA法检测血清TNF-α、IFN-γ、IgG、IL-1β水平。
2 实验结果
2.1 裸花紫珠抗H1N1有效萃取部位的筛选
体外实验结果显示,作为阳性对照,磷酸奥司他韦对MDCK细胞的CC50为565.8 μg/mL,对H1N1的IC50为45.01 μg/mL,选择指数(SI)为12.57(见图1)。正丁醇、乙酸乙酯和石油醚三个萃取部位对MDCK细胞的CC50分别为1 280.0、859.4、71.5 μg/mL。正丁醇、乙酸乙酯和石油醚三个萃取部位对H1N1的IC50分别为270、51、7.23 μg/mL,SI分别为4.74、16.85、9.9(见图2~4),萃余水部位没有明显的抗H1N1的活性,因此未对萃余水部位抗H1N1活性进行可视化。由实验结果可知,乙酸乙酯萃取部位有良好的抗H1N1活性且对MDCK细胞的毒性较低,因此将此部位认为是中药裸花紫珠的最佳活性部位。进一步对EACN的化学成分进行定性分析。

图1 磷酸奥司他韦体外抗H1N1活性
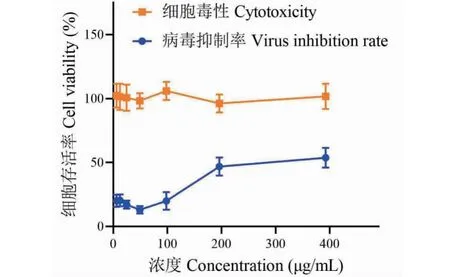
图2 正丁醇萃取物体外抗H1N1活性

图3 乙酸乙酯萃取物体外抗H1N1活性
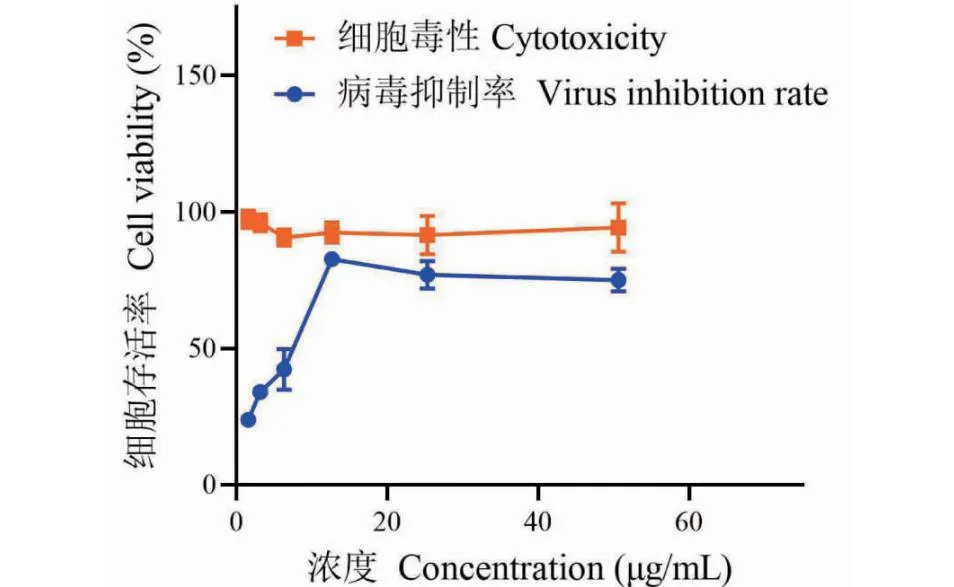
图4 石油醚萃取物体外抗H1N1活性
2.2 化学成分分析
采用UPLC-Q-Exactive-Orbitrap-MS技术对EACN化学成分进行表征。EACN在正负离子模式下的总离子流图(total ion chromatogram,TIC)见图5~8。共鉴定出34个化合物(见表1和图9),包括14个苯丙酸及其苷类,15个黄酮及其苷类,2个香豆素,2个三萜,1个苯乙醇苷类。通过与混合标准品的保留时间和裂解规律对比确定了表1中的化合物4、8、10、14、24、25、27、30、31、33分别是咖啡酸、异槲皮苷、木犀草苷、毛蕊花糖苷、槲皮素、木犀草素、柚皮素、金圣草(黄)素、异鼠李素和齐墩果酸。其余化合物是根据分子离子峰和其他碎片离子的特性以及裂解规律等,参考MassBank(https://massbank.eu/)、FooDB数据库(https://foodb.ca)和文献数据[2,16]进行初步的定性。

图5 EACN在负离子模式下的总离子流图

图6 EACN在正离子模式下的总离子流图

图7 混合对照品在负离子模式下的总离子流图
图8 混合对照品在正离子模式下的总离子流图

图9 EACN中化学成分的结构式
2.3 网络药理学分析
2.3.1 活性成分靶点预测
口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18经常被作为筛选药物活性成分的条件[21]。我们在筛选过程中发现如咖啡酸(OB=54.97%,DL=0.05)、阿魏酸(OB=39.56%,DL=0.06)和毛蕊花糖苷(OB=2.94%,DL=0.62)等化合物不符合上述筛选条件,但已有文献证明这些化合物能通过抑制病毒复制、抑制神经氨酸酶的活性、降低甲型流感引起的炎症反应等途径发挥抗甲型流感的作用[22-24]。因此本实验不将OB值和DL值作为筛选条件。共检索得到466个药物靶点和1 225个H1N1相关靶点。使用Venny2.1版平台将药物相关目标与疾病相关目标交叉得到67个共同靶点(见图10),这些交叉靶点对应除1-O-咖啡酰-(6-O-L-吡喃鼠李糖基)-吡喃葡萄糖苷、金圣草(黄)素-7-O-β-D-葡萄糖苷、柚皮芸香苷、parvifloroside B以外的29个成分。

图10 成分靶点与疾病靶点韦恩图
2.3.2 GO和KEGG富集分析
采用Metascape数据库对得到的67个靶点进行GO和KEGG富集分析,得到491个GO条目,包括生物学过程BP条目360个,细胞组分CC条目56个,分子功能MF条目75个,按照P值进行从小到大排序,各选取前十个条目进行可视化(见图11)。得到17个注释聚类的147个KEGG通路,删除明显与H1N1无关的抗癌通路、糖尿病通路等,按照P值从小到大排序,选前25个条目作为核心通路进行可视化(见图12)。结果表明GO条目中与治疗H1N1有关的生物学过程包括蛋白质磷酸化的正调控(GO:0001934),氧化应激反应(GO:0006979)等;有关的细胞组分包括囊泡腔(GO:0031983),分泌颗粒腔(GO:0034774);有关的分子功能包括激酶结合(GO:0019900),生长因子受体结合(GO:0070851)。

图11 GO富集分析

图12 KEGG富集分析
与H1N1相关的KEGG通路主要可以分为炎症、免疫调节,病毒三个模块,核心通路中,与炎症相关的通路包括IL-17信号通路(hsa04657),NF-κB信号通路(hsa04064)等;与免疫调节有关的通路包括T细胞受体信号通路(hsa04660),Th1和Th2细胞分化(hsa04658)等,与病毒相关的通路包括甲型流感病毒通路(hsa05164)等。提示EACN抗病毒是一个多途径的作用。
2.3.3 药物-成分-靶点-通路-疾病网络分析
为了阐明EACN治疗H1N1感染的潜在机制,我们利用Cytoscape v3.6.0软件构建了药物-成分-靶点-通路-疾病网络(见图13),三角形代表裸花紫珠,箭头代表基因符号,六边形代表成分,正方形代表通路,菱形代表H1N1。通过网络分析发现度值最高的靶点RELA(degree=32),NF-κB1(degree=31)都属于NF-κB家族,在炎症反应、免疫应答等过程都发挥了重要作用。有22个活性成分都与MMP2(degree=24)相连,但是在展示出的25个通路中,MMP2只存在于白细胞跨内皮迁移中,提示EACN抗H1N1的一个重要潜在机制可能是调节白细胞的跨膜迁移。有19个化合物通过11个靶点作用于甲型流感病毒通路。药物通过作用于PLG(对应Plasmin)和PRSS1(对应Trypsin)影响H1N1的M2通道影响病毒的脱壳过程,还可以通过PLG作用于神经氨酸酶途径影响病毒的释放过程。提示PLG和PRSS1可能是EACN直接作用于H1N1的关键靶点。

图13 药物-成分-靶点-通路-疾病网络
2.4 动物实验验证
KEGG富集分析结果显示,EACN能通过抑制病毒增殖作用、抗炎作用和免疫调节等多个途径发挥抗H1N1感染的作用。我们用H1N1感染BALB/c小鼠实验对预测结果进行了实验验证。
在感染H1N1后的第四天,Mod组小鼠体重急剧降低,并至第六天持续降低,而与Mod组相比,EACN-H、EACN-L和OP均能抑制小鼠体重的下降趋势(见图14)。我们检测了H1N1病毒感染小鼠肺组织中H1N1的相对表达水平,RT-PCR检测显示,Mod组小鼠肺病毒载量显著高于Con组(P<0.001)。OP、EACN-H和EACN-L能不同程度地降低H1N1在小鼠肺组织中的表达水平(见图15)。这些结果说明,EACN抑制了H1N1在小鼠肺组织的增殖。机体在清除病毒的过程中会对肺组织造成炎症损伤,肺部炎症浸润会引起小鼠肺指数增加(见图16),与Mod组相比,OP、EACN-H和EACN-L能显著降低小鼠的肺指数。病理切片结果显示(见图17),与Mod组相比,OP、EACN-H和EACN-L能减轻小鼠肺组织的炎症损伤。促炎细胞因子的过度表达增加了流感病毒的致病性,ELISA实验结果显示(见图18),Mod组小鼠血清中的炎症因子包括IL-1β、TNF-α、IFN-γ含量均显著高于Con组小鼠。与Mod组比较,EACN和OP治疗后小鼠血清中的IL-1β、TNF-α、IFN-γ含量均显著降低。我们认为EACN组炎症因子含量的减少有助于减轻感染H1N1小鼠的炎性损伤。

图14 小鼠体重变化
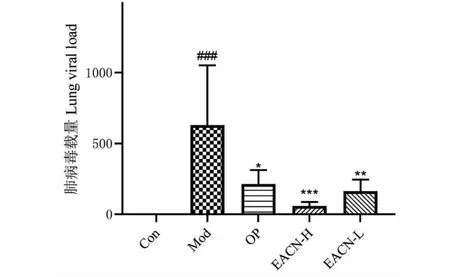
图15 H1N1感染小鼠肺组织病毒载量

图16 肺指数

图17 肺组织病理切片

图18 小鼠外周血血清中IFN-γ、IL-1β、TNF-α和IgG的水平
IgG主要存在于人体血清中,占血清中免疫蛋白总量的75%,机体在流感病毒刺激下产生的抗体主要以IgG为主[25]。因此我们还检测了小鼠血清中IgG的水平(见图18)。Mod组小鼠的血清水平低于Con组小鼠但是不具有显著性,而EACN-H组小鼠的血清IgG水平显著高于Mod组(P<0.1)。由此提示EACN对H1N1感染小鼠有一定的免疫调节作用。综上所述,我们初步证明了EACN能通过抑制病毒增殖作用、抗炎作用和免疫调节等多个途径发挥抗H1N1感染的作用。
3 讨论与结论
甲型流感病毒对现在常用的M2通道抑制剂和NA抑制剂都产生了不同程度的耐药性。因此,寻找新的抗甲型流感的药物或者治疗方法已经成为亟待解决的问题。中医药在甲型流感病毒的临床治疗中发挥了重要作用[26,27]。中医理论中的整体观念将病人作为一个有机整体进行系统地调控,而网络药理学通过构建药物-成分-靶点-通路-疾病网络,探索网络各节点生物功能与疾病的互作关系与中医的整体观具有一致性[28]。本实验首先筛选了中药裸花紫珠的主要抗H1N1的活性部位,并对该部位进行分析,鉴定得到34种化学成分。结合文献和数据库,得到药物与疾病的67个重叠靶点。通过交叉靶点的富集分析,我们推测EACN抗H1N1的重要生物过程可能是正向调节蛋白质磷酸化,对氧化应激的反应。KEGG富集分析结果发现,EACN中有19个化合物通过11个靶点作用于甲型流感病毒通路。药物通过作用于PLG和PRSS1影响H1N1的M2通道影响病毒的脱壳过程,还可以通过PLG作用于神经氨酸酶(NA)途径影响病毒的释放过程。提示PLG和PRSS1可能是EACN直接作用于H1N1的关键靶点,EACN能通过影响H1N1的脱壳过程和释放过程,抑制H1N1的增殖。在药物-成分-靶点-通路-疾病网络中,RELA和NF-κB1是度值最高的两个靶点,它们所在的NF-κB信号通路能促进IL-1β、TNF-α、IL-6等因子的表达而促进炎症反应,提示EACN可能能够作用于RELA和NF-κB1等关键靶点调节NF-κB信号通路等减轻炎症对机体的损伤。根据网络药理学预测的结果,EACN能调节T细胞信号通路,影响Th1和Th2分化等发挥免疫调节作用。因此本研究对EACN抑制H1N1增殖作用、抗炎作用和免疫调节作用进行动物实验验证。实验结果发现EACN能改善H1N1感染引起的体重的降低和肺指数的增加,降低小鼠肺组织的病毒载量,减轻小鼠肺组织的病理损伤,降低外周血血清中TNF-α、IFN-γ、IL-1β水平,增加血清抗体IgG的水平。本研究首先利用体外实验筛选出裸花紫珠抗H1N1的活性萃取部位,并利用UPLC-Q-Exactive-Orbitrap-MS和网络药理学对EACN抗H1N1的活性成分进行了预测,并对预测结果进行了动物实验验证,筛选出了EACN抗H1N1的潜在活性成分包括槲皮素、杨梅素、木犀草素、山柰酚、金圣草(黄)素、芹菜素和金合欢素等,初步证明了裸花紫珠能从直接抑制病毒、抗炎作用和免疫调节作用等多个途径发挥抗H1N1的作用。在后续的实验中,需要对筛选出的单体化合物进行体内外实验验证,在mRNA和蛋白水平上进一步研究EACN抗H1N1的作用机制。

