CARD蛋白家族在缺血性卒中中的研究进展
胡玉洁综述, 徐运审校
卒中是全球的第二大死因,也是导致长期残疾的主要原因。87%的卒中是缺血性卒中,每年全球约有80万人罹患缺血性卒中[1]。脑血流的突然中断导致细胞能量耗竭并迅速死亡,继发严重的炎症反应和组织损伤。缺血性卒中的病理生理机制涉及兴奋性毒性、氧化应激、炎症、细胞凋亡、免疫应答等过程。CARD是由约90个氨基酸组成的蛋白质,在细胞凋亡、炎症和先天细胞信号传导中起作用[2]。近年来,CARD蛋白家族已被广泛证明与缺血性卒中相关。CARD蛋白家族通过激活转录因子蛋白家族核因子κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等通路调节炎症和细胞凋亡,从而直接或间接地影响缺血性卒中的发展和预后。本文就CARD蛋白家族调控缺血性卒中进行归纳和分析,进一步阐述CARD蛋白的作用机制,为今后探究CARD蛋白在缺血性卒中中的临床转化提供潜在靶点和研究基础。
1 CARD家族概述
CARD家族属于死亡结构域超家族,以包含一个6个或7个反平行α螺旋束的结构为特征[3]。CARD能够通过同型相互作用和与含CARD结构域的蛋白相互作用促进大型寡聚信号复合物的组装。根据整体结构域的区别可以将CARD蛋白分为四个亚家族:(1)核苷酸结合域(nucleotide-binding domian,NBD)-CARDs:Apaf-1、NOD1、NOD2、CARD7、CARD12;(2)coiled-coil-CARDs:CARD9、CARD11(CARMA1)、CARD14(CARMA2)、CARD10(CARMA3);(3)bipartite-CARDs:RIPK2(CARD3)、Bcl10、CARDD、PYCARD/ASC、ARC、半胱天冬酶(Caspase)-1、Caspase-2、Caspase-4、Caspase-5、Caspase-9、CARD8;(4)CARD-only proteins(COPs):PSEUDO-ICE/CARD18、ICEBERG/CARD16[4]。近年来研究发现CARD与多种肿瘤、心血管疾病(高血压、心肌梗死、动脉粥样硬化)、自身免疫性疾病(强直性脊柱炎)、炎症性疾病(克罗恩病)、皮肤病(银屑病、特异性皮炎、真菌感染性疾病)相关,提示其在多种病理生理过程中具有重要作用[5-7]。
2 NBD-CARDs与缺血性卒中
2.1 Apaf-1 细胞凋亡激活因子-1(Apaf-1)是细胞应激或损伤的传感器,也是细胞凋亡线粒体通路中激活Caspase的关键分子[8]。在细胞凋亡期间,Apaf-1通过CARD-CARD相互作用促进Caspase-9活化,启动Caspase级联反应。Apaf-1在脑中动脉栓塞(middle cerebral artery occlusion,MCAO)小鼠中显著升高[9]。Apaf-1相互作用蛋白AIP是Caspase-9的新型短变体,包含CARD结构域,但缺乏Caspase-9所具有的催化结构域。小鼠体内过表达AIP可以有效抑制MCAO后的细胞凋亡,提示靶向Apaf-1-Caspase-9信号通路可能是一种可行的缺血性卒中的神经保护策略[10]。
2.2 NOD1、NOD2 先天免疫依赖于跨膜Toll样受体(Toll-like receptors,TLR)和核苷酸结合寡聚结构域样受体(NOD-like receptors,NLR)来诱导炎症反应。核酸结合寡聚结构域1(NOD1)是NLR家族的成员。NOD1在MCAO小鼠海马中显著上调,NOD1配体DAP显著增加MCAO小鼠自噬相关蛋白Beclin1、P62和LC3BII的表达,激活NF-κB通路,扩大梗死体积并加重神经功能缺损[11]。NOD2在体外氧糖剥夺的胶质细胞和神经元细胞中升高,通过NOD2/MAPK/NF-κB信号通路介导氧化应激和炎症[12]。研究表明,NOD2参与脑缺血再灌注损伤后的炎症反应,NOD2基因敲除能改善缺血性卒中的预后[13]。因此,NOD1/2是减轻缺血再灌注损伤的潜在靶点。
3 coiled-coil-CARDs 与缺血性卒中
3.1 CARD9 在多种细胞,特别是免疫细胞中表达,参与先天免疫和适应性免疫应答,与感染、炎症、肿瘤、心血管疾病和自身免疫性疾病相关。CARD9是Bcl-10和NF-κB、MAPK信号传导的上游激活剂,调节炎症反应和氧化应激[14]。在MCAO小鼠中,骨髓细胞上表达的TREM-1可以通过与SYK相互作用来激活下游促炎途径CARD9/NF-κB和NLRP3/Caspase-1[15]。CARD9在缺血性卒中的作用机制仍有待进一步研究。
3.2 CARMA CARD10、CARD11、CARD14都属于CARMA蛋白[16]。在一项基于机器学习的研究中,CARD11被鉴定为缺血性卒中的免疫相关遗传生物标志物[17]。
黏膜相关淋巴组织淋巴瘤易位蛋白1(mucosaassociated lymphoid tissue lymphoma translocation protein 1,MALT1),是一种参与NF-κB信号通路的多功能蛋白。MALT1在调节协调免疫反应的大量基因的表达中起关键作用。MALT1能够调节先天性自然杀伤细胞,树突状细胞和肥大细胞和适应性免疫细胞(T细胞和B细胞)中促炎基因的表达[18]。MALT1与Th1细胞、Th17细胞及其分泌的细胞因子呈正相关,也与急性缺血性卒中的疾病风险、严重程度和预后相关[19]。
4种coiled-coil-CARDs都可以与Bcl10和MALT1形成CBM(CARD-Bcl10-MALT1)复合物。CBM复合物是一种控制免疫和炎症通路的多蛋白信号平台,调节NF-κB、MAPK信号通路(A20、HOIL1、CYLD、RELB)和mRNA结合蛋白(regnase1、roquin1、roquin2)的降解,在免疫缺陷疾病、炎症性疾病和免疫系统癌症中发挥重要作用[16]。CBM复合物参与DNA损伤诱导的NF-κB活化,并阻止细胞凋亡[20]。研究发现,A20可以通过去泛素化RIPK3发挥抗坏死作用,然而在缺血性卒中的大鼠模型中MALT1通过增强A20的降解来促进大脑的坏死[21]。目前CARMA和CBM复合物在缺血性卒中中的研究较少,具体机制有待进一步研究。
4 bipartite-CARDs与缺血性卒中
4.1 RIPK2/CARD3 受体相互作用蛋白2(RIPK2/CARD3)是NOD2下游的信号衔接蛋白,增强IKKγ/NF-κB必需修饰物(NEMO)的泛素化。CARD3水平在小鼠大脑缺血再灌注损伤后的脑组织中以时间依赖性方式显著上调。敲除CARD3能减少梗死体积,改善神经病理学评分,减轻炎症反应和神经元凋亡;而神经元特异性的CARD3过表达扩大了脑梗死体积,加重了神经功能缺损并且增强缺血性卒中后的炎症反应。MAPKs家族成员,如JNK、ERK和p38在缺血性卒中后迅速被激活。值得注意的是,再灌注6 h后,磷酸化的JNK和p38在CARD3敲除小鼠中明显降低,但在神经元特异性CARD3过表达的小鼠中显著升高,两种情况中p-ERK都没有明显变化,这提示CARD3可能通过MAPK通路加重缺血再灌注损伤。转化生长因子β活化激酶1(TAK1)被广泛认为是3种传统MAPKs通路的共同调节因子,神经元特异性CARD3过表达小鼠MCAO后TAK1的激活显著增强,而在CARD3敲除小鼠中则降低。TAK1特异性抑制剂显著减少了神经元特异性CARD3过表达小鼠MCAO后的梗死体积,减轻了缺血相关的炎症和细胞凋亡[22]。CARD3不仅可以调节炎症还可以通过促进神经元凋亡诱导缺血再灌注损伤,提示靶向CARD3具有缓解缺血性卒中的潜力,能否开发一种跨血脑屏障的CARD3拮抗剂仍有待进一步研究。
4.2 PYCARD PYCARD是炎症小体的重要组成成分,包含N端Pyrin结构域(PYD)和C端CARD结构域。PYCARD与活化的NLRP3寡聚体中的PYD结构域结合,并通过PYD-PYD同源型结构域相互作用形成同源寡聚体纤维,进一步聚集形成PYCARD寡聚体和大的PYCARD斑点,招募并激活pro-Caspase-1,维持长时间的炎症小体激活[23]。PYCARD寡聚体可以被释放到细胞间隙,被邻近的炎性细胞吸收以维持持续的免疫反应。He等[24]研究发现,重组PYCARD激活NLRP3,诱导促炎反应,恶化了复发性缺血性卒中的结局。
4.3 CARD8 CARD8作为一种衔接分子,负调控Caspase-1依赖性IL-1β的产生,并抑制NF-κB的激活[25]。CARD8编码C10X变异体外显子5的无意义T30A多形现象(rs2043211)与中国人群大动脉粥样硬化卒中相关。Gu等[26]研究了中国人群中CARD8在大动脉粥样硬化卒中患者中的表达和rs2043211的影响。结果表明,rs2043211变异纯合子T/T与左心耳卒中风险显著增加相关,具有T/T基因型的高血压患者发生左心耳卒中的风险更高,风险等位基因T使CARD8表达增加,提示rs2043211可能是中国人大动脉粥样硬化性脑卒中的一种新型生物标志物。Bai等[27]研究发现,9p21位点上的非编码RNA ANRIL可能通过调节CARD8通路增加缺血性卒中的风险。CARD8在缺血性卒中发病机制中的作用仍有待进一步研究。
4.4 免疫信号适配器(Bcl10) Bcl10最初是在黏膜相关淋巴组织的B细胞淋巴瘤中发现的染色体易位t(1; 14)(p22; q32)附近的候选基因,是一种细胞内信号蛋白[28]。Bcl10收到刺激信号后形成细丝并聚集成介导和传递信号的高级簇,最终激活MALT1并传导NF-κB和JNK信号。Bcl10在大鼠皮质局灶性光栓4 h后的缺血半暗带区表达升高了60%[29]。在一项基于多加权基因共表达网络分析(WGCNA)和单细胞分析的研究中Bcl10被鉴定为缺血性卒中相关的关键基因[30]。Bcl10在缺血性卒中中的研究较少,具体作用机制有待进一步研究。
4.5 Caspase Caspase家族在程序性死亡和炎症中发挥重要作用,其中Caspase-1、Caspase-2、Caspase-4、Caspase-5、Caspase-9、Caspase-12包含CARD结构域。Caspase根据其功能分为凋亡型和炎症型。凋亡型Caspase可进一步分为启动型和效应型。Caspase-2、Caspase-9属于启动型,作为蛋白水解信号放大器激活效应型Caspase。Caspase-1、Caspase-4、Caspase-5、Caspase-12属于炎症型,激活细胞焦亡,触发DAMPs的激活和分泌以促进炎症[31]。
缺血性卒中后Caspase的表达受到严格的转录调控。在大鼠MCAO造模12 h后Caspase-2则维持相对稳定的水平[32]。Caspase-2基因敲除并不影响永久性局灶性缺血后的神经功能缺损和组织损伤,在小鼠短暂性和永久性动脉闭塞后pro-Caspase-2的量保持不变,表明Caspase-2不是脑缺血导致细胞死亡的重要效应物[33]。然而,研究发现在小鼠MCAO和小鼠脑神经瘤细胞系N2a的氧葡萄糖剥夺/复氧(oxygen and glucose deprivation/reoxygenation,OGD/R)模型中Caspase-2蛋白表达升高[34]。这可能与造模条件有关,也提示Caspase-2经历复杂的转录后调控。
Caspase-1被NLRP3/PYCARD激活后可以引发细胞焦亡。抑制Caspase-1可MCAO以通过抑制焦亡和晚期糖基化终产物受体(receptor for advanced glycation end products, RAGE)/MAPK通路显著改善大鼠缺血性卒中后血脑屏障的通透性和完整性[35]。
Caspase-4通过激活非规范的炎症小体、NLRP3炎症小体以及与TRAF6-IRAK1(tumor necrosis factor receptor-associated factor 6-IL-1R-associated kinase 1)复合物的相互作用,进而影响细胞焦亡、IL-1β的活化和分泌以及NF-κB炎症通路[36]。
在大鼠MCAO模型中,Caspase-9在再灌注1 h就已经被激活,神经元活化的Caspase-9激活Caspase-6介导缺血性卒中后12 h内的轴突丢失和24 h内的神经元死亡,在再灌注后4 h通过鼻内递送一种新型细胞膜穿透的高特异性Caspase-9抑制剂可以在缺血后3周持续提供神经保护作用[37]。研究发现多种中药复方和中草药提取物,如木香油方、大黄碱、冬凌草素,可以改善Caspase-9介导的缺血性卒中后的细胞凋亡[38-40]。
Caspase-12是内质网应激诱导的细胞凋亡的核心参与者。激活的Caspase-12从内质网易位到胞质,直接裂解Caspase-9,进而激活Caspase-3[41]。Mouw等[42]研究发现Caspase-12在MCAO后的纹状体和大脑皮质中显著升高。重组IL-17A还可以通过Caspase-12依赖性途径加剧缺血性卒中小鼠的神经元凋亡[43]。星形胶质细胞在氧糖剥夺(OGD)处理后出现细胞损伤和凋亡的增加,Caspase-12、裂解的Caspase-3、NLRP3炎症小体成分和IL-1β的蛋白水平也显著升高;使用Caspase-12特异性抑制剂ZATAD-FMK预处理可以保护星形胶质细胞免受OGD诱导的细胞死亡,并抑制NLRP3炎症小体的激活[41]。Caspase-12及其对NLRP3炎症小体激活的调节可能是治疗缺血性卒中的潜在靶点,具体调节机制有待进一步探索。
5 CARD-only proteins
COPs是Caspase-1和炎症小体NLR家族激活的调节因子[44]。CARD18与含有CARD的激酶RICK/RIP2/CARDIAK相互作用并激活NF-κB[45]。CARD16、CARD17和CARD18通过竞争性结合并取代Caspase-1蛋白之间的CARD相互作用,改善尿酸晶体介导的NLRP3炎症小体活化和炎症性疾病[46]。研究发现抑制ICE可以减少缺血性和兴奋性毒性神经元损伤[47]。ICE突变能够改善缺血诱导的脑损伤程度并保留神经功能[48]。COPs在缺血性卒中中的作用有待进一步研究。
6 其他CARD
CARD6是NF-κB活化的调节因子,通过协同RIPK家族调节NF-κB的活化[49]。在一项基于WGCNA和机器学习鉴定缺血性卒中患者外周血中的免疫相关关键基因的研究中,CARD6被认为是缺血性卒中相关的枢纽基因。CARD6与中性粒细胞、单核细胞和M0巨噬细胞呈正相关,与幼稚B细胞、活化的NK细胞、嗜酸性粒细胞和CD8 T细胞呈负相关[50]。
7 小结
CARD蛋白家族参与细胞炎症和凋亡,在缺血性卒中的病理过程中发挥重要作用,相关蛋白的突变也与缺血性卒中发病风险相关。目前有关CARD蛋白家族在脑缺血中的研究不断出现,为靶向相关通路的治疗提供基础。本文归纳CARD蛋白在缺血性脑损伤中的研究(见表1)。目前,CARD蛋白家族的研究主要关注MAPK和NF-κB等信号通路,我们希望能更进一步地研究CARD蛋白家族各个成员的功能和具体的调控机制,为临床转化发现新的策略和药物靶点提供可能性。
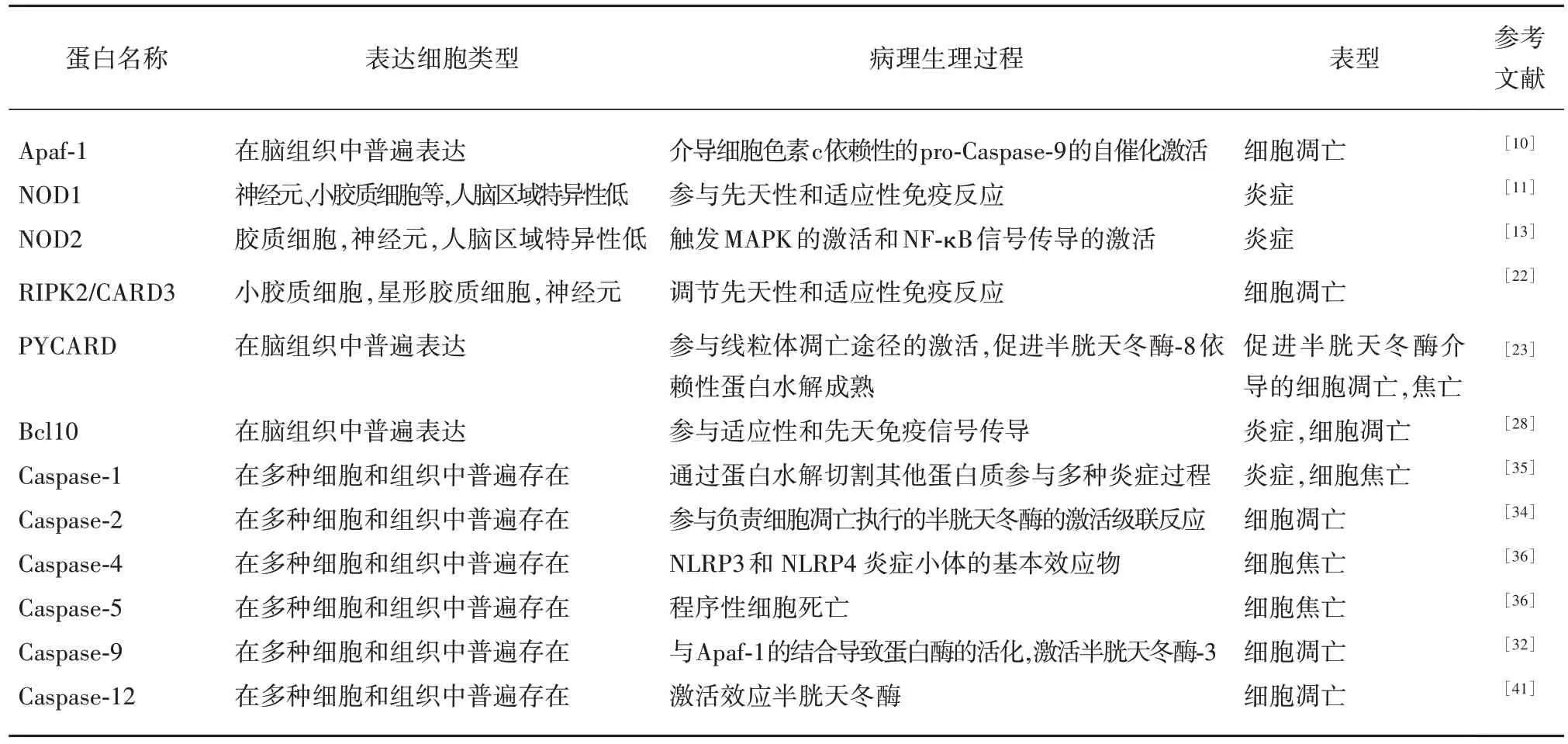
表1 CARD蛋白在缺血性脑损伤中的研究
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:胡玉洁负责文献收集、撰写论文,徐运负责拟定写作思路、指导撰写文章并最后定稿。

