基于AMPK/ULK1 介导的自噬探讨牡荆素对鼻咽癌CNE-2 细胞裸鼠移植瘤生长抑制作用及其机制
袁东杰,李艳峰,卢振民
新乡医学院第一附属医院 耳鼻咽喉科,河南 新乡 453100
鼻咽癌是临床上常见的头颈部恶行肿瘤,发病率为耳鼻咽喉恶性肿瘤之首,具很强的地域分布性,常发于我国南方地区[1]。目前,临床上关于鼻咽癌患者治疗主要通过同步放化疗方式,但是长期的放化疗容易造成患者复发和病灶转移[2]。因此,积极探寻鼻咽癌的发病机制及相关治疗靶点是目前迫切需要的。细胞自噬在肿瘤的发生发展、浸润转移及耐药性中发挥双重调控作用,被认为是肿瘤治疗潜在的重要机制[3]。多项研究证实,细胞自噬参与了鼻咽癌细胞的增殖、凋亡及转移[4-5]。激活细胞自噬能够抑制鼻咽癌细胞增殖,诱导细胞凋亡[6]。但也有部分研究证实,自噬对鼻咽癌细胞的增殖和生长具有显著的促进作用,通过激活细胞自噬能够抑制细胞凋亡,促进细胞增殖,提高鼻咽癌细胞的存活[7-8]。以上研究表明自噬在鼻咽癌中可能发挥“双刃剑”作用。因此,以细胞自噬为靶点的研究将对鼻咽癌新药的开发具有重大意义。
牡荆素是一种天然的生物活性黄酮类化合物,具有抗炎、抗氧化以及抗肿瘤等多种生物学活性,且对疾病的治疗效果较为显著,不良反应小、安全性较高等优势,被认为是一种极具开发潜力的活性天然化合物[9-10]。研究显示,牡荆素能够发挥抗结直肠癌[11]、肺癌[12]、肝癌[13]等作用。Wang 等[14]研究证实,牡荆素能够通过调控核因子-κB(NF-κB)通路诱导鼻咽癌细胞凋亡,抑制细胞生长,表明牡荆素可能是未来鼻咽癌潜在的治疗药物。腺苷酸活化蛋白激酶(AMPK)/UNC-51 样激酶1(ULK1)是介导细胞自噬形成的重要信号通路,参与鼻咽癌细胞自噬调节,进而抑制细胞增殖,促进细胞凋亡发生[15]。Zhang 等[16]研究证实,牡荆素能过够通过激活AMPK 信号通路介导的细胞自噬,改善氧化低密度脂蛋白介导的内皮损伤。此外,牡荆素能够通过激活AMPK/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路诱导细胞自噬水平升高,促进细胞凋亡,从而抑制肾细胞癌生长[17]。以上研究提示牡荆素很有可能通过调控AMPK/ULK1 介导的细胞自噬途径抑制鼻咽癌裸鼠移植瘤生长。为此,本研究拟通过对BALB/c 裸鼠左侧前肢腋窝下接种CNE-2 细胞构建鼻咽癌裸鼠成瘤模型,探究牡荆素对其移植瘤生长及AMPK/ULK1 介导的细胞自噬通路的影响,旨在阐明牡荆素抗鼻咽癌生长的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞和动物 人鼻咽癌细胞CNE-2 购自中国科学院上海细胞库;50 只SPF 级的BALB/c 裸鼠,雌雄各半,体质量18~20 g,周龄4~6 周,动物购自北京维通利华实验动物技术有限公司[生产许可证号SCXK(京)2021-0012]。动物饲养于新乡医学院实验动物中心,温度(25±1)℃,相对湿度60%~70%,昼夜12 h/12 h 交替光照,自由饮食,饮水,所有小鼠均适应性喂养1 周,且动物实验经过新乡医学院第一附属医院医学伦理委员会审准(批准号LLSC2021-11-002)。
1.1.2 试剂 牡荆素(质量分数>98%,成都植标化纯生物技术有限公司,批号20220312);AMPK激动剂AICAR、AMPK 抑制剂Compound C(美国Selleck 公司,货号S1802、S7306);苏木素–伊红(HE)染色试剂盒、TUNEL 染色检测试剂盒、蛋白质浓度测定试剂盒、ECL 发光液、山羊抗兔二抗、山羊抗小鼠二抗、β-肌动蛋白(β-actin)小鼠单克隆抗体、DAPI 染色液(上海碧云天生物技术公司,货号C0105S、C1091、P0011、P0018FS、A0409、A0413、AF5001、C1005);免疫组化检测试剂盒(北京中杉金桥生物技术有限公司,货号SP-9001);Bcl-2 相关X 蛋白(Bax)抗体、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)抗体、B 淋巴细胞瘤-2(Bcl-2)抗体、p-AMPK(Thr172)抗体、AMPK、p-ULK1(Ser317)抗体、ULK1 抗体、微管相关蛋白轻链3(LC3)-II抗体、泛素结合蛋白(p62)抗体(美国Cell Signaling Technology 公司,货号2772、9662、15071、50081、2532、37762、8054、2775、5114)。
1.1.3 仪器 Gel Doc XR+型凝胶成像系统(美国Bio-Rad 伯乐公司);CKX53 型荧光倒置显微镜(日本奥林巴斯);H3-18KR 型高速冷冻离心机(湖南可成仪器设备有限公司);LD-96A 型酶标仪(山东莱恩德智能科技有限公司)。
1.2 方法
1.2.1 鼻咽癌CNE-2 细胞裸鼠移植瘤模型构建[18]、分组及给药 取对数生长期的人鼻咽癌CNE-2 制备成单细胞悬液,调整细胞密度为1×106个/mL。将0.2 mL 细胞悬液sc 于裸鼠左侧前肢腋窝下,以皮下肿瘤组织隆起直径大于0.5 cm 视为模型构建成功。待裸小鼠移植瘤模型构建成功后将其随机分为模型组、牡荆素(5、10 mg/kg)组、AICAR(200 mg/kg)组、牡荆素(10 mg/kg)+Compound C(20 mg/kg)组,每组各10 只。牡荆素临用前使用生理盐水稀释至所需浓度。
牡荆素组裸鼠分别ig 5、10 mg/kg 牡荆素[19];AICAR 组裸鼠ip 200 mg/kg AICAR;牡荆素+Compound C 组裸鼠ig 10 mg/kg 牡荆素的同时ip 20 mg/kg Compound C[20];模型组裸鼠ig 等量的生理盐水,各组均给药1 次/d,连续给药21 d。给药后,次日将裸鼠颈椎脱臼处死,并剥离肿瘤组织进行相关实验检测。
1.2.2 移植瘤生长体积、质量及抑瘤率测定 各组裸鼠于造模成功后3、7、14、21 d,利用游标卡尺测量肿瘤体长径(a)和短径(b),并计算肿瘤体积。21 d 后各组裸鼠ip 戊巴比妥钠麻醉,行颈椎脱臼处死,剥离肿瘤体,称量质量(W),计算抑瘤率。
肿瘤体积=(a×b2)/2
抑瘤率=1-W给药/W模型
1.2.3 肿瘤组织病理学观察 将肿瘤体组织放于4%的多聚甲醛中固定24 h、梯度乙醇脱水、二甲苯透明、组织石蜡包埋、切片,行HE 染色、封片、复染,之后于显微镜下观察组织形态学变化。
1.2.4 TUNEL 染色检测肿瘤组织细胞凋亡 按照TUNEL 染色试剂盒进行染色,通过光学显微镜下观察并计数TUNEL 阳性细胞数。其中TUNEL 阳性细胞核呈棕黄色颗粒,即为凋亡细胞,每张切片随机选取6 个视野,计算TUNEL 阳性细胞率。
TUNEL 阳性细胞率=TUNEL 阳性细胞数/总细胞数
1.2.5 免疫组化检测肿瘤组织LC3-II、p62 蛋白表达 给药21 d 后,各组裸鼠ip 戊巴比妥钠麻醉,行颈椎脱臼处死,剥离瘤体组织经4%多聚甲醛固定,乙醇脱水,石蜡包埋、切片后采用内源性过氧化物酶阻断剂阻断、抗原修复、组织封闭后,滴加LC3-II 抗体、p62 抗体(1∶500),孵育过夜,对应二抗孵育2 h,滴加DAB 显色液,苏木素复染,于200 倍显微镜下观察肿瘤体组织LC3-II、p62 着色情况,并通过Image Pro-Plus 6.0 软件分析肿瘤体组织LC3-II 及p62 蛋白相对表达水平。
1.2.6 免疫荧光检测肿瘤组织LC3-II、Caspase-3 蛋白表达 将各组裸小鼠肿瘤组织切片放入PBS 缓冲液中清洗,经0.2% TritionX-100 透化5 min,PBS缓冲液清洗后10%的BSA 溶液封闭60 min,阻断非特异性反应,去除切片上残留的BSA 后,行双重免疫荧光染色,室温条件下分别孵育LC3-II 抗体(1∶200)和Caspase-3 抗体(1∶200)4 h,去除一抗后避光条件下孵育荧光素酶标记的山羊抗小鼠或山羊抗兔二抗2 h,PBS 缓冲液清洗后,DPAI 进行细胞核染色5 min,最后滴加抗荧光淬灭剂,避光条件下荧光显微镜下观察并拍照。LC3-II、Caspase-3 表达水平以平均荧光强度表示。
平均荧光强度=区域荧光强度总和/区域面积
1.2.7 Western blotting 检测AMPK/ULK1 通路及凋亡相关蛋白表达 末次给药结束后,立即将裸鼠处死,剥离肿瘤体并提取总蛋白,按照质量与体积比1∶5 加入细胞裂解液,于4 ℃条件下裂解40 min;BCA 法测定各组肿瘤组织蛋白质浓度;蛋白上样(按照每孔上样量30 μg 计算得出上样体积);凝胶电泳;湿转法转膜;5% BSA 室温封闭2 h;分别加p-AMPK 抗体(1∶500)、AMPK 抗体(1∶500)、p-ULK1 抗体(1∶500)、ULK1 抗体(1∶500)、Bax抗体(1∶1 000)、Bcl-2 抗体(1∶1 000)、Caspase-3(1∶500)、β-actin 抗体(1∶2 000),4 ℃条件下孵育16 h;37 ℃条件下二抗孵育60 min;去除二抗后TBST 洗膜15 min;滴加显影液后于Gel Doc XR+成像系统中显影拍照,并采用Image Pro Plus 6.0软件进行蛋白质条带灰度值半定量分析。
1.2.8 统计学分析 SPSS22.0 软件进行统计学数据处理。数据以表示,数据满足正态分布且方差齐性,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果
2.1 牡荆素对鼻咽癌裸鼠移植瘤生长的影响
给药后3 d,各组裸鼠移植瘤体积组间比较均无显著差异。给药后7、14、21 d,与模型组相比,牡荆素各剂量组、AICAR 组移植瘤体积均明显减小(P<0.05)。给药后7、14、21 d,与牡荆素10 mg/kg组相比,牡荆素+Compound C 组移植瘤体积显著增大(P<0.05)。
给药后21 d,与模型组相比,牡荆素各剂量组、AICAR 组移植瘤质量均显著降低(P<0.05)。与牡荆素10 mg/kg 组相比,牡荆素+Compound C 组移植瘤质量显著增加(P<0.05),各给药组肿瘤抑制率分别为24.86%、35.26%、25.92%、13.76%,见图1、表1。
表1 各组裸鼠鼻咽癌细胞移植瘤生长变化(,n=10)Table 1 Growth changes of transplanted nasopharyngeal carcinoma cells of nude mice in each group (,n=10)
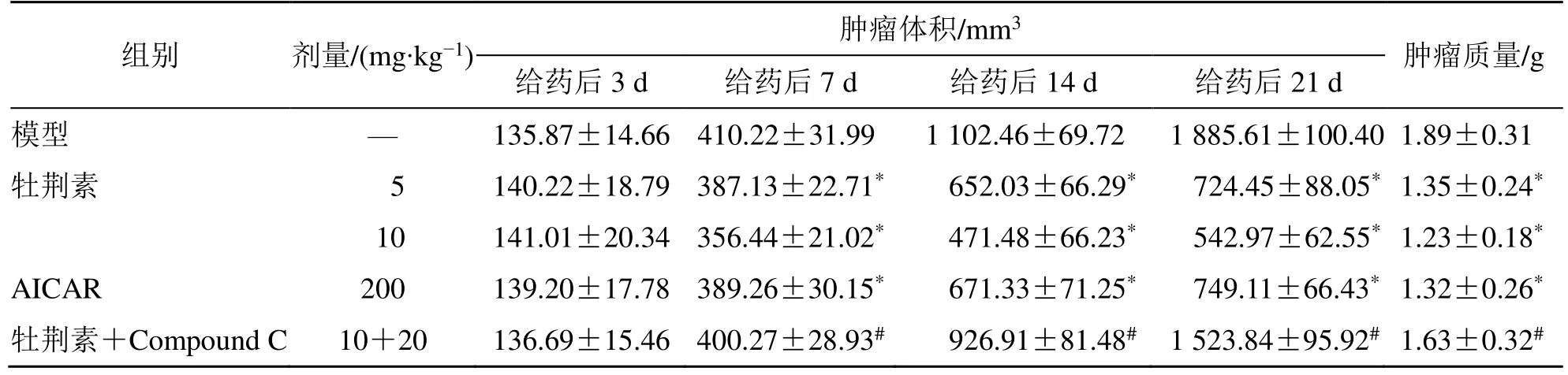
表1 各组裸鼠鼻咽癌细胞移植瘤生长变化(,n=10)Table 1 Growth changes of transplanted nasopharyngeal carcinoma cells of nude mice in each group (,n=10)
与模型组比较:*P<0.05;与牡荆素10 mg∙kg−1组比较:#P<0.05。*P <0.05 vs model group;#P <0.05 vs vitexin 10 mg∙kg−1 group.

图1 牡荆素裸鼠移植瘤生长的影响Fig.1 Effect of vitexin on the growth of transplanted tumors in nude mice
2.2 牡荆素对鼻咽癌裸鼠移植瘤病理学的影响
与模型组相比,牡荆素各剂量组、AICAR 组肿瘤细胞生长较差,可见肿瘤细胞排列疏松,部分细胞胞质减少,细胞核出现不同程度的固缩,细胞间出现淋巴细胞和中性粒细胞浸润。与牡荆素10 mg/kg 组相比,牡荆素+Compound C 肿瘤组织细胞生长状态良好,肿瘤细胞排列相对紧密,细胞间淋巴细胞和中性粒细胞浸润明显降低,见图2。
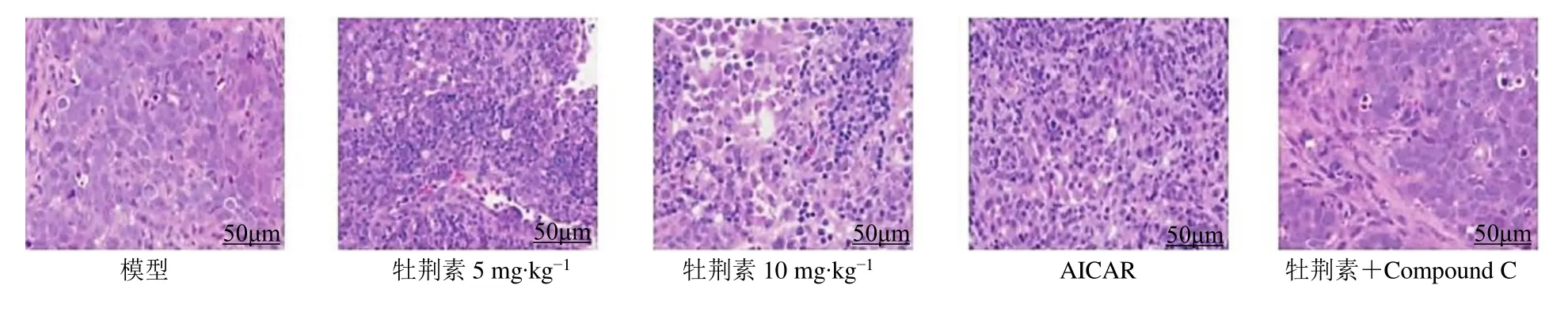
图2 各组裸鼠移植瘤组织病理学变化(HE,×400)Fig.2 Pathological changes of xenograft tissues in nude mice of each group (HE,× 400)
2.3 牡荆素对鼻咽癌裸鼠移植瘤细胞凋亡的影响
与模型组相比,牡荆素各剂量组、AICAR 组移植瘤中Caspase-3、Bax、Bcl-2 蛋白表达和细胞凋亡率均显著升高(P<0.05)。与牡荆素10 mg/kg 组相比,牡荆素高剂量+Compound C 组移植瘤中Caspase-3、Bax、Bcl-2 蛋白表达和细胞凋亡率均显著降低(P<0.05),见图3、4 和表2。
表2 各组鼻咽癌裸鼠移植瘤组织Bax/Bcl-2、Caspase-3 蛋白相对表达和细胞凋亡率比较(,n=10)Table 2 Comparison of Bax/Bcl-2,Caspase-3 protein relative expression and apoptosis rate in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)
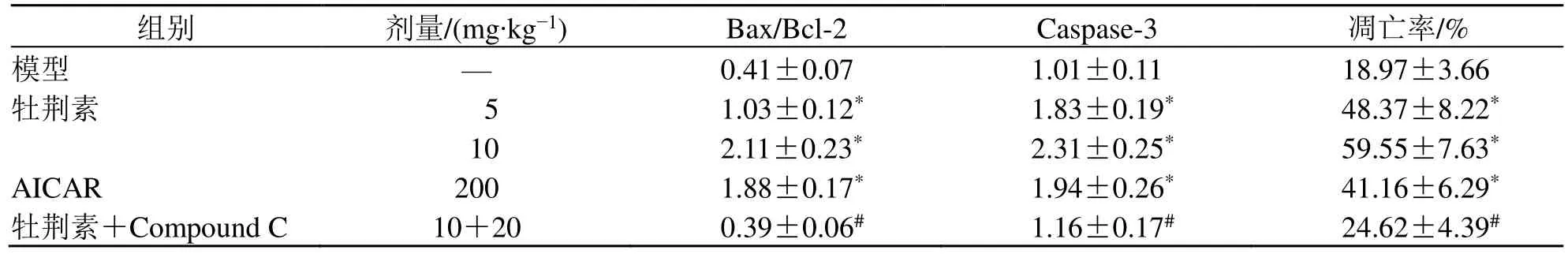
表2 各组鼻咽癌裸鼠移植瘤组织Bax/Bcl-2、Caspase-3 蛋白相对表达和细胞凋亡率比较(,n=10)Table 2 Comparison of Bax/Bcl-2,Caspase-3 protein relative expression and apoptosis rate in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)
与模型组比较:*P<0.05;与牡荆素10 mg∙kg−1组比较:#P<0.05。*P <0.05 vs model group;#P <0.05 vs vitexin 10 mg∙kg−1 group.
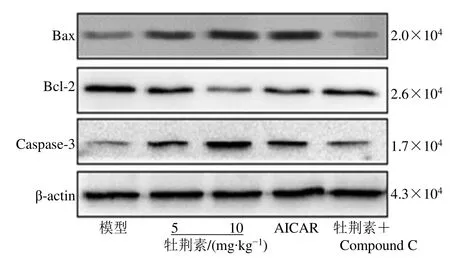
图3 各组裸鼠移植瘤组织中Bax、Bcl-2、Caspase-3 蛋白表达条带图Fig.3 Bands of Bax,Bcl-2,and Caspase-3 protein expression in xenograft tissues of nude mice in each group

图4 各组鼻咽癌裸鼠移植瘤组织细胞凋亡染色(TUNEL,×400)Fig.4 Apoptosis staining of nasopharyngeal carcinoma xenograft tissues in nude mice of each group (TUNEL,×400)
2.4 牡荆素对鼻咽癌裸鼠移植瘤细胞自噬的影响
与模型组相比,牡荆素各剂量组和AICAR 组移植瘤组织中细胞自噬相关蛋白LC3-II 表达显著升高,p62 表达显著降低(P<0.05)。与牡荆素10 mg/kg 组相比,牡荆素+Compound C 组裸鼠肿瘤组织LC3-II 表达显著降低,p62 表达显著升高(P<0.05),见图5、表3。
表3 各组鼻咽癌裸鼠移植瘤组织中LC3-II、p62 蛋白相对表达比较(,n=10)Table 3 Comparison of LC3-II and p62 protein relative expression in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)
表3 各组鼻咽癌裸鼠移植瘤组织中LC3-II、p62 蛋白相对表达比较(,n=10)Table 3 Comparison of LC3-II and p62 protein relative expression in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)
与模型组比较:*P<0.05;与牡荆素10 mg∙kg−1组比较:#P<0.05。*P <0.05 vs model group;#P <0.05 vs vitexin 10 mg∙kg−1 group.
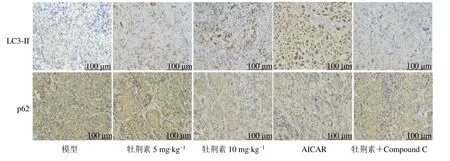
图5 各组鼻咽癌裸鼠移植瘤组织中LC3-II、p62 表达(IHC,×200)Fig.5 Expression of LC3-II and p62 in nude mice xenograft tissues nasopharyngeal carcinoma tissues in each group (IHC,×200)
2.5 牡荆素对鼻咽癌裸鼠移植瘤组织LC3-II 和Caspase-3 荧光表达的影响
免疫荧光检测显示,与模型组相比,牡荆素各剂量组和 AICAR 组移植瘤组织中 LC3-II 和Caspase-3 蛋白表达明显升高(P<0.05)。与牡荆素10 mg/kg 组相比,牡荆素+Compound C 组能够抑制牡荆素对LC3-II 和Caspase-3 的表达,见图6、表4。
表4 各组鼻咽癌裸鼠移植瘤组织中LC3-II、Caspase-3 平均荧光强度表达比较(,n=10)Table 4 Comparison of LC3-II and Caspase-3 mean fluorescence intensity expression in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)

表4 各组鼻咽癌裸鼠移植瘤组织中LC3-II、Caspase-3 平均荧光强度表达比较(,n=10)Table 4 Comparison of LC3-II and Caspase-3 mean fluorescence intensity expression in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)
与模型组比较:*P<0.05;与牡荆素10 mg∙kg−1组比较:#P<0.05。*P <0.05 vs model group;#P <0.05 vs vitexin 10 mg∙kg−1 group.
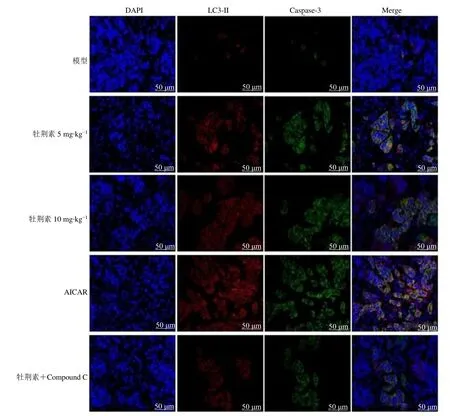
图6 各组鼻咽癌裸鼠移植瘤组织中LC3-II、Caspase-3 平均荧光强度表达(IF,×400)Fig.6 Mean fluorescence intensity expression of LC3-II and Caspase-3 in nude mice xenograft tissues nasopharyngeal carcinoma tissues in each group (IF,×400)
2.6 牡荆素对鼻咽癌裸鼠移植瘤组织 AMPK/ULK1 信号通路的影响
与模型组相比,牡荆素各剂量组、AICAR 组移植瘤组织中p-AMPK/AMPK、p-ULK1/ULK1 均显著升高(P<0.05)。与牡荆素10 mg/kg 组相比,牡荆素+Compound C 组移植瘤组织中 p-AMPK/AMPK、p-ULK1/ULK1 比值均显著降低(P<0.05),见图7、表5。
表5 各组鼻咽癌裸鼠移植瘤组织p-AMPK/AMPK、p-ULK1/ULK1 水平比较(,n=10)Table 5 Comparison of p-AMPK/AMPK,p-ULK1/ULK1 levels in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)

表5 各组鼻咽癌裸鼠移植瘤组织p-AMPK/AMPK、p-ULK1/ULK1 水平比较(,n=10)Table 5 Comparison of p-AMPK/AMPK,p-ULK1/ULK1 levels in nasopharyngeal carcinoma xenograft tissues of nude mice in each group (,n=10)
与模型组比较:*P<0.05;与牡荆素10 mg∙kg−1组比较:#P<0.05。*P <0.05 vs model group;#P <0.05 vs vitexin 10 mg∙kg−1 group.
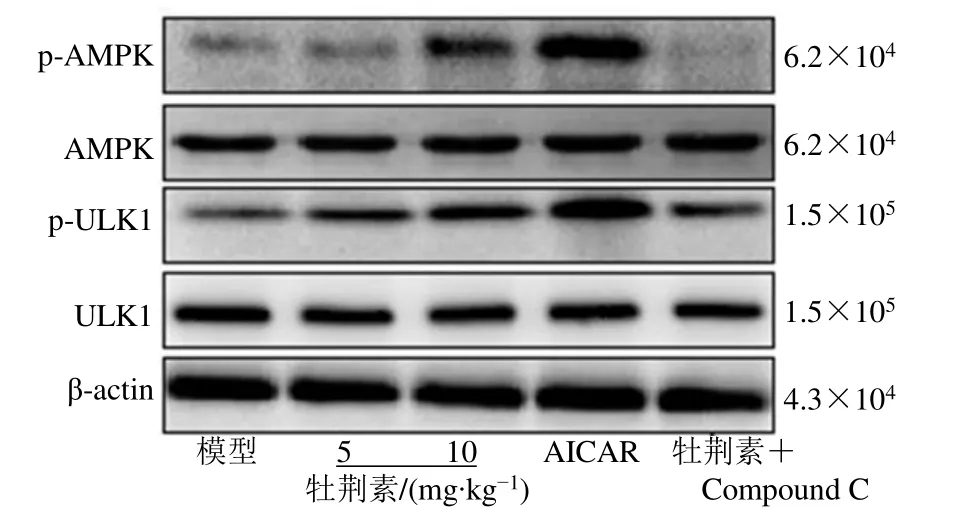
图7 各组裸鼠移植瘤组织中AMPK/ULK1 通路相关蛋白表达条带图Fig.7 Expression bands of AMPK/ULK1 pathway related proteins in xenograft tissues of nude mice in each group
3 讨论
鼻咽癌来源鼻黏膜上皮,是常见的头颈部恶性肿瘤之一,具有明显的地域差异,同步方化疗被认为是临床上治疗局部晚期鼻咽癌的主要手段。临床研究发现,长期的化疗药物治疗鼻咽癌具有不良反应大,敏感性差等缺点,常常导致鼻咽癌患者的治疗效果不佳[8]。近年来,中医药在肿瘤的治疗中显现明显的优势和特色,能够有效改善患者治疗的有效率,提高患者的生活质量。多项研究表明,中药可以通过多靶点、多途径抑制鼻咽癌细胞增殖,促进细胞凋亡[21-22]。牡荆素是一种生物活性黄酮类化合物,多存在于山里红叶、山楂干燥成熟果实或山楂叶中,具有显著抗炎、抗氧化及抗肿瘤等生物学功能,其中在抗肿瘤生物学作用中对于牡荆素的研究主要局限于肝癌、肺癌、结直肠癌等[9],是否对其他类型的癌症具有同样的治疗作用尚不清楚。此外,既往多数关于牡荆素抗肿瘤的研究仅停留在细胞水平,体内实验的研究相对缺乏[9]。为此,本研究首先通过构建鼻咽癌CNE-2 细胞裸鼠移植瘤模型,观察牡荆素对肿瘤生长的影响。结果显示,与模型组相比,牡荆素各剂量组肿瘤体积明显减小,肿瘤质量明显减轻,且肿瘤细胞生长较差,可见肿瘤细胞排列疏松,部分细胞胞质减少,细胞核出现不同程度的固缩,细胞见出现淋巴细胞和中性粒细胞浸润,细胞凋亡率和 Caspase-3 蛋白表达和Bax/Bcl-2 均显著升高,表明牡荆素具有抑制鼻咽癌裸鼠移植瘤生长的作用。
细胞自噬是一种程序化的细胞内的降解机制,通过清除受损的细胞器、非功能性蛋白质以及病原微生物等并递送至溶酶体中消化降解,并将回收营养物质供细胞和组织再利用[23]。已有多项研究证实自噬与多种恶性肿瘤的发生、发展、侵袭和转移密切相关,且自噬对肿瘤细胞的生长具有促进和抑制的双重作用[24-25]。Wang 等[26]研究发现,CNE-2 细胞在放疗中诱发的自噬可以明显提高细胞的存活率,从而发挥对CNE-2 细胞保护效应,而抑制自噬水平能够显著增加CNE-2 细胞放疗的敏感性,降低细胞的存活率。Chow 等[27]研究显示,次黄芩素能够诱导鼻咽癌细胞自噬和凋亡,激活自噬能够通过抑制mTOR 通路抑制鼻咽癌细胞凋亡。Xu 等[28]研究发现,茶黄素能够通过诱导细胞自噬促进鼻咽癌细胞凋亡。以上研究关于自噬对鼻咽癌发挥相反的作用效果可能与治疗药物不同有关。LC3、p62 是自噬发生过程中的重要调控蛋白,是反映自噬水平高低的标志性蛋白。本研究结果显示,与模型组相比,牡荆素组裸鼠肿瘤组织中LC3-II 表达明显升高,p62 表达明显降低,表明牡荆素能过够通过诱导细胞自噬和凋亡,从而抑制鼻咽癌肿瘤生长。AMPK/ULK1 信号通路已被证实可同时对细胞凋亡和自噬产生调节作用,进而发挥抗肿瘤效果[29]。当细胞受到氧化应激、缺氧刺激后,AMPK 通过磷酸化被显著激活,从而抑制mTOR 磷酸化,促进ULK1 Ser317位点磷酸化,激活细胞自噬[30]。Xie 等[15]研究显示,在鼻咽癌细胞中AMPK/ULK1 通路及自噬相关蛋白表达降低,激活AMPK/ULK1 通路能够诱导细胞自噬,抑制鼻咽癌细胞增殖,促进细胞凋亡。本研究结果显示,与模型组相比,牡荆素各剂量组p-AMPK/AMPK、p-ULK1/ULK1 水平明显升高。Min等[31]研究发现,硼替佐米能够通过调控AMPK/ULK1 介导的细胞自噬,诱导胰腺癌和结直肠癌癌细胞凋亡和细胞毒性,但是此作用效果能够被AMPK 抑制剂Compound C 所取消。为进一步明确AMPK/ULK1 介导的细胞自噬在牡荆素诱导鼻咽癌细胞凋亡中的作用。本研究通过对模型裸鼠ip AMPK 激动剂/抑制剂后观察肿瘤体生长变化。本研究结果显示,与模型组相比,AICAR 能够促进AMPK/ULK1 通路活化,上调LC3-II,下调p62 表达,促进细胞自噬,诱导肿瘤细胞凋亡,并最终抑制肿瘤体生长,从而发挥与牡荆素相同的保护作用。与牡荆素高剂量组相比,AMPK 抑制剂Compound C 处理后能够逆转牡荆素对鼻咽癌裸鼠移植瘤的抑制作用。
综上所述,牡荆素能够通过激活AMPK/ULK1通路介导的自噬,促进肿瘤细胞凋亡,进而抑制鼻咽癌CNE-2 细胞裸鼠移植瘤生长。
利益冲突所有作者均声明不存在利益冲突

