短链脂肪酸盐对小鼠腹腔巨噬细胞的抗炎功能研究
刘鹏,姚梦,李志恒,潘万龙
(1.川北医学院基础医学与法医学院;2.南充市中心医院检验科,四川 南充 637000)
短链脂肪酸盐(short-chain fatty acid salt,SCFAs)为主要由结肠内有益菌群酵解糖类形成挥发性酸的盐形态,包括乙酸钠、丙酸钠(natrium propionicum,NaP)和丁酸钠(natrium butyrate,NaB)等。短链脂肪酸盐具有维持肠道营养与稳态、调节糖脂代谢与宿主免疫反应等多重生理功能[1]。SCFAs通过激活G蛋白偶联受体(G-protein-coupled receptor,GPR)和抑制组蛋白脱乙酰化酶(histone deacetylase,HDAC),保护肠道免受致病菌的感染和炎症的侵袭[2]。丁酸盐可通过降低NADPH氧化酶相关的氧化应激而减轻动脉粥样硬化的发展[3]。此外,SCFAs在脓毒血症、溃疡性结肠炎与纤维肌痛等疾病中通过抑制NF-κB的活化,减少炎症介质的释放而减轻炎症反应[4-6]。因此,SCFAs可作为一种抗炎剂在多种炎症性疾病中发挥抗炎作用。
在沙门菌的感染免疫中,巨噬细胞(macrophage,MΦ)是发挥抗沙门菌感染的主要因素。鼠伤寒沙门菌(salmonellatyphimurium,STM)作为胞内寄生菌被MΦ吞噬后可分泌多种分子抵抗MΦ的杀伤作用,而MΦ作为STM的主要宿主细胞,活化后产生的炎性细胞因子(IL-6、TNF-α)在清除细菌方面发挥重要作用,MΦ活性降低也可能使STM杀灭不彻底而造成慢性菌血症或肠热症复发。因此其活化与吞噬杀菌功能的强弱将直接影响到疾病的发生与发展。目前已有研究[7]表明,SCFAs可在一定程度上诱导MΦ凋亡,减轻来源于肺泡巨噬细胞系NR8383的炎症反应。但关于SCFAs能否通过降低MΦ的活性,减轻炎症介质释放,从而影响其吞噬与杀菌功能的研究较少。本研究拟用NaP与NaB干预经LPS刺激的小鼠腹腔巨噬细胞,通过Griess法与荧光探针检测细胞内外NO的含量,ELISA法检测炎性细胞因子IL-1β、IL-6与TNF-α,评价NaP与NaB对MΦ的抗炎作用;使用NaP与NaB干预巨噬细胞杀灭STM的过程,分别在不同时间点检测细菌存活数,评价SCFAs对杀菌功能的影响。
1 材料与方法
1.1 材料
清洁级昆明小鼠(6~8周龄,体重20~22 g)由川北医学动物中心培育。NaP、NaB与细胞因子检测试剂盒购至上海生工生物,CCK-8、LPS、NO荧光探针购至碧云天公司,Griess试剂购至上海酶联生物,STM购至北京万佳首化,RPMI 1640、胎牛血清与双抗购至美国Gibco公司。
1.2 方法
1.2.1 小鼠腹腔巨噬细胞的制备 使用含10%牛肉浸膏的肉汤1.5 mL腹腔注射昆明小鼠,3~4 d后脱颈处死小鼠,腹腔注射4 mL PBS。轻柔腹部后,用灭菌的吸管吸取腹腔液体,2 000 r/min离心10 min。PBS洗涤后用含10% FBS与双抗的PRMI1640培养基重悬细胞,计数并调整细胞浓度为1×107/L,以0.5 mL量接种于24孔板。37 ℃、5% CO2培养1 h后用预温的培养液轻柔洗涤两次,继续培养6 h后,200×镜下观察细胞形态。计数100个细胞,计算巨噬细胞所占百分比。
1.2.2 SCFAs对巨噬细胞代谢活性的影响 设置空白组、NaB组(0.02%、0.04%)、NaP组(0.04%、0.08%)、LPS组(50 μg/mL)、NaB+LPS组与NaP+LPS组(浓度同上)。按照分组,制备含上述试剂的PRMI1640培养液并重悬MΦ。每组100μL量接种3复孔(细胞约104个/孔),培养12 h后加入10 μL CCK-8继续培养1 h。酶标仪检测OD 462 nm值,减去空白孔的吸光度值后,计算实验组细胞的相对代谢活性。
1.2.3 SCFAs对LPS刺激的巨噬细胞产NO的影响 设置对照组(LPS 50 μg/mL)、NaB组(0.02%NaB+LPS、0.04%NaB+LPS)、NaP组(0.04%NaP+LPS、0.08%NaP+LPS)。使用含上述浓度SCFAs与LPS的PRMI1640重悬MΦ,每孔0.5mL量加入24孔板中,每组各3个复孔。37 ℃、5%CO2培养12 h后分离上清备用。向每孔加入1∶1 000稀释后的NO荧光探针100 μL,37 ℃、5%CO2处理20 min后,荧光显微镜下参照FITC的参数设置进行观察。取保存的各组上清液100 μL,分别加入50 μL Griess试剂A与试剂B,静止15 min后检测OD 550 nm值。按照试剂盒提供的公式计算各组的NO量。
1.2.4 SCFAs对LPS刺激巨噬细胞产细胞因子的影响 将1.2.3收集的上清液分别进行4倍、20倍稀释后,分别经加样或标准品孵育90 min,生物素标记TNF-α、IL-1β与IL-6抗体孵育60 min,HRP-链霉素孵育30 min,显色剂15 min后终止反应,酶标仪测定450 nm吸光度值并通过标准曲线计算每孔细胞因子浓度。
1.2.5 SCFAs对巨噬细胞杀伤STM的影响 设置对照、0.02%NaB、0.04%NaB、0.04%NaP与0.08%NaP共5个组。将MΦ按照1∶10吞噬比加入到用PRMI1640制备的STM菌液中。混匀后以100 μL量接种96孔板,培养40 min后,用预热的PBS洗涤3次。加入含相应浓度NaP与NaB的PRMI1640后继续培养,并分别在0、5、10 h弃上清,每孔加入200 μL灭菌水,37 ℃处理30 min后吹打混匀,经10倍稀释后平板接种计数。另重复上述操作,收集培养10 h后的细胞与上清。细胞经瑞士染色后观察胞浆内是否有完整结构的细菌,上清液使用Griess试剂检测各组NO量。
1.3 统计学分析

2 结果
2.1 小鼠腹腔巨噬细胞的分离
经1.5 mL肉汤诱导小鼠腹腔无菌性炎症后,每只分离获得腹腔细胞约3~7×106个。经培养后MΦ呈现典型形态:长梭形,有明显伪足,部分MΦ为大圆细胞形态;计数100个细胞后计算巨噬细胞百分比>80%,所得巨噬细胞纯度较高。见图1。
2.2 SCFAs对巨噬细胞形态与代谢活性的影响
光镜下观察空白组典型的巨噬细胞形态较收拢,伪足长度较实验组短,NaB、NaP干预后的MΦ有较长的伪足,经Image J图像分析空白组典型细胞长度约为NaB与NaP组的3/4。见图1。CCK-8法检测细胞相对活性,与空白组相比,不同浓度的SCFAs干预巨噬细胞后,其相对代谢活性均降低(P<0.05)。经LPS刺激后各组细胞代谢活性均增高。(P<0.05)。

表1 SCFAs干预经LPS刺激与未受LPS刺激的MΦ12 h后细胞相对活性

2.3 SCFAs对LPS刺激巨噬细胞产NO的影响
NaB/NaP与LPS共刺激12 h后的MΦ经DAF-FM DA荧光探针染色后,可见各处理组细胞内的荧光信号较LPS对照组有一定程度的降低;经Griess试剂检测发现LPS对照组、0.02%NaB组、0.04%NaB组、0.04%NaP组与0.08%NaP组上清液中NO量分别为:39.33±0.93 μmol/L、36.17±0.18 μmol/L、28.28±0.14 μmol/L、31.85±0.15 μmol/L、17.59±0.19 μmol/L。各组与LPS组比较NO均降低(P<0.05)。见图2。

2.4 SCFAs对LPS刺激巨噬细胞产炎性细胞因子TNF-α、IL-6与IL-1β的影响
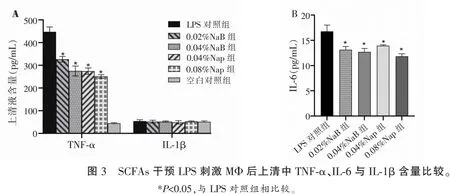
采用ELISA法检测不同浓度NaB、NaP与LPS共处理的MΦ上清中的TNF-α、IL-6与IL-1β,结果发现,LPS对照组的MΦ产TNF-α、IL-6明显增高,不同浓度NaP、NaB组的TNF-α、IL-6水平较LPS对照组均降低(P<0.05)。各实验组IL-1β的水平与LPS对照组无统计学差异(P>0.05)。见图3。
2.5 SCFAs对巨噬细胞杀伤STM的影响
MΦ吞噬STM后加入相应浓度SCFAs干预0、5与10 h,经瑞士染色观察MΦ吞噬STM 10 h后的胞浆内仍有完整结构的细菌。平板计数法检测各组MΦ内细菌存活数,发现0 h各组细菌数无统计学差异,(P>0.05)5 h与10 h后各组细菌数量均较0 h降低。与LPS对照组相比,5 h时不同浓度SCFAs处理后的MΦ内活菌数均增高(P<0.01)。10 h时0.04%NaB与0.08%NaP组MΦ内活菌数均增高(P<0.05)。各干预组MΦ吞噬STM 10 h上清液中NO量较LPS对照组均降低(P<0.05)。且SCFAs浓度越高,NO量减少的越明显。见图4。

3 讨论
绝大多数短链脂肪酸被吸收后是以离子形式存在[8]。SCFAs被肠道吸收后除可直接做为能量物质给肠道上皮细胞提供能量外,还可经门静脉系统被转移至肝脏参与机体的能量代谢[9-10],如乙酸可做为胆固醇、脂肪酸的合成底物,丙酸盐参与糖异生。进入血液循环系统的SCFAs还能发挥更广泛的作用,例如可通过促进免疫细胞的分化与成熟而增强机体免疫能力;通过肠-脑轴进入中枢神经系统的SCFAs可影响神经心理性疾病的发生与发展[11]。因此,SCFAs对宿主代谢和免疫系统等有多种有益作用[12]。
最近研究[13-15]发现,NaP与NaB可通过与细胞膜上GPR结合后,负向调节HDAC的水平,从而对炎症信号通路如NF-κB、MAPK等信号通路产生负向调节,其表现出的抗炎作用预示其在临床治疗与疾病预防方面的潜力。STM做为一种人畜共患病的病原体,经肠道M细胞提呈给MΦ后可分泌多种分子抵抗MΦ的杀伤作用,本研究中,在巨噬细胞吞噬STM 10h后仍有一定数量的细菌存活。MΦ作为STM的主要宿主细胞,其活化与吞噬杀菌功能的强弱将直接影响到疾病的发生与发展[16]。研究[17]发现,短链脂肪酸可促进CD4+T细胞和ILCs产生IL-22,从而使肠道抗感染与炎症的能力增强。STM既可产生肠毒素引起食物中毒,也可因内毒素入血引起免疫低下者严重的败血症。内毒素又称LPS,是G-细菌细胞壁外膜的特殊结构。大量内毒素入血可引起包括MΦ在内的大量炎症细胞活化与炎性细胞因子的产生,因此减少由内毒素引起的MΦ等炎性细胞的活化、调节促炎性细胞因子的分泌是对抗G-细菌感染的措施之一[18]。
本研究采用传统的小鼠腹腔巨噬细胞分离方法,所获得的原代巨噬细胞经培养后可见形态多样,具有明显伪足的典型细胞形态,且纯度较高。相较于常用的炎症模型RAM264.7肿瘤细胞[19],生物学形状与原体内细胞相似,可保证实验体内外的一致性。分别使用NaP与NaB单独干预巨噬细胞12 h后,细胞相对代谢活性降低,且NaB表现出更明显的抑制细胞代谢活性的能力。这与刘婷婷等[20]研究一致。但在LPS刺激下,NaB与NaP未表现出明显地抑制巨噬细胞代谢活性的能力,表明两者减轻由LPS诱导巨噬细胞的炎症反应并非是由其抑制巨噬细胞代谢活性而引起。LPS作为强有力的免疫刺激物,能诱导巨噬细胞向M1型极化,促进细胞表面特征性分子、NO与炎性细胞因子的表达[21]。M1型巨噬细胞在感染性疾病的早期发挥重要作用,在早期炎症部位富集,并被LPS,TNF-ɑ与IFN-γ等促炎因子激活,随后通过分泌多种炎症因子的方式促进炎症的发生发展[22]。在本实验中将NaP、NaB与LPS共同处理巨噬细胞后,上清液的NO、IL-6与TNF-ɑ的表达量均较LPS组降低(P<0.05),表明SCFAs可在一定程度上减少炎症介质的释放,减弱巨噬细胞向M1型极化而起到抗炎作用。
Kurtz等[23]报道,巨噬细胞分泌炎性因子如TNF-α、IL-6的能力减弱,导致体内小鼠攻毒STM后,其肝、脾和肠系膜淋巴结等免疫组织中的细菌载量有明显的增加,与本研究中的体外实验结果一致。SCFA对免疫系统可通过促进B细胞发育、Treg的分化与扩增、促进IL-22的产生等方式调节粘膜免疫,从而提高肠道的免疫屏障功能的作用[2],说明在体内感染STM后,短链脂肪酸盐调节免疫功能的机制更加复杂。
综上,丙酸钠与丁酸钠能降低由LPS诱导的小鼠腹腔巨噬细胞炎症反应,增加鼠伤寒沙门菌在巨噬细胞内的存活机率,机制有待进一步探讨。

