内质网磷酸化修饰与肺结核感染后免疫反应的相关性研究
陈 程, 邓 永, 鲁学明, 李榜龙, 李小玉
(湖南省长沙市第一医院, 湖南 长沙 410005)
结核分枝杆菌通过结核病患者呼出的气溶胶传播,并被密切接触者吸入。免疫监测保护了绝大多数受感染的个体,只有少数结核分枝杆菌感染的个体发展为结核病。T细胞对于抵御结核分枝杆菌至关重要,尤其是TH1免疫受损与结核病发病风险增加相关[1]。由结核分枝杆菌特异性T细胞产生的关键TH1细胞因子IFN-γ是检测结核分枝杆菌感染的公认标志。然而,对结核分枝杆菌感染的健康供体的T细胞的IFN-γ表达进行定量,既不足以预测发展为结核病的风险,也不能作为指示急性疾病的可靠生物标志物。近年来,已经发现了其他候选生物标志物,这些生物标志物可能指示疾病机制和T细胞未能更充分地预防结核病,如白细胞介素6(leukin-6,IL-6)[2]。几项研究报告了T细胞更高的IL-6表达与结核病患者更高的IL-6血清浓度相关[3-4]。最近研究发现,内质网(Endoplasmic reticulum,ER)应激和下游标记物(PERK、eIF2α、IRE-1α、ATF6、ATF4、XBP-1s、GRP78、CHOP和p-JNK)的水平增加介导T细胞免疫功能失调,并促进IL-6等细胞因子释放[5]。ER应激是多种应激物在细胞中诱导的结果,包括ER腔中错误折叠蛋白的积累、营养剥夺、缺氧、治疗剂和炎症因子[6]。在ER应激过程中,磷酸化的蛋白激酶样内质网激酶(Pancreatic ER kinase-like ER kinase,PERK)与其负性调节因子分离,并磷酸化几个靶标,包括翻译起始因子2α,它触发激活转录因子4的表达,瞬时激活了未折叠蛋白反应(unfolded protein response,UPR)[7]。为此,本研究的目的是阐明异常IL-6表达和PERK激活事件在人类结核病发病过程中对T细胞功能的可能作用。
1 资料与方法
1.1一般资料:在这项观察性研究中,我们招募了2021年1月至2023年6月间在本院接受治疗的成年结核病患者(n=28)和没有结核病症状并接触过的家庭接触者(健康接触者)(n=28)。排除艾滋病毒感染的结核病患者(n=5)和健康接触者(n=5),以及实验数据集不完整的个体(即结核病患者(n=4);健康接触者(n=3))。最终纳入19例结核病患者和20例健康接触者进行分析。在确诊之前,健康接触者与结核病指数患者在同一个家庭生活了4个多月。根据病史、胸部X光片和痰涂片检查对肺结核进行诊断。19例结核病患者中,男13例和女6例,平均年龄40.7岁,范围20~77岁。20例健康接触者中,男10例和女10例,平均年龄40.0岁,范围21~65岁。所有患者在开始治疗前采集血样。这项研究得到了本院伦理委员会的批准(2020-05)。所有研究参与者都提供了书面知情同意书。
1.2用于测量上清液细胞因子的全血体外培养:将肝素化全血(100μL)培养在补充有l-谷氨酰胺(2mmoL/L)和青霉素/链霉素(50U/mL)的96孔U底超低吸附细胞培养板中,加入结核纯化蛋白衍生物(PPD)(10μg/mL,丹麦Statens Serum Institute公司)刺激或不刺激(仅培养基)细胞72h。培养期结束后,对平板进行离心,收获上清液并使用基于流式细胞术的LEGENDplex试剂盒(美国BioLegend公司)进行测量。培养上清液(12.5μL)在测定缓冲液中以1∶2稀释并孵育2h,加入链霉亲和素PE,并将样品再孵育30min。然后洗涤样品并用BD LSR Fortessa流式细胞仪(美国BD Biosciences公司)进行分析每种细胞因子的浓度。
1.3外周血单核细胞(Peripheral blood mononuclear cells,PBMCs)分离及PERK、STAT3表达分析:通过密度离心(德国Ficoll公司)从肝素化全血中分离PBMCs。将抗人AlexaFluor488标记的CD4抗体(美国BioLegend公司)和IL-6(25ng/mL)(美国BioLegend公司)添加到每个样品中,然后将其孵育在37℃、5%CO2环境中15min。离心样品,在含有FCS(10%)的PBS中洗涤,并采用APC缀合的抗人PERK抗体(美国eBioscience公司)、Dy650缀合的抗人STAT3抗体(英国Abcam公司)进行染色。在BD Accuri C6流式细胞仪(美国BD Biosciences公司)上测量样品,以表征CD4+T细胞中PERK、STAT3表达。
1.4T细胞活化测量:将肝素化全血(100μL)培养在补充有l-谷氨酰胺(2mmoL/L)和青霉素/链霉素(50U/mL)的96孔U底超低吸附细胞培养板中,加入PPD(10μg/mL)刺激细胞3h。然后,将细胞固定并透化,用针对AlexaFluor488标记的CD4、PE标记的IFN-γ(美国BD Biosciences公司)、PerCP-Cy5.5标记的IL-2(美国BioLegend公司)和APC标记的CD40L/CD154(美国BioLegend公司)的抗体染色。使用BD Accuri C6流式细胞仪测量细胞。
1.5数据处理:使用SPSS24.0软件对数据进行分析。结果表示为平均值±标准差。两组间比较采用学生t检验。多组间比较采用单因素方差分析和Tukey事后检验进行多重比较。Spearman等级相关系数用于STAT3表达与PERK水平的相关性分析。统计学显著性定义为P<0.05。
2 结 果
2.1PPD刺激结核病患者全血中IL-17/IL-22降低和IL-6/IL-10升高:在PPD刺激的全血样品的上清液中检测到高IFN-γ浓度,但是在健康接触者和结核病患者之间没有显著差异(图1A)。与健康接触者相比,结核病患者的PPD刺激的全血样品中IL-17、IL-22水平显著降低(P<0.05),IL-6、IL-10水平显著增加(P<0.05)(图1B-E)。

图1 PPD对结核病患者和健康接触者全血细胞因子表达影响
2.2结核病患者全血中较高的自发IL-6和IL-10表达水平:我们接下来比较了研究组中非刺激的全血上清液中细胞因子水平。IL-17和IL-22的浓度通常较低,并且在研究组之间具有可比性。相反,与健康接触者相比,结核病患者的自发IL-10、IL-6和IFN-γ浓度更高(P<0.05)(图2)。

图2 结核病患者和健康接触者全血细胞因子表达
全血在存在结核分枝杆菌PPD的情况下体外培养72h后,测定上清液中IFN-γ、IL-17、IL-22、IL-6和IL-10的细胞因子浓度。
在不存在PPD刺激情况下,测定全血上清液中IFN-γ、IL-17、IL-22、IL-6和IL-10的细胞因子浓度。
2.3来自结核病患者的T细胞的异常高PERK和受损的IL-6反应:通过流式细胞术分析了来自结核病患者和健康接触者的T细胞中PERK表达(图3)。在没有IL-6体外刺激的情况下,与健康接触者相比,结核病患者的CD4+T细胞中的PERK水平显著更高(P<0.001)。加入IL-6导致健康接触者CD4+T细胞中PERK水平较没有IL-6体外刺激健康接触者CD4+T细胞显著增加(P<0.01)。在结核病患者中没有检测到IL-6体外刺激对CD4+T细胞中PERK水平的显著变化。
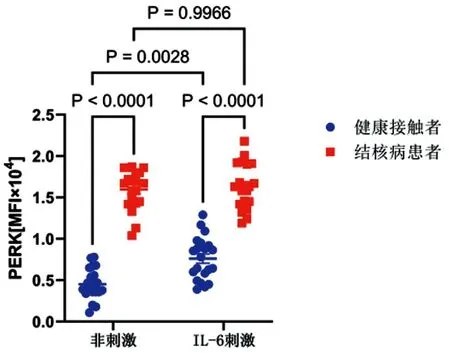
图3 IL-6体外刺激对结核病患者和健康接触者CD4+ T细胞中PERK表达影响
2.4结核病患者CD4+T细胞中较高的STAT3表达与PERK水平相关:与健康接触者相比,结核病患者的CD4+T细胞具有更高的STAT3蛋白表达(P<0.05)(图4A)。同样,与健康接触者相比,结核病患者的幼稚(CD45RAhigh)和记忆(CD45RAlow)CD4+T细胞中的STAT3水平更高(图4B)。我们接下来确定了T细胞中PERK和STAT3表达之间的联系。在所有供体和结核病患者中,CD4+T细胞中PERK和STAT3表达之间呈显著正相关性(rho=0.571、0.503,均P<0.05),而在健康接触者中没有发现二者显著相关性(rho=0.332,P=0.141)(图4C)。
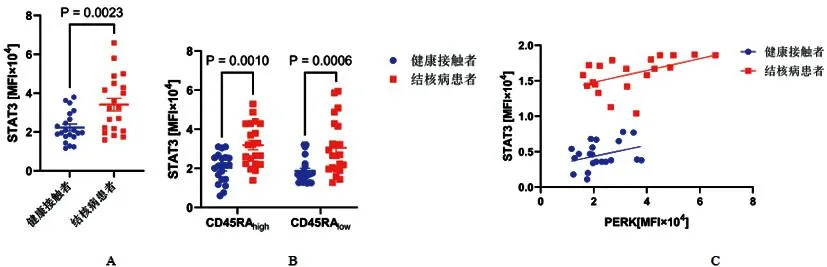
图4 结核病患者CD4+ T细胞中较高的STAT3表达与PERK水平相关

图5 STAT3水平与结核病患者T细胞活化和IFN-γ表达负相关
2.5STAT3水平与结核病患者T细胞活化和IFN-γ表达负相关:STAT3之前已被证明可调节T细胞受体激活。因此,我们测量了体外PPD特异性刺激后CD40L/IL-2共表达T细胞和CD40L/IFN-γ共表达T细胞的比例。结核病患者和健康接触者具有相似比例的结核分枝杆菌PPD诱导的CD40L/IL-2共表达T细胞和CD40L/IFN-γ共表达T细胞(图5A、B)。仅在结核病患者中观察到CD40L/IL-2共表达T细胞和CD40L/IFN-γ共表达T细胞比例与STAT3表达呈负相关(rho=-0.481、-0.705,P<0.001),而健康接触者或所有供体中没有检测到相关性(CD40L/IL-2:rho=-0.356、0.020,P=0.112、0.899,CD40L/IFN-γ:rho=-0.219、0.071,P=0.340、0.632)(图5C、D)。
3 讨 论
这项研究调查了细胞因子及其相关的T细胞功能在人类结核病患者中的作用。结果显示,体外自发性和结核分枝杆菌特异性较高的IL-6和IL-10表达水平可能导致结核病患者异常的细胞因子信号事件。此外,结核病患者的CD4+T细胞中STAT3表达与PERK水平呈正相关,并且高STAT3水平与弱TH1反应相关,可能是由于抑制了IL-2信号传导和T细胞增殖。
结核病由细胞内的结核分枝杆菌引起,其感染可以触发各种免疫系统成分在炎症部位的积聚,如M1和M2巨噬细胞、自然杀伤细胞、树突状细胞和不同亚型的淋巴细胞[8]。然而,结核分枝杆菌可以逃脱和逃避宿主的先天免疫系统;例如在活动性结核感染期间,T细胞表面的CTLA-4和PD-1增加,来自这些患者的APC上的PDL-1表达增加,导致适当适应性反应的激活减少[9]。最近的证据显示ER应激在介导结核免疫抑制方面发挥重要作用,如ER应激可以激活骨髓间充质干细胞,并触发这些细胞产生免疫抑制性的iNOS、活性氧和精氨酸-1[10]。在机制方面,ER应激显著调节骨髓来源的抑制性细胞对T细胞的抑制活性,促进IL-6、IL-10分泌,这些细胞因子进一步加剧ER应激[11]。其他研究进一步证实了减少T细胞中ER应激相关PERK表达可以促进免疫活性和刺激T细胞,特别是麻风病和结核病[12]。上述数据表明,T细胞中PERK异常表达可能有助于致病细胞因子IL-6的释放。本研究中,在外源性IL-6存在下,来自结核病患者的CD4+T细胞中的PERK水平没有增加,并且IL-6诱导的PERK在健康接触者中的表达没有达到在结核病患者中观察到的水平。这些数据表明结核病患者存在异常高的PERK表达和潜在受损的IL-6介导的T细胞反应。
众所周知,IL-6是TH17细胞发育的关键因素,TH17细胞主要参与炎症性疾病的发展。我们在结核病患者中检测到产生IL-17和IL-22的TH17细胞比例较低,这与之前的研究一致。最近研究证实,IL-6通过PERK诱导STAT3,IL-6受体信号通过STAT3与gp130链结合而受到抑制[13]。研究表明,在结核病感染期间,T细胞和PBMCs中的STAT3 mRNA表达增加[14]。在此,我们通过细胞内流式细胞术表征CD4+T细胞和其他亚群中STAT3蛋白表达水平,并在结核病患者的幼稚(CD45RAhigh)和记忆(CD45RAlow)CD4+T细胞中发现STAT3蛋白表达增加。我们还检测了不同T细胞亚群中PERK和STAT3表达之间的相关性。与先前关于炎性疾病中PERK/STAT3表达的研究结果一致[14],在结核病患者中,PERK激活伴随着较高的STAT3蛋白水平。
与健康接触者相比,我们在结核病患者的PBMCs中检测到更高的IL-10血浆水平,以及更高的自发IL-10产生。已经描述了结核病患者血浆中较高的IL-10浓度,并且先前也报道了结核病患者体外非活化PBMCs中自发产生的IL-10[15]。在当前和先前的研究中,较高的IL-10表达伴随着较高的IL-6血浆水平[16]。除了自发产生IL-10和IL-6,结核分枝杆菌PPD存在时,结核病患者的T细胞也被强烈激活,产生IL-10和IL-6。这些结果表明,在以IL-10阳性结核分枝杆菌特异性T细胞为特征的结核病患者中,免疫抑制T细胞表型占优势。在此背景下,我们一致发现,在结核病患者和接触者中,STAT3的高表达与低TH1反应之间存在相关性。尽管结核病患者和健康接触者之间的TH1反应相当,但我们发现CD40L/IL-2共表达T细胞和CD40L/IFN-γ共表达T细胞比例仅在结核病患者中与STAT3表达呈负相关,表明高STAT3水平对结核病患者活化的表达TH1细胞因子的CD4+T细胞有潜在的抑制作用。
总之,我们的数据证实了以前在结核病患者中较高的IL-10/IL-6细胞因子水平的发现,并增加了关于ER磷酸化修饰相关PERK/STAT3信号通路可能驱动结核病患者中的免疫抑制/抗T细胞反应的证据。这种受损的T细胞功能可能导致活动性结核病的免疫反应效率低下,从而需要长期的多种药物化疗。

