铜死亡相关miRNAs 在乳腺癌中的预后价值及与免疫微环境的关系
王艺馨,符德元
(1.扬州大学医学院,江苏 扬州 225000;2.苏北人民医院甲状腺乳腺外科,江苏 扬州 225000)
乳腺癌(breast cancer,BC)仍是目前全球女性死亡的主要原因。随着乳腺癌筛查和新治疗策略的普及,患者5 年生存率已高达90%,然而其发病率及死亡率仍呈增长趋势[1,2]。并且由于乳腺癌的高度异质性,具有相同亚型和TNM 分期也可出现截然不同的预后[3]。因而,急需寻找有潜力为乳腺癌患者早期发现、诊断、治疗以及预测预后的新型生物标志物。铜(Cu)是生物体所必需的微量金属元素,而金属离子过多或过少都会导致细胞死亡[4]。Tsvetkov P等[5]在研究携带铜离子的细胞死亡过程中发现了一种新的细胞死亡模式,涉及胞内铜离子,并受其调节,称为铜死亡(cuproptosis)。铜死亡是通过铜与三羧酸循环的脂酰化成分直接结合发生的,引起脂酰化蛋白质聚集和随后的铁硫簇蛋白丢失,最终导致蛋白质毒性应激致细胞死亡。MicroRNAs(miRNAs)是一类小的非编码RNA 分子,通过降解mRNA 或抑制mRNA 翻译成蛋白质来调控广泛的生物过程[6]。另外,研究发现miRNAs 可通过调节缺氧、铁死亡等途径参与癌症的进展、转移和免疫治疗反应[7,8]。然而目前缺乏对乳腺癌中miRNAs 在铜死亡过程中的功能作用的研究,以及在预测乳腺癌患者预后中的作用。本研究构建了铜死亡相关miRNAs 的预后模型,以评估其与乳腺癌患者预后关系,旨在为乳腺癌的早期诊断以及治疗提供新的方向。
1 资料与方法
1.1 数据的获取与处理 从TCGA-GDC 数据库(https://portal.gdc.cancer.gov/)下载获得乳腺癌患者完整的miRNA 数据和RNA-seq 数据以及临床信息数据,并通过Perl 软件进行数据整理。TCGA 数据库向公众免费开放,因此不需要额外的伦理证明。
1.2 铜死亡相关基因与miRNA 的筛选 通过R 软件limma 包对铜死亡相关基因与miRNA 进行Pearson相关性评估。若|r2|>0.3;P<0.001,则被认为显著相关。edgeR 包用于比较筛选肿瘤样本和正常样本之间的差异的mRNA 和铜死亡相关的差异的miRNA,过滤标准为FDR<0.05 和|log2FC|>1。
1.3 预后基因筛选及模型构建 收集患者临床资料,通过R 软件survival 包对铜死亡相关差异表达基因行单因素Cox 分析得到预后相关基因(P<0.05),再行多因素Cox 分析。最终确定11 个用于模型构建的对BC 预后有价值的铜死亡相关miRNAs(cuproptosis-related MicroRNAs,CRMs)。根据表达值及相应系数计算风险评分。公式为:Risk score=coef(miRNA1)×expr(miRNA1)+(coefmiRNA2)×expr(miRNA2)+…+coef(miRNAn)×expr(miRNAn)。
1.4 预后风险模型评估及临床价值分析 根据上述公式计算样本风险值,以中位值为界将患者分为高风险组和低风险组并进行生存差异分析,绘制K-M生存曲线,1、3、5 年的受试者工作特征(receiver operating characteristic,ROC)曲线,以及风险打分等评估该模型预后预测效能。利用单因素和多因素Cox分析评价风险评分能否作为预后因子。
1.5 靶基因预测及潜在功能分析 使用TargetScan[9]、miRDB[10]和miRTarBase[11]进行miRNA 靶基因预测。为了探索CRMs 是否可能参与BC 的进展,使用Perl 语言预测miRNA 的靶基因,将同时存在于两个及以上数据库中的基因定义为miRNA 的靶基因。将这些靶基因与差异表达基因取交集,采用KEGG 与GO 富集分析来揭示这些交集基因的潜在机制功能,P<0.05 认为差异有统计学意义。
1.6 免疫微环境浸润相关分析 CIBERSORT 算法评估每个样本中22 种免疫细胞在肿瘤微环境(Tumor microenvironment,TME)中的比例,P<0.05 过滤样本。利用ssGSEA 算法对高低风险组每个样本进行免疫细胞、免疫功能和免疫检查点的差异分析。
1.7 统计学方法 统计分析以及图片可视化均由R软件(4.1.2 版)进行。统计显著性定义为P<0.05,且所有P值均为双尾。
2 结果
2.1 铜死亡相关基因与miRNAs 的筛选 通过R 软件limma 包对19 个铜死亡基因与乳腺癌miRNA(肿瘤样本1091 例,正常样本103 例)进行筛选,共得4242 个CRMs。随后基于edgeR 包筛选出121 个铜死亡相关的差异表达miRNAs,同样通过edgeR包对乳腺癌mRNA(肿瘤样本1100 例,正常样本112 例)进行分析得到5882 个差异表达的mRNA。过滤标准为FDR<0.05 和|log2FC|>1。
2.2 预后基因的筛选及模型的构建 经单因素以及多因素Cox 分析(P<0.05),最终得到11 个有预后价值的CRMs 并以森林图形式展示,见图1。风险评分公 式:Risk score=(0.003935704×hsa-mir-592)+(0.021151117×hsa-mir-4501)+(0.13583739×hsamir -7974)+(0.291802054 ×hsa -mir -549a)+(0.061157431×hsa-mir-4675)+(-0.224946382×hsamir -4658)+(-0.062466584 ×hsa -mir -618)+(0.068830528×hsa-mir-1293)+(0.167058581×hsamir -466)+(0.01933156 ×hsa -mir -4533)+(0.019609619×hsa-mir-3923)。

图1 个铜死亡相关miRNAs 的多因素Cox 分析森林
2.3 预后风险模型预测效能评估 对高、低风险组进行生存差异分析,根据K-M 生存曲线、风险评分图、生存状态图和风险热图的结果可知随着风险评分增加,患者死亡率逐渐升高,高风险组患者OS 明显低于低风险组,两组存在显著生存差异(P<0.001),风险评分对BC 患者预后有显著影响,见图2A~图2D。并 且1、3、5 年生存结果AUC值分别为0.723、0.688、0.686,见图2E,表明该模型具有良好的预测生存能力。对临床特征与风险评分进行单因素和多因素Cox 分析显示年龄与风险评分是BC 患者的独立预后因子,见图2F、图2G。最后将风险评分纳入构建生存列线图,校准曲线显示预测概率与实际概率基本一致,见图2H、图2I。

图2 乳腺癌铜死亡相关miRNAs 预后模型的构建
2.4 功能分析 将预测的4625 个靶基因与5882 个差异表达mRNA 取交集获得1264 个交集基因,对乳腺癌潜在功能进行分析。KEGG 富集分析显示,在癌症中蛋白聚糖、Wnt 信号通路、癌症中MicroRNAs、病毒致癌等多个癌症相关通路富集,见图3A。GO 富集分析,BP 提示基因在细胞生长、细胞形态发生调节、细胞周期负调控、Wnt 信号通路等富集;CC提示基因在粘着斑、细胞基质连接等过程富集,见图3B;MF 提示基因调控特异性RNA 聚合酶IIDNA 结合转录因子结合、DNA 结合转录因子结合,见图3C,表明大多数目标靶基因都参与了癌症相关通路,揭示CRMs 可能在BC 进展中发挥重要作用。

图3 乳腺癌相关靶基因的功能富集分析
2.5 免疫微环境浸润相关分析 进一步探索与抗肿瘤免疫之间的关系,见图4A、图4B,两组免疫细胞浸润存在差异,在低风险组中肿瘤浸润性CD8+T 细胞、幼稚B 细胞、浆细胞、静息肥大细胞比例高于高风险组,而高风险组中M2 巨噬细胞、M0 巨噬细胞比例高于低风险组。另外,在免疫细胞评分中B 细胞、CD8+T 细胞、肥大细胞、NK 细胞、pDCs、Tfh、Th2 细胞、TIL 在低风险组中较高,见图4C。在免疫功能评分中趋化因子受体、免疫检查点、溶细胞活性、副炎症、T 细胞共刺激以及Ⅰ型干扰素反应、Ⅱ型干扰素反应在高低风险组之间存在差异,见图4D。并进一步探讨了高、低风险组免疫检查点分子表达差异,共21 个差异表达的免疫检查点,常见的如PDCD1(PD-1)、CD274(PD-L1)、CD40、CD40LG和CD27 在低风险组中表达水平高于高风险组,见图4E,这表明低风险组乳腺癌患者可能是免疫治疗的候选者。
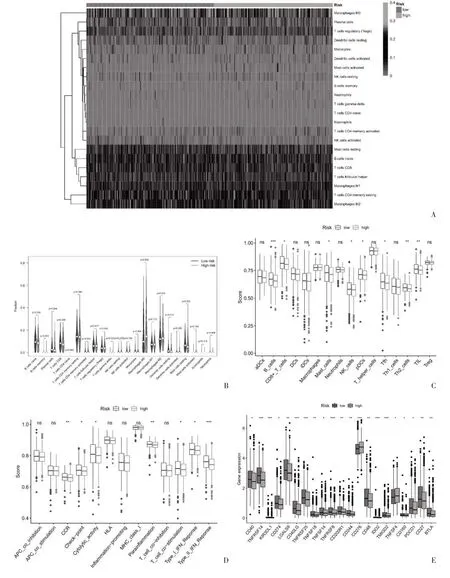
图4 乳腺癌铜死亡相关miRNAs 免疫相关分析
3 讨论
铜稳态失衡会影响肿瘤细胞的生长并诱导其死亡[12]。当胞内铜离子异常升高时,离子载体将其转运到线粒体,直接与三羧酸循环的脂酰化成分结合致脂酰化蛋白积累和铁硫簇蛋白丢失,导致蛋白毒性应激致细胞死亡[5,13]。乳腺癌和卵巢癌组织中铜死亡关键基因FDX1 与酰化蛋白表达高度相关,因而有希望利用靶向治疗具有铜死亡这种代谢特征的肿瘤。
研究发现[14],铜死亡相关LncRNA 在预测乳腺癌预后和肿瘤免疫浸润等方面具有良好表现。本研究发现的11 个CRMs 中,大部分miRNAs 已有报道可作为肿瘤抑制因子或癌基因,其表达异常与乳腺癌等肿瘤的进展密切相关,影响患者生存预后。如hsa-miR-549a 可预测胶质细胞瘤患者的预后[15]。而hsa-miR-446、hsa-miR-618 作为重要的肿瘤抑制因子,在抑制肿瘤细胞增殖、转移、侵袭并诱导细胞凋亡方面发挥作用[16,17]。研究发现[18],hsa-miR-592 可靶向TGF-β 抑制乳腺癌细胞增殖、迁移和侵袭,但其在BC 组织和细胞系中表达显著低于正常组织,与晚期临床分期、远处转移和淋巴结转移有关。此外,hsa-miR-3923 可作为预测乳腺癌淋巴转移的标志物[19]。Takagawa Y 等[20]在小鼠模型中发现hsamiR-1293 能抑制肿瘤细胞生长,并揭示其与DNA损伤剂或放射疗法的联合使用可能对癌症治疗有效。hsa-miR-4501 可能参与结膜黑色素瘤的转移扩散[21]。因此,用于模型构建的miRNAs 参与调控肿瘤的生长、侵袭与转移等。通过对KEGG 分析发现主要富集在癌症中的蛋白聚糖、PI3K-AkT 信号通路等通路。蛋白聚糖是构成乳腺微环境主要信号传导和结构成分的功能性蛋白质,在肿瘤进展和转移中发挥重要作用[22]。Guo J 等[23]研究发现,铜激活PI3K-AKT 信号通路促进乳腺肿瘤发生。使用TTM等铜螯合剂可有效抑制AKT 激酶活性,对抗过度活跃的AKT 驱动的肿瘤,减弱致癌功能。因此,用于构建模型的CRMs 参与调控肿瘤相关信号通路,为模型的临床应用提供了生物学的证据。
随着免疫检查点阻断(ICB)疗法的深入研究,抗PD-1/PD-L1 在乳腺癌治疗中显示出良好的临床效果。ICB 的疗效与TME 密切相关,在具有较少浸润性细胞毒性T 细胞和较低PD-L1 表达的免疫“冷”肿瘤中较差[24]。而乳腺癌大多表现为免疫“冷”肿瘤[25]。若将免疫“冷”肿瘤转化为免疫“热”肿瘤可能会增强乳腺癌对ICB 治疗的反应。在本研究中,高风险组浸润的肿瘤杀伤免疫细胞CD8+T 细胞较少,而促进肿瘤增殖和转移的免疫细胞M2 巨噬细胞增加;并且高风险组在CD8+T 细胞、NK 细胞、pDCs、B 细胞、肥大细胞、Th2 细胞、滤泡辅助T 细胞等具有抗肿瘤免疫效应的免疫细胞评分低于低风险组,与既往研究一致[26-28]。此外,低风险组患者中免疫检查点PDCD1(PD-1)、CD274(PD-L1)、CD40、CD40LG 和CD27 表达水平较高。因而推测相较于BC 高风险组患者而言,低风险组患者表现出更强的抗肿瘤免疫效应,倾向于免疫“热”,更可能受益于免疫检查点抑制剂。这些发现表明CRMs 与TME 相关,可用于靶向免疫治疗。近来研究发现铜可调节癌细胞中PD-L1 表达发挥抗肿瘤免疫作用。Voli F 等[29]研究发现,铜螯合剂TEPA 通过下调神经母细胞瘤肿瘤中的PD-L1 来增强免疫细胞的肿瘤浸润并提高小鼠存活率。此外,研究还发现miRNA 可以调节免疫检查点,用于免疫治疗。如hsa-miR-4759 可抑制PD-L1 表达并增加肿瘤组织中CD8+T 细胞浸润,促进BC 抗肿瘤免疫[30]。总之,据以往研究及本研究可推测CRMs 在免疫浸润方面发挥重要作用,可影响乳腺癌免疫状态,进而影响肿瘤的进展。为探索潜在的肿瘤靶向疗法提供新思路。
综上所述,CRMs 可能与乳腺癌发展有关,并定义了一种新型预后模型,为乳腺癌预后预测及免疫学领域特征提供了见解。然而,本研究还存在一些不足。首先,本研究分析是对公共数据库数据的二次分析,数据来源单一,且存在选择偏倚,影响结果准确性;其次,本研究对乳腺癌CRMs 的作用机制及与肿瘤免疫之间的潜在机制还需进一步实验验证。

