胰岛素抵抗小鼠小肠类器官模型构建及黄诺玛苷对此模型肠黏膜屏障的保护作用
依米妮古丽·麦麦提,麦麦提亚森·多力昆,古丽那孜·别克达吾来提,热孜亚·阿不来孜,陈龙,郑梦竹,3,杨占群,蔡梓恒,许诺,李琳琳
(1.新疆医科大学药学院,新疆乌鲁木齐 830011;2.北京大学第三医院药剂科,北京 100191;3.北京大学基因组学创新中心,北京 100091;4.新疆喀什地区第一人民医院综合心理科,新疆喀什 844000)
胰岛素抵抗(insulin resistance,IR)是包括2型糖尿病(diabetes mellitus type 2,T2DM)和心血管疾病在内的人类疾病最早表现之一[1]。根据国际糖尿病联盟发布的第10版糖尿病图谱,全球有5.37亿成年人患有糖尿病,其中中国病例数为140.9万,是全世界糖尿病患者最多的国家[2]。防治糖尿病已成为严峻的公共卫生问题。
当机体出现病理状况时,由多种因素造成的紧密连接蛋白异常使肠道黏膜屏障功能受损,从而使肠上皮通透性发生改变,导致IR 的全身性低度炎症反应,继而诱导T2DM和肥胖等代谢性疾病[3-4]。因此,以胃肠道为靶点的治疗在改善T2DM 方面可能发挥重要作用。db/db小鼠为瘦素受体基因缺陷引起的自发性T2DM 小鼠,可高度模拟人类具有明显IR特点的自发性T2DM的发生发展[5]。
两色金鸡菊(Coreopsistinctoria)又称昆仑雪菊,属于菊科金鸡菊属植物[6],具有改善IR[7]、抗炎、抗氧化和保护胰岛β 细胞等[8]作用。本课题组前期研究发现,两色金鸡菊醇提取物可部分逆转高脂饮食所导致的菌群结构改变,并对肠道产生保护作用[9]。两色金鸡菊中主要有效成分黄酮类物质含量可达18.3%[10],其中黄诺玛苷(flavanomarein)对糖尿病及其并发症也具有一定的改善作用[11-12],并在小肠吸收效率最好[13],但其药理作用机制有待研究。
肠类器官是小肠干细胞衍生的组织3D 培养模型,能够模拟人类小肠的表型构造、蛋白质构成及组织结构功能[14]。传统的Caco2 单层模型不能真实再现肠道黏液层组织结构,也不存在不同类型的肠细胞之间的相互作用[15]。小肠类器官可分化为肠上皮功能细胞,从而动态监测和分析小肠黏膜损伤修复的生理病理机制[16]。类器官作为疾病新型非临床研究模型具有良好的应用前景,但尚无有关小肠IR 模型类器官建立相关的研究报道。因此,本研究建立并完善IR 小鼠小肠类器官模型,分析其形态及生物学特性,探究黄诺玛苷对IR 小鼠小肠肠道屏障的保护作用,进一步阐明黄诺玛苷改善糖脂代谢的药理作用机制。
1 材料与方法
1.1 动物
雄性C57BL/6J 小鼠,体重20~25 g,6~8 周龄;雄性db/db(IR)小鼠(C57BL/6J背景),体重35~40 g,6~8 周龄,均购自于斯贝福(北京)生物技术有限公司,动物合格证号:SCXY(京)2019-0010;SPF 级实验动物使用许可证号:SYXK(新)2018-0003。本研究所涉及的动物实验通过新疆医科大学实验动物伦理委员会批准,伦理审批号:IACUC-20210422-07。
1.2 药品、主要试剂和仪器
黄诺玛苷(纯度≥99.9%),课题组自提[17]。类器官基础培养基:DMEM/F12 培养基,美国Gibco公司;类器官完全培养基:基础培养基添加10%重组小鼠R-脊椎蛋白Ⅰ(批号120-38-20)、5%重组小鼠Noggin蛋白(批号120-10C)、5×10-5mg·L-1重组小鼠表皮生长因子(批号315-09-100UG)和5×10-5mg·L-1重组小鼠Wnt3a(批号315-20-10),美国PeproTech公司;B27 添加剂1∶50(批号17504044)、N2 添加剂1∶100(批号17502048)、1%青-链霉素(批号15140122)、1%Hepes缓冲液(10 mmol·L-1)、胎牛血清(fetal bovine serum,FBS)(批号2414839RP)和Gluta MAXTM-Ⅰ添加剂(批号35050-061),美国Gibco公司;Rho激酶抑制剂(批号S1049),美国Selleck Chemicals 公司;500 nmol·L-1N-乙酰-L-半胱氨酸1∶150(批号A9165)、10 mmol·L-1烟酰胺(批号NO636)和500 nmol·L-1A83-01(批号SML0788-5MG),德国Sigma Aldrich 公司;杜氏磷酸盐缓冲液(DPBS),美国Thermo Scientific 公司;基质胶,美国Corning 公司;温和细胞解离(gentle cell dissocitation)试剂(批号100-0485),加拿大Stemcell公司;兔抗小鼠溶菌酶(lysozyme,Lyz)单克隆抗体(批号NBP2-61118),美国NOVUS 公司;兔抗小鼠Ki-67(D3B5)单克隆抗体、兔抗小鼠β-肌动蛋白单克隆抗体和HRP 标记山羊抗兔IgG 抗体(批号分别为718022,2099233 和9129S),美国Cell signaling公司;兔抗MUC-2 单克隆抗体(批号XF3625268),美国Invivogen 公司;兔抗小鼠胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)多克隆抗体和兔抗小鼠肽YY(peotide YY,PYY)多克隆抗体(55292-1-AP和24294-1-AP),美国Proteintech 公司;兔抗小鼠纤连蛋白(fibronectin,Fn)单克隆抗体(批号ab268620)、兔抗E-钙黏蛋白(E-cadherin,E-cad)单克隆抗体(批号EP700y)和荧光标记山羊抗兔IgG 抗体(批号ab150077),美国Abcam 公司;RIPA 裂解液,塞维尔生物科技有限公司;小鼠溶菌酶ELISA 试剂盒(批号SEKM-0276),美国Solarbio 公司;RNA 提取试剂盒(批号20220620),北京索莱宝公司;cDNA 链合成试剂盒(批号AM12936A),日本TAKARA公司;2×Realab Green PCR Fast mixture 试剂盒(批号R0201),北京兰博利德生物科技有限公司;引物均为小鼠源,引物序列见表1,生工生物工程(上海)股份有限公司合成。
Axio VerA1荧光显微镜,德国Carl Zeiss公司;HERACELL 150i CO2培养箱和Multifuge X1R 型低温离心机,美国Thermo Scientific 公司;Nanodrop分光光度计,美国Pultton 公司;凝胶成像仪,美国Bio-Rad 公司;Step One 实时荧光定量PCR 仪,美国Applied biosystems公司。
1.3 小鼠小肠类器官培养和处理
1.3.1 小肠类器官模型建立
将小鼠安乐死后浸泡于75%乙醇中,无菌环境下在靠近胃端取长度约20 cm 小肠,去除肠系膜、血管和脂肪。将肠段放入冷DPBS 中,用10 mL DPBS 冲洗肠段。小肠段切开,用盖玻片刮掉小肠绒毛和剩余内容物后,剪成2 mm小片段放入50 mL离心管中,用5 mL 移液枪多次吹打洗涤。弃去上清,加温和细胞解离试剂20 mL,摇床上20 r·min-1室温消化15 min。自然沉降30 s,弃去上清,加入含1% FBS 的无Ca2+和Mg2+磷酸盐缓冲液(1%FBS)10 mL,吹打5~10 次。将小肠组织用70 μm滤网过滤,在4 ℃,300×g离心5 min,弃上清。用1 mL DMEM/F12 重悬沉淀并转移到1.5 mL 新EP 管中,取10 μL 在显微镜下观察隐窝形态并计数。4 ℃,200×g再次离心3 min,弃上清。隐窝细胞团按1∶2比例加入到预先配制好的类器官培养基和基质胶中形成混悬物,以每孔180~200 个隐窝计算,取30 μL 加入预热的48 孔板中。将48孔板放入37 ℃CO2培养箱中孵育15 min后沿壁加入类器官培养基继续放回37 ℃CO2培养箱孵育。7 d 内按类器官状态更换培养基2~3次。

Tab.1 Sequences of primers for real time-quantitative PCR(RT-qPCR)
1.3.2 类器官传代、冻存和复苏
按类器官生长情况,在7~10 d 对其进行传代。吸除全部培养基,每孔加1 mL 温和细胞解离试剂,反应1 min 后转移到15 mL 离心管中。室温摇床20 r·min-1孵育10 min,290×g,4 ℃离心5 min。弃上清后用1 mL DMEM/F12 重悬样本,再200×g,4 ℃离心5 min。细胞按1∶2 比例加入类器官完全培养基和基质胶形成混悬物,取30 μL 加入预热的48 孔板中进行培养;小鼠小肠类器官冻存方法步骤同传代过程。计数离心后的细胞,按1×107L-1密度加入10%DMSO 1 mL,放入程序降温冻存盒-80 ℃过夜,转移到液氮中低温保存。在37 ℃水浴锅内复苏冻存的类器官,离心、洗涤、接种、培养和传代同前。
1.3.3 小肠类器官分组和处理
传代3 d后小肠类器官分3组处理:正常对照组(C57BL/6J 小鼠小肠类器官)、IR 模型组(db/db小鼠小肠类器官用含0.1%DMSO 培养液处理48 h)和IR 模型+黄诺玛苷组(db/db小鼠小肠类器官用黄诺玛苷25,50和100 μmol·L-1处理48 h)。
1.4 免疫荧光检测小肠类器官Ki-67,E-cad,Lyz和MUC-2蛋白表达
取1.3 制备的小肠类器官培养6 d 后弃去培养基,用冷DPBS 500 μL 洗涤3~4 次,在37 ℃条件下用4%多聚甲醛固定30 min。用0.1% Triton-100打孔15 min,室温用含5%FBS的PBS封闭30 min。弃封闭液后加入一抗(Ki-67 和Lyz,1∶100;E-cad和MUC-2,1∶200)在4 ℃孵育12 h,用DPBS 洗3~5 次(每次5 min)。加入荧光二抗(1∶500)37 ℃孵育1 h,再用DPBS 洗3~5 次(每次5 min),最后用4′,6-二脒基-2-苯基吲哚(DAPI)染细胞核5 min,通过倒置显微镜观察Ki-67,E-cad,Lyz 和MUC-2 荧光标记。以荧光强度反映目标蛋白表达水平。
1.5 ELlSA检测小肠类器官Lyz分泌水平
取1.3制备的小肠类器官,培养6 d后将上清液以1000×g,4 ℃离心10 min 后转移到EP 管中,按照ELISA 试剂盒说明书操作,用波长450 nm 处吸光度(A450nm)值反映Lyz分泌水平。
1.6 RT-qPCR 检测小肠类器官Lyz,GLP-1,PYY和Fn mRNA表达
取1.3 制备的小肠类器官,培养6 d 后使用RNA 提取试剂盒提取各组样本总RNA,用Nano-Drop 紫外分光光度计检测RNA 浓度与纯度。利用1.0%琼脂糖凝胶电泳检测RNA 是否污染及其降解程度。用PrimeScriptTM第一链cDNA 合成试剂盒逆转录合成cDNA。使用2×Realab Green PCR Fast mixture试剂盒进行检测,每待测样品设3个平行样本。反应体系:cDNA 模板1 μL,正向引物0.5 μL,反向引物0.5 μL,2×Realab Green PCR Fast mixture 10 μL,ROX 荧光标记0.4 μL,无脱氧核糖核酸酶水7.6 μL,总体积20 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,48 ℃退火30 s,72 ℃延伸30 s,共40 个循环,熔解曲线采集程序为95 ℃30 s,55 ℃30 s。以β 肌动蛋白为内参,用2-△△Ct法计算目标基因mRNA相对表达水平。
1.7 Western 印迹法检测小肠类器官Lyz,GLP-1,PYY和Fn蛋白表达
1.3.3 分组处理的类器官给药干预48 h 后弃去全部培养基,每孔加1%FBS 500 μL 进行机械碎胶并转移到EP 管中,800×g,4 ℃离心5 min,加入RIPA裂解液,4 ℃,9820×g离心30 min。上清转入新EP 管中,用BCA 法定量蛋白浓度。制备SDSPAGE 凝胶,将各组蛋白溶液调整到同一浓度(1 mg·L-1),变性10 min,上样(20 μg)。电泳1.5 h,转膜75 min,常温下用5%脱脂奶粉封闭90 min。加入一抗(Lyz,GLP-1,PYY 和Fn,稀释比例均为1∶1000)溶液,4 ℃摇床孵育过夜,洗涤。室温下加入HRP 标记的山羊抗兔IgG抗体(二抗)(稀释比例1∶5000)孵育1 h,洗涤。滴加增强型化学发光液(现配现用),曝光后用Image J 软件分析条带积分吸光度值。以β-肌动蛋白为内参,用目标蛋白与内参的积分吸光度比值反映目标蛋白表达水平。
1.8 统计学分析
2 结果
2.1 正常小鼠和lR 模型小鼠小肠类器官模型的鉴定
如图1所示,分离出的隐窝团培养4~5 h 后外圈开始增厚;培养第2 天开始形成轮廓清晰的圆圈状结构,中间可见管腔;第4天,圆圈状结构变大,开始出芽形成潘氏细胞和杯状细胞;第6 天形成围绕管腔周围的环状结构,形成成熟可传代的类器官。C57BL/6J与db/db小鼠小肠类器官大小、生长速度以及隐窝细胞数量之间有所差异。免疫荧光法结果(图2)表明,2种小鼠小肠类器官均表达生长及增殖细胞核核抗原Ki-67、上皮细胞E-Cad、潘氏细胞标志物Lyz和杯状细胞标志物MUC-2。

Fig.1 Dynamic observation of small intestinal organoid formation of normal mice and insulin resistance(lR)mice.After the C57BL/6J and db/db mice were euthanized,the small intestine segments were cut into small fragments and added with a gentel cell dissociation reagent to digest the small intestinal crypts.After that,the crypt cell mass was added to the pre-prepared organoid medium and matrigel at a ratio of 1∶2 to form a suspension,which was added to a 48-well plate with 180-200 crypts per well and incubated in a CO2 incubator at 37 ℃.The medium was changed 2-3 times according to the state of organoids within 7 d.The crypt morphology was observed and counted under a microscope.
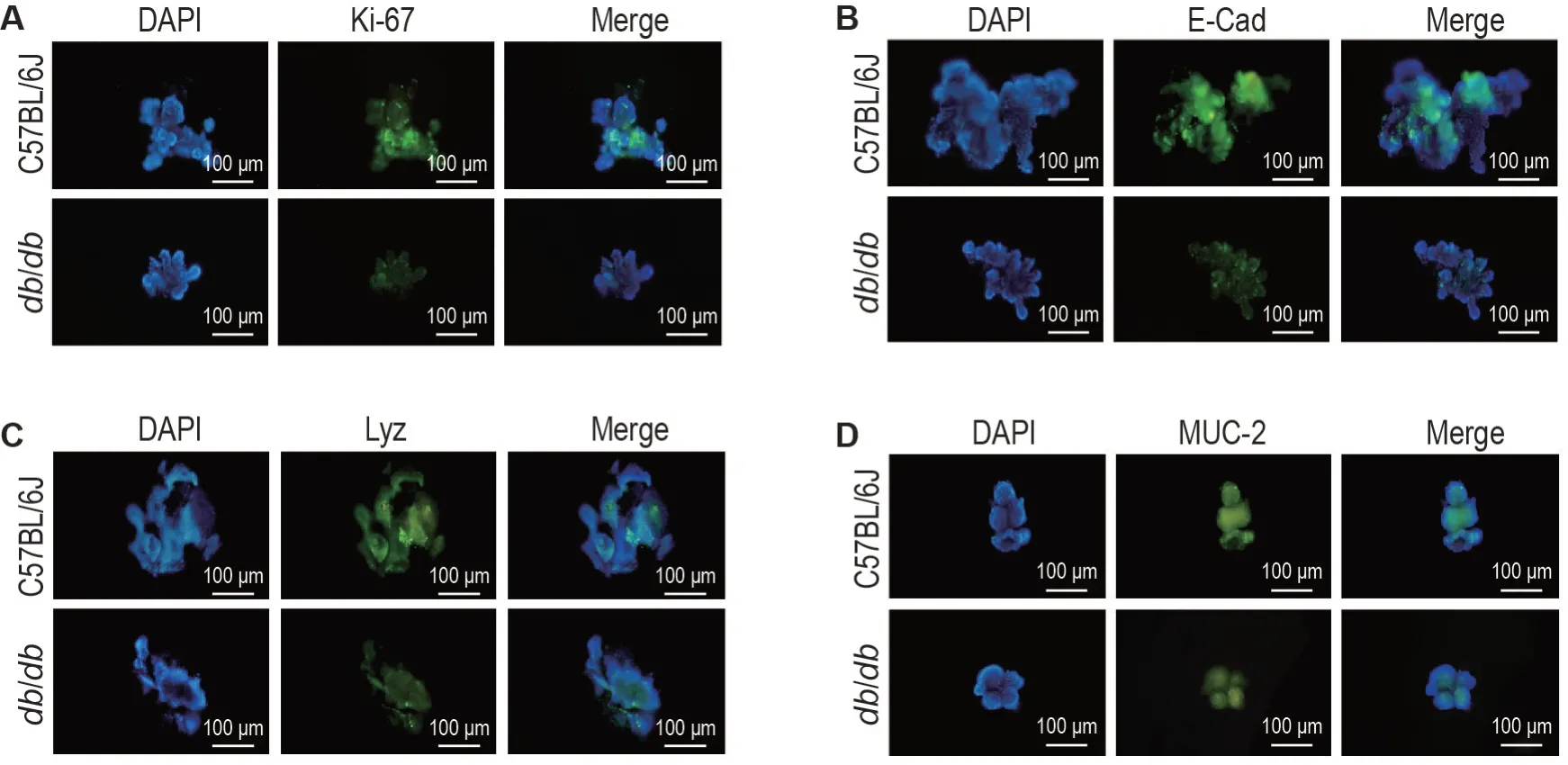
Fig.2 Expressions of Ki-67(A),E-cadherin(E-cad,B),Lyz(C)and mucin-2(MUC-2,D)in small intestinal organoids of normal mice and lR mice by immunofluorescence.Small intestinal organoids were cultured for 6 d.
2.2 db/db小鼠小肠类器官Fn,GLP-1和PYY mRNA表达水平
RT-qPCR结果(图3)显示,IR模型组FnmRNA表达明显高于正常对照组(P<0.05),肠道L 细胞标志物GLP-1和PYYmRNA 表达明显低于正常对照组(P<0.05)。

Fig.3 Expressions of Fn,GLP-1 and PYY mRNA in mouse small intestinal organoids by RT-qPCR.Small intestinal organoids were divided into two groups 6 d after subculturation:C57BL/6J mouse small intestinal organoids as normal control group,db/db mouse intestinal organoids as IR model group.±s,n=3.*P<0.05,compared with normal control group.
2.3 db/db 小鼠小肠类器官Fn,GLP-1 和PYY 蛋白表达水平
Western印迹结果(图4)显示,IR模型组Fn蛋白表达明显高于正常对照组(P<0.01),L 细胞标志物GLP-1(P<0.01)和PYY(P<0.05)蛋白表达水平明显低于正常对照组。

Fig.4 Expressions of Fn,GLP-1 and PYY protein in mouse small intestinal organoids by Western blotting.See Fig.3 for the organoid treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with normal control group.
2.4 db/db小鼠小肠类器官潘氏细胞Lyz分泌水平
如图5所示,与正常对照组相比,IR模型组小肠类器官潘氏细胞Lyz分泌显著减少(P<0.01)。
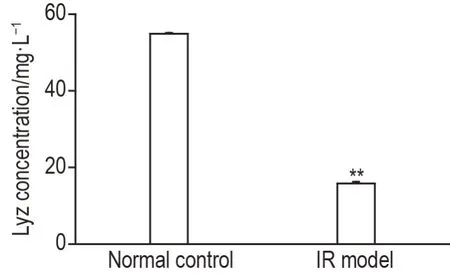
Fig.5 Effect of flavonmarin(FM)on Lyz secretion in small intestinal organoids of lR model mice by ELlSA.See Fig.3 for the organoid treatment.±s,n=3.**P<0.01,compared with normal control group.
2.5 黄诺玛苷对lR模型小鼠小肠类器官Lyz mRNA表达水平的影响
如图6所示,与正常对照组相比,IR模型组小鼠小肠类器官中LyzmRNA 表达水平显著降低(P<0.01);与IR 模型组相比,IR 模型+黄诺玛苷50 和100 μmol·L-1组小鼠小肠类器官LyzmRNA 表达水平显著升高(P<0.05,P<0.01)。

Fig.6 Effect of FM on Lyz mRNA expression in small intestinal organoids of lR model mice by RT-qPCR.Small intestinal organoids were divided into five groups:C57BL/6J mouse small intestinal organoids as normal control group,db/db mouse intestinal organoids as IR model group,db/db mouse small intestinal organoids with FM 25,50 and 100 μmol·L-1 intervention 4 d after subculturation as IR model+FM groups,the intervention duration was 48 h.±s,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with IR model group.
2.6 黄诺玛苷对lR 模型小鼠小肠类器官Lyz 蛋白表达水平的影响
Western 印迹结果(图7)显示,IR 模型组Lyz表达明显低于正常对照组(P<0.01),IR 模型+黄诺玛苷50 和100 μmol·L-1组小鼠小肠类器官Lyz 表达显著升高(P<0.05,P<0.01)。

Fig.7 Effect of FM on Lyz protein expression in small intestinal organoids by Western blotting.See Fig.6 for the organoid treatment.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with IR model group.
3 讨论
本研究通过在体外直接分离、培养小肠隐窝完成了C57BL/6J和db/db小鼠小肠类器官的建立、传代、冻存和复苏等工作。这与直接分离肠道干细胞的方法不同,省去了小肠干细胞的分选步骤,并发现建立的正常小鼠与IR 模型小鼠小肠类器官在隐窝细胞数量、生长速度和大小等方面有所差异。
免疫荧光结果显示,本研究建立的小鼠小肠类器官均表达Ki-67,E-cad,Lyz 和MUC-2,表明建立的正常小鼠和IR小鼠小肠类器官很好地保留了来源于小肠隐窝团中肠道干细胞的增殖分化特征,且肠道类器官与小肠组织上皮的结构和组成具有一致性,与体内小肠组织具有相同的多细胞组成等特点。
RT-qPCR 和Western 印迹结果中,IR 模型小鼠Fn mRNA 和蛋白均高表达,肠道L 细胞标志物GLP-1 和PYY mRNA 和蛋白低表达。这可能跟高血糖促进成纤维细胞分泌Fn,从而引起纤维化病变有关。IR 模型小鼠小肠长期处于低度炎症状态,可能会使隐窝细胞生长速度变慢,细胞黏附性降低,从而导致肠黏膜屏障受损,肠道通透性增加。
传统改善IR 的药物不可避免地具有胃肠道反应、低血糖、体重增加和皮肤病变等不良反应[18-19]。根据报道,黄酮类、膳食纤维、皂苷和多糖等天然活性化合物具有改善IR 特性,不良反应少,依赖性低,资源丰富[20]。潘氏细胞是机体小肠特征性细胞,与肠道干细胞相邻,能分泌Lyz 和α 防御素等抗菌分子到小肠管腔[21],回肠中Lyz 水平的显著下降可能参与IR 及T2DM 的发生发展[22]。ELISA 结果显示,IR 模型小鼠小肠类器官Lyz 分泌水平显著低于正常小鼠,表明IR 模型小鼠肠道局部防御能力下降可能与潘氏细胞分泌Lyz减少有关。
本研究通过对正常小鼠和IR 模型小鼠小肠类器官进行药物干预发现,黄诺玛苷具有回调IR 小鼠小肠类器官Lyz表达的作用。黄诺玛苷可能通过增加遗传因素导致的IR 小鼠肠道潘氏细胞Lyz 含量来减少肠道通透性,缓解肠道屏障受损,通过维护黏膜屏障改善IR。具体分子机制还需进一步研究。

