维生素K3激活黄嘌呤氧化酶的动力学和分子机制
刘礼,赵文静,肖丽君,齐晓怡,吕沐瀚,梁思成,吴敬敬
(西南医科大学附属医院 1.消化内科,2.皮肤科,四川泸州 646000;3.大连医科大学药学院临床药理学系,辽宁大连 116044)
维生素K 统指叶绿醌(K1)、甲基萘醌类(K2)和甲萘醌(K3)等结构类似物[1-2]。其中,维生素K1和K2是天然存在的,属于脂溶性维生素。维生素K1广泛分布于植物和藻类,维生素K2主要分布于各种乳制品。维生素K3是人工合成的止血药物,也可由维生素K1和维生素K2在胃肠道中经微生物转化生成[2-4]。维生素K 参与广泛的生物过程并与许多疾病治疗有关,如其是哺乳动物凝血和骨代谢的关键因子,可用于防止过度出血(如鼻出血和胃肠道出血等)和治疗骨质疏松[5-6]。此外,维生素K 还可作为膳食补充剂,用于改善和保持人体健康[7]。据Gast 等[8-12]建议,维生素K 的平均摄入量为0.07~0.30 g·d-1。虽然维生素K补充剂的使用频率很低,但消费者对膳食补充剂的偏好正在增长,目前发达国家的人均摄入量总体上高于这一建议[3,6,13]。因此,其对人体具有易暴露,不易察觉的特点。
近期,美国FDA 发布的临床数据表明,服用维生素K(2-甲基-1,4-萘醌)用于治疗骨质疏松的老年人患高尿酸及痛风的概率可能会增加[14],但具体机制仍不清楚。本课题前期研究揭示了白花丹素(5-羟基-2-甲基-1,4-萘醌)具有黄嘌呤氧化酶(xanthine oxidase,XO)激活能力[15],鉴于白花丹素与维生素K 均为萘醌类化合物,推测萘醌类化合物维生素K3也具有一定的XO 激活活性。XO 是哺乳动物细胞质中的一种高度保守的钼黄素酶,在肝和肠道中高水平表达,在血液和其他组织中也有表达[16]。XO 负责激活/降解一些药物(如多柔比星和甲苯磺丁脲)。更重要的是,它是内源性嘌呤转化为尿酸的体内限速酶[16-17],激活XO 可导致尿酸的异常升高。本研究旨在应用人肝S9 孵育体系,研究维生素K3对人源XO 的激活作用(图1),并通过激活动力学及分子对接技术阐明其相关机制,为维生素K3的饮食管理和临床合理应用提供指导。

Fig.1 Effect of vitamin K3 on conversion of xanthine to uric acid.XO:xanthine oxidase;MoCo:molybdopterin cofactor;Fe2S2(2Fe/S):two non-identical iron-sulfur clusters;FAD:flavin adenine dinucleotide.
1 材料与方法
1.1 药品、试剂和主要仪器
维生素K3(纯度>98%,批号71707303),上海迈瑞尔化学科技有限公司。黄嘌呤(纯度>98%,批号P1605538),上海阿达玛试剂有限公司。混合的人肝S9(20 名供体,混合性别),美国康宁公司。高效液相色谱(high performance liquid chromatography,HPLC)系统(包含G7111A Quat 泵VL、G7129C Vialsampler 自动注射器、G7130A ICC 热交换器和G7115A DAD WR 检测器),美国安捷伦科技公司;超纯水系统,美国Millipore 公司。所有试剂和溶剂均为市售分析纯或色谱纯。
1.2 黄嘌呤及其XO代谢物尿酸的HPLC分析条件
Diamonsil Plus C18 柱(250 mm×4.6 mm,5 μm),柱温30 ℃;流动相为水(含0.1%磷酸)和乙腈(97/3,V/V),进样量:60 μL;流速为1 mL·min-1;检测波长284 nm。尿酸的线性范围为0.16~2.5 μmol·L-1,R为0.9998。该方法重现性良好,日内和日间RSD均<5.2%。
1.3 维生素K3对XO活性影响的初筛
首先,使用不同浓度黄嘌呤(0,2,4,8 和16 μmol·L-1)、磷酸钾50 mmol·L-1缓冲液(PBS,pH 7.4)和S9(0.1 g·L-1)组成总体积为200 μL的孵育系统,在37 ℃条件下反应90 min,HPLC 法测定不同浓度黄嘌呤与XO 反应的尿酸生成量,计算XO介导的尿酸生成反应的动力学常数Km。之后,以不同浓度(1,10 和100 μmol·L-1)的维生素K3、XO 抑制剂别嘌呤醇或非布索坦分别与磷酸钾50 mmol·L-1缓冲液(PBS,pH 7.4)、黄嘌呤(浓度为测得的Km值)和S9(0.1 g·L-1)组成总体积为200 μL的孵育系统,在37 ℃条件下反应90 min后,测定XO 活性(n=3)。在加入S9 启始前,反应混合物均经3 min 的预培养步骤,加入S9 孵育90 min后,体系中加入200 μL 冰冷10%三氯乙酸(V/V)终止反应。反应样品在4 ℃,20 000×g条件下离心10 min,上清液进行HPLC 分析,通过单位时间体系中尿酸的生产量反映XO 活性。黄嘌呤母液使用含0.2% NH3·H2O(V/V)的PBS溶解和保存,维生素K3用二甲亚砜(dimethyl sulfoxide,DMSO)稀释,DMSO的体系终浓度小于1%(V/V)。
1.4 维生素K3激活XO的EC50和动力学曲线测定
为进一步评估维生素K3的XO 激活效果,使用浓度接近其Km值的黄嘌呤和不同浓度维生素K3(1,2,5,10,20,50,100,200 和400 μmol·L-1)确定半数有效浓度(EC50)和最大效应(Emax)(式①)。当维生素K3浓度接近其EC50值时,使用浓度范围在<1/3Km~>3Km的底物进行激活动力学测定。使用GraphPad Prism 7.0 软件(美国加利福尼亚州圣地亚哥)和Michaelis-Menten 方程(式②)进行非线性拟合估计酶动力学参数。通过Lineweaver-Burk双倒数曲线图评估激活动力学类型。
其中,E是效应,Emax是最大效应,EC50是半数最大效应浓度,v是反应速率,Vmax是最大速度,Km(米氏常数)是0.5Vmax时的浓度,[S]是底物浓度。通过F统计量、R2值、参数标准误差估计值和95%置信区间评估动力学模型的拟合度。
1.5 分子对接研究维生素K3与人肝XO 的相互作用机制
采用AutoDock 工具4.2 软件进行分子对接,探索维生素K3与人源XO 之间的相互作用。从RCSB蛋白质数据库中检索人源XO 的X 射线晶体结构(PBD ID:2E1Q)。使用AlloSite 服务器并应用AlloSitePro方法分析人源XO中维生素K3的优选结合位点。在蛋白质上创建网格盒(X,Y和Z坐标尺寸为60×60×60 的网格框,网格间距为0.375 Å)并准备PDBQT 文件和配体后,使用AutoDockTools进行对接并得到结合能数值。使用PyMOL 2.5 和LigPlot 2.2软件对对接结果进行可视化和分析。
1.6 统计学分析
2 结果
2.1 维生素K3对XO活性的影响
HPLC 数据显示,黄嘌呤及其XO 代谢物尿酸的保留时间分别为7.6和6.6 min(图2)。

Fig.2 ldentification of xanthine and its xanthine oxidase(XO)- mediated oxidative metabolite uric acid by high peformance liquid chromatography(HPLC).The reactions of xanthine and XO were carried out at 37 ℃for 90 min.Liquid chromatography analysis conditions:diamonsil Plus C18 column(250 mm×4.6 mm,5 μm),column temperature 30 ℃,the mobile phases were water(containing 0.1% phosphoric acid)and acetonitrile(97/3,V/V),injection volume 60 μL,the flow rate 1 mL·min-1 and detection wavelength 284 nm.Standards:xanthine 100 μmol·L-1 and uric acid 50 μmol·L-1;control group:xanthine 200 μmol·L-1 without combination of 0.1 g·L-1 human liver S9;experimental group:xanthine 200 μmol·L-1 with combination of 0.1 g·L-1 human liver S9.
对于人肝XO,酶促反应遵循经典的米氏动力学,Km值为4.71 μmol·L-1,Vmax值为0.08 μmol·min-1·g-1(图3)。

Fig.3 Michaelis-menten curve of S9 mediated xantihne oxidation.Xanthine(0,2,4,8,and 16 μmol·L-1)was incubated with S9(0.1 g·L-1)at 37 ℃for 90 min.±s,n=3.
在S9孵育体系中,与DMSO组比较,维生素K31,10 和100 μmol·L-1均表现出一定的激活能力(P<0.01),其中,10和100 μmol·L-1组XO活性提高>2倍(P<0.01),而别嘌呤醇和非布索坦抑制XO 活性(P<0.01)(图4)。表明维生素K3具有激活XO 增加其代谢黄嘌呤产生尿酸的能力。
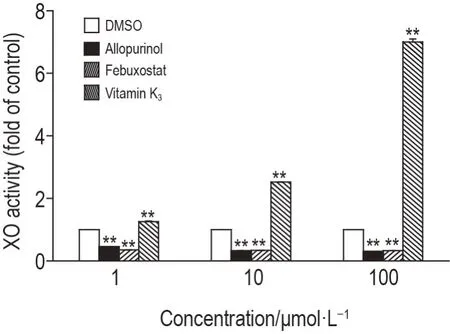
Fig.4 Activation of XO in S9 incubation system supplemented with vitamin K3 or control compounds allopurinol or febuxostat(1,10 and 100 μmol·L-1).Vitamin K3,allopurinol or febuxostat were incubated with S9(0.1 g·L-1)and xanthine 5 μmol·L-1 at 37 ℃for 90 min.XO activity is expressed as fold change over the vehicle control(DMSO).±s,n=3.**P<0.01,compared with vehicle control group.
2.2 维生素K3对XO的激活作用
维生素K3对XO 的EC50值为32.0 μmol·L-1,Emax值为7.73,非线性拟合数据获得的相关系数R2值为0.9942(图5),表明维生素K3对XO 介导的黄嘌呤氧化反应有激活作用。同时,使用Origin 7.0软件对维生素K3激活XO 作logistic 分析发现,拟合公式为y=A2+(A1-A2)/(1+(x/x0)^p),其中y=XO活性(fold of control),x=log [vitamin K3(μmol·L-1)],A1=1.43277±0.19338,A2=8.3244±0.68649,x0=1.56572±0.10257,p=4.21025±0.8579。拟合数据呈典型S形(图5),说明维生素K3对XO的激活具有浓度依赖性。

Fig.5 Activation effect of vitamin K3 on production of uric acid catalyzed by XO in S9.Xanthine(approaching Km value)was incubated with S9(0.1 g·L-1)and vitamin K3(1,2,5,10,20,50,100,200 and 400 μmol·L-1)at 37 ℃for 90 min.±s,n=3.
2.3 维生素K3对XO 介导的黄嘌呤氧化反应动力学行为的影响
不同浓度维生素K3条件下,XO介导的黄嘌呤氧化反应动力学行为发生改变(表1),具体表现为Km值随维生素K3浓度增加而减小(4.71~1.34 μmol·L-1),而Vmax值随维生素K3浓度增加而增加(0.08~1.31 μmol·min-1·g-1)。维生素K3引起的动力学曲线变化增加了S9 的催化效率(Vmax/Km,17.0~977.6 mL·min-1·g-1)导致尿酸水平升高。如图6所示,Lineweaver-Burk双倒数曲线图的直线相交于第二象限,证实维生素K3对XO的激活特性为混合型。

Tab.1 Effect of vitamin K3 on kinetic parameters of S9 mediated xanthine oxidation.

Fig.6 Lineweaver-Burk of XO activation in S9 by vitamin K3.Vitamin K3 was incubated with S9 0.1 g·L-1 and xanthine at 37 ℃for 90 min.±s,n=3.
2.4 维生素K3通过氢键与XO相互作用
采用AllositePro 预测人肝XO(2E1Q)晶体结构中的变构位置,并进一步对接维生素K3。结果表明,维生素K3在变构位点结合良好(图7),其与人肝XO 的结合能最高得分-5.39 kcal·mol-1。该值小于黄嘌呤与人肝XO的结合能(-5.12 kcal·mol-1),表明维生素K3与人肝XO的结合能力强于底物黄嘌呤。
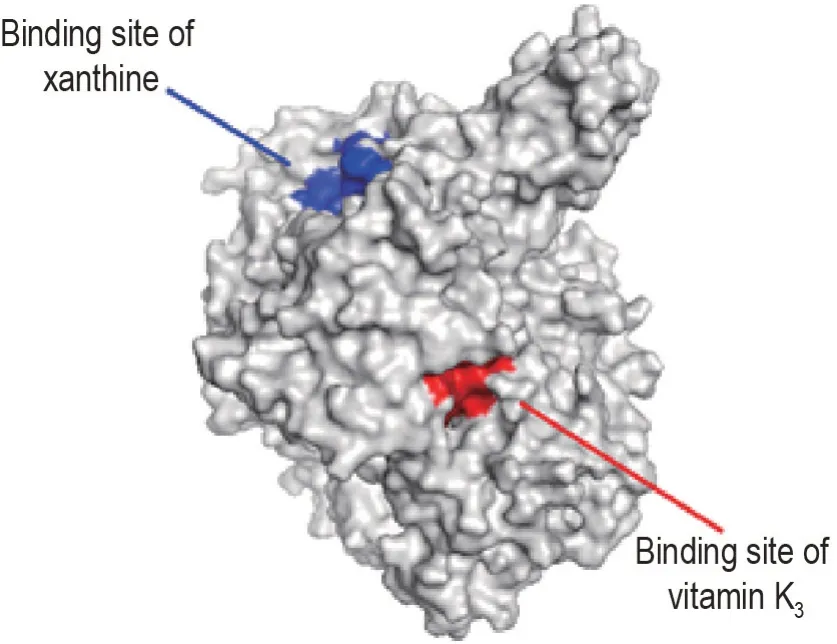
Fig.7 Surface representation of three-dimensional crystal structure of XO derived from human(2E1Q).2E1Q bound to both orthosteric substrate xanthine and the allosteric activator vitamin K3.Orthosteric and allosteric sites are highlighted in blue and red,respectively.
进一步分析发现,2E1Q 的变构位点由氨基酸残基Asp595,Arg599,Ser605,Leu606,Arg607,Pro676,Thr679,Arg825 和Met827 组成(图8)。维生素K3与蛋白质2E1Q 的残基Arg599 和Ser605的侧链形成氢键,且氢键长度分别为0.278 和0.296 nm(图8)。

Fig.8 3D(A)and 2D(B)result of interactions of vitamin K3 with allosteric site of XO.The figures shown above are the distance(Å)of hydrogen bond between vitamin K3 and the key amino acids of XO.
3 讨论
本研究发现,维生素K3具有激活XO 升高尿酸作用,且该作用存在浓度依赖性。目前,尽管维生素K3(假设完全由维生素K1转化而来)的体内暴露量(0.47~4.33 nmol·L-1)[18]未超过本研究中的EC50值(32.0 μmol·L-1),但考虑到每天经常食用含有维生素K 的水果(200~400 g),以及成年人的肠道容积(4~5 L),维生素K仍可能通过长期低浓度暴露,导致尿酸水平失衡。因此,本研究提示脂溶性维生素K3在体内的累积可能是导致临床高尿酸血症的关键影响因素,并可能进一步增加患痛风风险。此外,动力学研究显示,维生素K3可通过影响底物黄嘌呤与XO 的亲和力(Km值和Km值减小,亲和力增大)来影响其催化能力。Lineweaver-Burk 双倒数曲线结果还证实,维生素K3对XO 的激活可能为混合型,表明维生素K3可能在影响底物与XO 结合的同时,也影响了XO 空间构型的变化,最终导致XO催化效率上调。
同时,结合体外激活动力学结果,本研究推测维生素K3可能通过变构作用调控XO 活性,可能为XO 的变构激活剂。变构作为最重要的自然发生机制之一,可通过诱导靶生物分子的构象变化和功能调节来影响生物学功能[19]。为此,本研究借助AllositePro 预测变构位点并利用Autodock 对维生素K3的XO 激活机制作进一步解析。根据分子对接结果,同时结合XO 分子结构〔由约145 ku的2个相等的亚基组成,每个亚基包含1 个钼酸盐催化亚基(Moco,约85 ku)、1 个黄素腺嘌呤二核苷酸(FAD,约40 ku)辅因子和2 个Fe/S 簇(2Fe-2S,约20 ku)[20-21]〕的氨基酸序列信息,可知维生素K3对XO 的别构调控可能是通过竞争人源XO 的Moco 结构域(维生素K3与XO 的结合部位包含于Moco 结构域),并与XO 酶变构位点Arg599 和Ser605 形成氢键相互作用而引起的。与许多变构剂相同,维生素K3的XO 结合位点远离XO 活性中心[19],抑制剂别嘌呤醇则与底物黄嘌呤竞争性结合XO 的活性中心。因此,本研究可为维生素K3作用的变构位点的药物设计提供理论基础。
近年来,针对维生素K3的研究日益增加。目前维生素K3不仅具有广泛的生理和药理活性(如促进凝血、治疗骨质疏松[5]、抗炎[19]和抗癌[2,22]等),也作为膳食营养品广泛使用。然而,这些研究主要针对疾病防治,仍缺乏对其潜在不良影响的探究。本研究揭示的维生素K3引起的尿酸升高的潜在不良影响,可为维生素K3作为膳食保健品以及抗炎、抗癌等疾病的治疗药物提供风险预警,以促进其安全引用。此外,本研究观察到的维生素K3的XO 激活作用,不仅拓展了XO 激活剂的种类,丰富了对维生素K3功能的研究,同时也为维生素K3在更多领域的合理应用提供了理论依据。但实验尚有不足,还需要进行细胞及动物实验等研究,进一步考察维生素K3在体内的XO激活作用。
——从偶然发现到合理设计

