多光谱法和分子对接模拟法研究茶碱和胃蛋白酶的相互作用
王晓霞, 马力通, 孙吉盛, 聂智华, 赛华征, 成建国, 段建国
1. 内蒙古科技大学化学与化工学院, 内蒙古 包头 014010
2. 生物煤化工综合利用内蒙古内蒙古自治区工程研究中心, 内蒙古 包头 014010
3. 清华大学生命科学学院, 北京 100084
引 言
茶碱(Theophyline, TPL)是黄嘌呤类衍生的化合物, 具有利尿、 强心和松弛支气管平滑肌等功效。 胃蛋白酶(Pepsin, PEP)是一种促进食物中蛋白质消化的酶类, 将蛋白质分解为小的肽片段, 方便食物消化, 是人体内重要的消化类蛋白酶[1]。 研究药物与蛋白质的相互作用机制及结合模式, 对于阐明药物的代谢与运输方式、 了解蛋白质的基本结构和作用都有着重要意义。 药物被摄入人体后, 极大可能会与PEP发生反应, 因此探究药物中的化学分子与PEP的作用机制, 对于药物的发现、 药物的设计、 提升药物疗效以及降低药物副作用奠定了一定的理论基础, 让药物设计更加高效、 可控。 为了更全面了解蛋白质转运药物的形式与代谢过程以及药物与蛋白质相互作用的化学性质, 通过多光谱法和分子对接模拟技术探究TPL与PEP的相互作用机理。
1 实验部分
1.1 仪器与试剂
紫外-可见分光光度计(L6S, 上海仪电分析仪器有限公司); 傅里叶变换红外光谱仪(SPECTRUM 3, 铂金埃尔默企业管理有限公司); 荧光分光光度计(F-7100, 日本日立); 圆二色光谱仪(Chirascan plus, 英国应用光物理公司)。
茶碱(TPL, 质量分数≥99%, 内蒙古佳合药业有限公司); 胃蛋白酶(PEP, 纯度≥99%, 合肥千盛生物有限公司); 柠檬酸(质量分数≥99%, 天津市恒兴化学试剂制造有限公司); 柠檬酸钠(质量分数≥99%, 天津市恒兴化学试剂制造有限公司); 氯化钠(NaCl, 质量分数≥99.4%, 天津化学试剂三厂)。
配制pH为2.0的柠檬酸-柠檬酸钠缓冲溶液, 1×10-4mol·L-1的TPL溶液和含有0.5 mol·L-1NaCl且pH 2.0的5×10-4mol·L-1的PEP溶液。
实验室所有用到的试剂全部为分析纯, 实验所用的水均为二次蒸馏水。
1.2 方法
1.2.1 荧光光谱的测定
取9支10 mL比色管, 分别加入1 mL浓度为5×10-4mol·L-1的PEP溶液, 再分别加入0、 0.5、 1.0、 1.5、 2.0、 2.5、 3.0、 3.5和4.0 mL浓度为1×10-4mol·L-1的TPL溶液, 用蒸馏水定容至刻度线, 摇匀、 静置20 min。 恒温水浴锅水浴20 min, 分别在298、 303和308 K用荧光光度计测定荧光光谱。 在荧光激发波长为280 nm, 发射波长在290~550 nm, 狭缝宽度均为5 nm, 扫描速度为1 200 nm·min-1条件下, 测量三个温度下PEP的荧光光谱。
1.2.2 同步荧光光谱的测定
取9支10 mL比色管, 分别加入1 mL浓度为5×10-4mol·L-1的PEP溶液, 向其分别加入0、 0.5、 1.0、 1.5、 2.0、 2.5、 3.0、 3.5和4.0 mL浓度为1×10-4mol·L-1的TPL溶液, 用蒸馏水定容至刻度线, 摇匀、 静置20 min放入298 K下的恒温水浴锅水浴20 min, 待测。 参数设置Δλ=15 nm和Δλ=60 nm, 激发波长λex扫描范围250~550 nm, 狭缝设置为5, 扫描速度1 200 nm·min-1, 测量并记录PEP的荧光光谱。
1.2.3 三维荧光光谱的测定
取2支10 mL比色管, 一支加入1 mL浓度为5×10-4mol·L-1的PEP溶液, 用蒸馏水定容至刻度线; 另一支比色管加入1.0 mL浓度为5×10-4mol·L-1的PEP溶液, 2.0 mL浓度为1×10-4mol·L-1的TPL溶液, 蒸馏水定容至刻度线, 摇匀、 静置20 min。 放入298 K下的恒温振荡器下加热20 min, 待测。 参数设置为激发波长λex范围200~500 nm, 发射波长λem范围200~500 nm, 狭缝设置为5, 扫描速度2 400 nm·min-1, 测量三维荧光光谱。
1.2.4 紫外光谱的测定
取9支10 mL比色管, 分别加入2 mL浓度为1×10-3mol·L-1的PEP溶液, 在分别加入0、 0.5、 1.0、 1.5、 2.0、 2.5、 3.0、 3.5和4.0 mL浓度为1×10-4mol·L-1的TPL溶液, 用蒸馏水定容至刻度线, 摇匀、 静置20 min后。 放入298 K下的恒温振荡器下加热20 min, 待测。 设置紫外光谱仪参数, 扫描范围200~400 nm, 使用石英比色皿, 在298 K时进行紫外光谱测量。
1.2.5 结合距离的测定
在三支比色管, 分别配制成PEP溶液、 TPL溶液与PEP-TPL混合溶液, 浓度全部为1.0×10-5mol·L-1, 第三个混合体系中TPL与PEP浓度比1∶1。 298 K恒温水浴锅静置20 min。 对TPL溶液进行紫外测定, PEP溶液与PEP-TPL溶液进行荧光测定。 荧光光度计参数设置为激发波长λex=280 nm, 发射波长λem范围290~550 nm, 狭缝设置为5, 扫描速度1 200 nm·min-1。 紫外可见分光光度计参数设置为扫描200~500 nm波长范围。
1.2.6 红外光谱的测定
称取一定质量的PEP及TPL固体干燥粉末, 按照PEP与TPL的质量比为1∶0及2∶1混合, 放入研钵中充分混合并研磨5 min, 准确称量0.100 0 g KBr后加入研钵充分研磨, 压片处理, 设定扫描范围4 500~500 cm-1, 进行红外光谱扫描。
1.2.7 圆二色光谱的测定
取两支比色管, 一支取一定浓度的PEP溶液; 另一支取同样浓度的PEP与一定浓度的TPL混合液, 得到PEP与TPL浓度比为1∶3的溶液待测。 设置圆二色谱仪器参数, 设定带宽Bandwidth为1.0 nm, 设定光谱扫描范围180~260 nm, 设置单个数据点的采样时间Time-per-point为0.5 s, 以配制好的pH 2.0的柠檬酸-柠檬酸钠缓冲溶液为参比液, 分别记录PEP与TPL-PEP体系的圆二色光谱数据。
1.2.8 分子对接模拟技术
运用ChemDraw 18.0软件作TPL结构图, 在蛋白质数据库中RCSB Protein Data Bank中找到PEP的晶体结构, 利用网页程序Z-Dock(http://zdock.umassmed.edu)进行结合位点的选择和绑定点残留的选择, 利用分子对接软件Accelrys Discovery Studio3.5采用CDOCKER模块进行分子对接模拟。
2 结果与讨论
2.1 TPL与PEP的荧光猝灭光谱
PEP中具有三种可以发射荧光的芳香氨基酸, 分别是色氨酸、 苯丙氨酸与酪氨酸。 其产生的荧光强度可以用于检测PEP与药物作用的相关研究[2]。 图1(a—c)分别是298、 303和308 K温度时, 相同浓度的PEP随着TPL浓度增大荧光强度的变化情况。 由图1(a)可知, 在激发波长为280 nm, 发射波长为342 nm时PEP产生了荧光发射峰。 从图1可以看出, 随着TPL浓度逐渐增大, PEP的荧光强度呈规律性下降趋势, 其发射峰位置没有明显变化, 由此可见, 两者发生了反应, TPL对PEP的荧光产生猝灭作用。

图1 三个温度下TPL-PEP体系荧光光谱
本实验采用Stern-Volmer方程[3]判断TPL对PEP的猝灭作用类型, 方程如式(1)
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
(1)
式(1)中,F0为未加入猝灭剂(TPL)时PEP的荧光强度,F为加入猝灭剂(TPL)后TPL-PEP体系的荧光强度,Ksv为Stern-Volmer动态猝灭常数, [Q]是猝灭剂(TPL)的实际浓度,Kq是动态荧光猝灭速率常数, 各类荧光猝灭剂对生物大分子的最大动态荧光猝灭速率常数约为2.0×1010L·(mol·s)-1,τ0为没有猝灭剂下生物大分子的平均寿命为10-8s。
对所研究TPL在298、 303和308 K温度下对PEP荧光强度的影响, 以F0/F值为纵坐标, [Q]为横坐标作图, 得到Stern-Volmer曲线, 见图2。 由图2得到动态猝灭常数Ksv与动态荧光猝灭速率常数Kq于表1。 由表1得知Stern-Volmer动态荧光猝灭速率常数Kq远大于最大动态荧光猝灭速率常数2.0×1010L·(mol·s)-1, 证明TPL通过静态猝灭的方式猝灭PEP的荧光。 通过表1可知不同温度下的猝灭常数Ksv(L·mol-1): 2.221×104(298 K), 2.057×104(303 K), 2.018×104(308 K)。 随着温度升高, TPL-PEP体系中荧光猝灭常数Ksv数值减小, 进一步证明TPL是通过静态猝灭方式减弱PEP的荧光强度[4]。
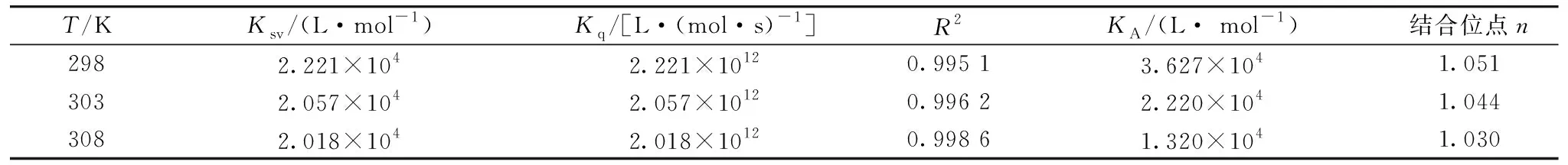
表1 Stern-Volmer线性方程和相关系数

图2 三个温度下TPL-PEP的荧光猝灭的Stern-Volmer曲线
2.2 TPL与PEP的结合常数与结合位点数
由于TPL是通过静态猝灭的形式猝灭PEP的荧光, 可通过运算静态猝灭双对数公式[5]得到TPL与PEP的结合位点数与结合常数。
lg[(F0-F)/F]=lgKA+nlg[Q]
(2)
式(2)中,KA是TPL与PEP的结合常数,n是TPL与PEP的结合位点数。 以lg[(F0-F)/F]为纵坐标, lg[Q]为横坐标作图(见图3), 对所得直线进行拟合, 得到的斜率与截距分别为TPL与PEP的结合常数与结合位点数, 见表1。 由表1可知, 在298 K时TPL-PEP体系的结合常数KA=3.627×104L·mol-1; 结合位点数n=1.051。 在303 K时,KA=2.220×104L·mol-1;n=1.044。 在308 K时,KA=1.321×104L·mol-1;n=1.300, 结合常数的数量级都在104, 说明TPL与PEP形成的复合物较稳定; 结合位点数都接近1, 说明结合产生的复合物为1∶1型。KA(298 K)>KA(303 K)>KA(308K), TPL-PEP体系结合常数KA与温度负相关, 与猝灭常数Ksv的规律一致, 进一步证明TPL通过静态猝灭方式减弱PEP的荧光强度。
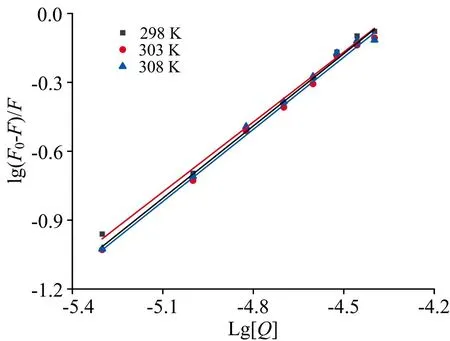
图3 三个温度下lg[(F0-F)/F]-lg[Q]图
2.3 TPL与PEP的结合距离
根据Förster’s偶极-偶极非辐射能量转移理论, 能量供体PEP与能量受体TPL之间的最大结合距离小于7 nm, 并且PEP的荧光发射光谱与TPL的紫外吸收光谱有重叠部分时, PEP分子与TPL分子必然会产生非辐射能量转移, 从而使TPL猝灭了PEP的荧光。
(3)
(4)
(5)
式(3)—式(5)中,r为PEP与TPL的结合距离;R0为能量转移效率E为50%时的临界距离;k2为空间取向因子, 取供能体与受能体各项随机分布的平均值2/3;φ为PEP的荧光量子产率一般取蛋白质中色氨酸量子产率的0.15[6];n为介质折射指数, 通常取有机物和水的平均值1.36;J为PEP的荧光光谱和TPL的紫外光谱的重叠积分;FD(λ)为PEP在把波长为λ时的荧光强度;εA(λ)为TPL在波长为λ时的摩尔吸收系数。
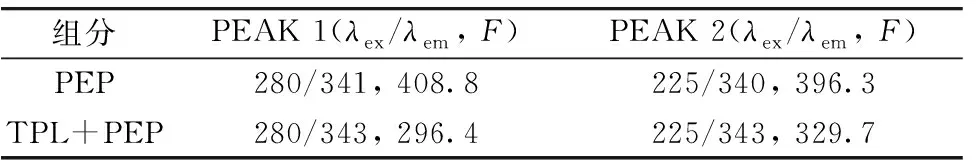
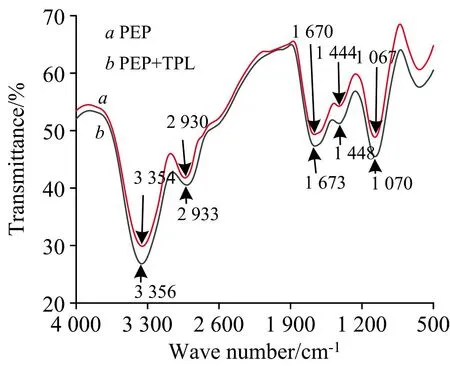
图4为PEP和TPL在浓度比为1∶1时298 K下PEP的荧光曲线与TPL的紫外吸收曲线重叠图, 由式(3)—式(5)求得PEP与YPL重叠积分J=2.144×10-13cm3·(mol·L-1)-1,E=45.54%,R0=4.203 nm,r=4.330 nm。 0.5R0 图4 PEP的荧光光谱(a)与TPL的紫外吸收光谱(b)重叠图 TPL与PEP结合反应的作用力可以通过Ross理论[7]判断: 当ΔH>0, ΔS>0时, 作用力为疏水作用力; ΔH<0, ΔS<0时作用力为氢键与范德华力; ΔH<0, ΔS>0时, 作用力为静电作用力。 ln(K2/K1)=ΔH(1/T1-1/T2)/R (6) lnK=-ΔH/RT+ΔS/R (7) ΔG=ΔH-TΔS=-RTlnKA (8) 式(6)—式(8)中,K为TPL与PEP的结合常数; ΔH为TPL与PEP的焓变; ΔS为TPL与PEP的熵变; ΔG为TPL与PEP的吉布斯自由能;T为TPL与PEP反应温度;R为气体常数, 取8.314 J·(mol·K)-1。 根据Van’t Hoff公式, 可以计算出298、 303和308 K下的热力学参数。 焓变ΔH=-81.59 kJ·mol-1, 熵变ΔS=-186 J·(mol·K)-1, 吉布斯自由能ΔG=-26.17 kJ·mol-1(298 K)、 ΔG=-25.24 kJ·mol-1(303 K)、 ΔG=-24.31 kJ·mol-1(308 K)。 可知ΔH<0, ΔS<0, 可推测TPL和PEP主要的作用力为氢键和范德华力, ΔG<0说明TPL和PEP的静态猝灭为自发、 放热(ΔH<0)的过程。 分子对接技术可使蛋白质受体与药物配体间快速对接并研究两者之间的相互作用力。 采用分子对接模拟技术探究TPL配体与PEP受体的作用力类型、 作用距离以及对接模式, 通过网页程序Z-DOCK3.0.2模拟出TPL与PEP的分子对接模拟图, 在运用Discovery Studio 2016 Client软件分析出两者结合的相关数据。 见图5(a)、 (b)和(c)。 图5 TPL和PEP结合的分子对接结构模型图 由图5(a)、 (b)可知, PEP的三维结构呈心形, TPL分子位于PEP的表面活性口袋中, 为了更加简单、 清晰地观察到TPL与PEP的结合部位所处的微环境, 作出TPL周围氨基酸残基2D/3D示意图, 见图5(c)。 由图5(c)可知TPL周围氨基酸残基有GLU13、 VAL30、 TRP39、 TYR75、 GLY76、 THR77、 GLY78、 PHE111、 LEU112、 PHE117、 ILE120、 GLY217。 TPL与其中的氨基酸残基THR77、 GLY217形成氢键(Conventional hydrogen bond), 键长为4.58和4.51 Å, 与氨基酸残基GLY217形成碳氢键(Carbon hydrogen bond); 与氨基酸残基GLU13、 VAL30、 TRP39、 GLY76、 GLY78、 PHE117之间的作用力为范德华力(Van der Waals); 与氨基酸残基TYR75、 LEU112、 ILE120、 PHE111之间存在疏水作用力, 键长为3.85、 5.98、 5.63和6.22 Å, 以Pi-Alkyl、 Pi-Sigma、 Pi-Pi T-shaped形式存在[8]。 表明TPL与PEP间结合作用力较多且结合稳定, 两者之间的作用力主要是氢键与范德华力, 进一步证明TPL使PEP的二级结构发生改变。 2.6.1 TPL与PEP作用的紫外光谱分析 紫外吸收测量是探索结构变化和理解复合物的形成的一种容易操作而可观的表征, 可以探究药物小分子对蛋白质大分子的二级结构的影响。 本实验做了TPL-PEP混合体系的紫外光谱, 见图6。 由图6可知, PEP在274 nm附近有最大吸收峰, 随着TPL加入且浓度逐渐的增大, PEP吸收峰的峰值明显增大, 最大吸收波长从274 nm移动至272 nm, 发生蓝移, 蓝移了2 nm。 表明两者之间能量跃迁方式为n—π*跃迁, 证明TPL与PEP之间发生了反应, TPL影响了PEP的二级结构。 假设TPL通过动态猝灭的机制来猝灭PEP的荧光强度, 那么TPL不会改变PEP的吸收光谱, 但是图6中PEP峰值变化明显, 进一步证明TPL对PEP猝灭机制不是动态猝灭, 而是静态猝灭[9]。 图6 TPL与PEP相互作用的紫外光谱图 2.6.2 TPL与PEP体系同步荧光图谱分析 同步荧光可以提供蛋白质与药物结合后发色团附近微环境的变化情况, 最大发射波长的所有变化都对应着发色团附近极性的改变。 通常情况下, Δλ=15 nm和Δλ=60 nm同步荧光光谱能够分别呈现蛋白质中酪氨酸残基和色氨酸残基特征荧光, 可用于研究药物分子对PEP微环境和构象的影响。 TPL-PEP体系的同步荧光光谱见图7(a)、 (b), 由图7可知, 随着TPL浓度的升高, PEP的同步荧光峰值有下降趋势。 图7(a)中的发射峰位置基本不变, 发射峰的峰型基本不变, 并且TPL对PEP中酪氨酸的荧光猝灭程度小; 图7(b)中发射峰峰型呈现规律性变化, TPL对PEP中色氨酸的荧光猝灭程度大, 发射峰峰位从279.6 nm移动到284.8 nm, 红移了5.2 nm, 猝灭程度大。 表明TPL与PEP间形成了复合物, PEP构象产生改变, 使酪氨酸残基与色氨酸残基附近微环境改变, 极性增大, 亲水性增强, 疏水性减弱; 色氨酸残基的荧光猝灭程度强于酪氨酸残基, 表明TPL与PEP结合时主要集中在色氨酸的残基上。 图7 TPL-PEP溶液同步荧光光谱图 2.6.3 TPL与PEP构象变化影响的三维荧光光图谱分析 三维荧光光谱立体图可以详细展现出被测药品多肽骨架结构的变化情况, 为研究蛋白质结构与组分分布变化提供了依据。 通过三维荧光光谱法运用光谱仪对PEP加入TPL前后的数据, 以处理出的荧光强度数据F为Z轴; 激发波长λex为X轴; 发射波长λem为Y轴, 作PEP、 TPL-PEP混合体系的三维荧光光谱图及等高线图, 见图8(a)、 (b)。 三维荧光光谱图有两类峰, 一种是“驼峰”状的荧光峰(如PEAK 1、 PEAK 2), 峰1代表了色氨酸残基与酪氨酸残基的荧光光谱特征, 峰2代表了肽链骨架结构, 峰值强度与蛋白质的二级结构联系紧密; 另一种是“山脊”状的瑞利散射峰: PEAK a(λex=λem)、 PEAK b(2λex=λem)。 图8 PEP、 TPL-PEP溶液的三维荧光光谱图及等高线图 加入TPL后, PEP荧光峰与瑞利散射峰的位置与峰形基本没有变化。 由表2可知, 加入TPL前后, PEP的瑞利散射峰PEAK a、 PEAK b的荧光强度减弱趋势较明显。 PEAK 1的荧光强度峰值(λex/λem,F)从(280/341, 408.4)改变到(280/343, 296.4), PEAK 2的荧光强度峰值(λex/λem,F)从(225/340, 396.3)改变到(225/343, 329.7), PEAK 1的最大发射波长从341 nm移动至343nm, 峰位红移了2 nm, 说明TPL使PEP中的色氨酸残基与酪氨酸残基周围微环境发生改变, 极性增大, 亲水性增强, 疏水性减弱; PEAK 2的最大发射波长从340 nm移动至343 nm, 峰位红移了3 nm, 说明TPL改变了PEP的肽链骨架结构。 通过以上数据及分析结果可知, TPL与PEP表面结合后产生解聚反应, 使蛋白酶的分布更加分散, 蛋白质粒径变小, 从而使PEP荧光强度降低, 进一步说明TPL对PEP的二级结构产生了影响。 表2 三维荧光光谱特征参数 2.6.4 TPL与PEP作用的圆二色谱图分析 通过扫描PEP与TPL-PEP混合体系的圆二色谱可以更加深入地研究TPL对PEP二级结构的影响[10-11], 见图9, 通过图9可知, PEP在190 nm附近有一个负峰, 这是β-折叠(β-sheet)的特征吸收峰, 这个负峰强度的变化可以反映PEP中β-折叠数量的变化, 将所测的圆二色谱数据导入CDNN软件可得到PEP与TPL-PEP的二级结构含量数据, 由数据可知PEP的二级结构主要为β-折叠, 随着TPL的加入且当PEP与TPL的浓度比为1∶3时, PEP中β-折叠的占比从50.2%下降至48.8%; α-螺旋(α-Helix)结构的占比从8.1%上升到8.4%; β-转角(β-turn)的占比从18.3%上升到18.7%; 无规则结构的占比从29.1%上升到29.2%。 上述数据表明TPL在与PEP反应的过程中改变了PEP周围的环境造成了PEP二级结构改变。 图9 TPL与PEP作用的圆二色谱图 3.6.5 TPL与PEP作用的傅里叶红外光谱分析 图10 TPL与PEP的红外光谱图 在模拟生理条件时, 298、 303和308 K三种温度下TPL对PEP具有荧光猝灭作用, 形式为静态猝灭。 根据Förster’s偶极-偶极非辐射能量转移理论得知结合距离r=4.330 nm<7 nm, 表明PEP与TPL间会发生非辐射能量转移。 分子对接模拟表明TPL分子位于PEP的表面活性口袋中, 两者之间结合作用力较多且结合稳定, 作用力主要是氢键与范德华力, 进一步证明TPL使PEP的二级结构发生改变。 三维荧光光谱、 同步荧光图谱、 紫外吸收光谱、 圆二色谱、 红外光谱表明TPL使PEP中的色氨酸残基周围微环境发生改变, 极性增大, 亲水性增强, 疏水性减弱, 说明TPL对PEP的二级结构产生了影响。
2.4 TPL与PEP相互作用的热力学参数和主要作用力
2.5 TPL与PEP的分子对接模拟

2.6 TPL对PEP的二级结构的影响





3 结 论

