磷酸酯基阻燃电解液用于高安全锂硫电池
何孟雪,李一涛,刘亚涛,贾永锋,李 刚,贾 龙,庞全全
1) 北京大学材料科学与工程学院,北京 100871 2) 北京航天自动控制研究所,北京 100854
如今锂离子电池(Lithium-ion batteries)已经成为了最普遍的商用化学储能装置之一,应用场景包括手机等电子产品及电动汽车等[1-2]. 而随着电动汽车和电网储能需求的快速增长,迫切需要高能量密度、高安全性的电池[3-4]. 锂(Li)金属由于其极高的理论比容量(~3860 mA·h·g-1),低密度(0.59 g·cm-1)和最低的负电化学电位(-3.04 V (vsSHE)),成为了一种理想型的负极材料[5-6]. 而单质硫(S)的理论比容量高达1672 mA·h·g-1,配合Li 金属负极组装的锂硫(Li–S)电池能够获得超高的能量密度,故受到研究人员的广泛关注[7-9]. 此外因为S 元素在地球上具有丰度高、无毒、且价格低廉的优点,所以Li–S 电池也被认为是最有希望的下一代高能量密度二次电池之一,具有极高的商业价值[10]. 如何发展具有高安全性和高能量密度的下一代电池至关重要.
尽管Li–S 电池有巨大的研究潜力,但电池的商业化进程却受到很多因素的制约. 首先,S 电极面临电导率差,体积膨胀及多硫化锂穿梭等问题,从而导致硫的利用率低,电极粉碎,自放电等现象,进而恶化电池的循环寿命. 通过加入非活性导电材料,例如多孔碳,可以在充电和放电过程中提供必要的电子传输路径并作为体积缓冲剂,缓解活性材料膨胀/收缩所引起的应变[11-12]. 另外,金属锂负极也面临不均匀的电沉积及锂枝晶生长等问题,不稳定的界面膜导致电极界面阻抗不断增加,从而增加电池内阻,使电池快速达到截止电压,造成容量衰减. 此外,电池的安全性也是商业应用中需要特别关注的因素. 传统的Li–S 电池电解液具有强烈的挥发性和易燃性,锂枝晶的生长容易刺穿隔膜导致电池短路,引发一系列热失控反应甚至火灾或爆炸[13]. 传统的解决方式包括使用不燃的离子液体、耐热型隔膜、固态电解质等,但又面临离子传输缓慢、电解质界面接触不良等问题. 随着近年来大家对电池安全性的关注日益提升,对阻燃型电解液的探索也在增多[14-15].
以硫化聚丙烯腈(PAN/S)为正极活性物质的电池在寿命上具有较大的优势. 在电解液的选择上较为宽泛,由于不需要考虑多硫化锂的溶解问题,在该体系中可以使用磷酸酯类电解液. 而磷酸酯基电解液具有很好的阻燃特性,其在受到高温后,气态的溶剂分子会释放出含P 的自由基,并结合H 自由基从而阻止燃烧链式反应的进行,达到阻燃的效果[16]. Chen 等[17]以磷酸三甲酯(TMP)为主溶剂配制了1.6 mol·L-1LiFSI/TMP-3HFE 电解液,在阻燃的同时该电解液也表现出了优秀的倍率性能,在5C 倍率循环1000 圈后容量保持率高达75%. Yang 等[18-19]配制了以磷酸三乙酯(TEP)为主要溶剂的阻燃电解液,分别探究了阻燃电解液以1,1,2,2-四氟乙基2,2,3,3-四氟丙基醚(TTE)和氟代碳酸乙烯酯(FEC)作为共溶剂后的电池性能. 除此之外,磷酸酯类溶剂还可以当做阻燃添加剂来降低电解液的自熄灭时间(SET),Wang 等[20]在商用的EC/DMC 电解液中加入了质量分数15%的三(2,2,2-三氟乙基)亚磷酸酯(TTFP)将电解液的SET值降到了0 s∙g-1.
磷酸酯基阻燃溶剂多为短链分子,例如TMP、TEP 等分子,捕捉燃烧自由基的能力较强,不管是作为主溶剂还是阻燃添加剂都具有优良的阻燃效果. 但此类磷酸酯基电解液通常面临黏度较大、与锂金属负极兼容性较差的问题,在作为电解液后虽然提高了阻燃特性,但往往会降低电解液的离子电导率并加速电池容量衰减[15]. 高浓度电解液的发展使得磷酸酯基溶剂可以直接作为电解液的主溶剂或单一溶剂来配置电解液,并已经应用于锂离子和钠离子电池中[21-24]. Jiang 等[25]制备了基于TEP 溶剂的阻燃电解液,显著提升了层状镍钴锰酸锂(NCM811),磷酸铁锂(LFP)及钛酸锂(LTO)等多种电极的高温循环稳定性. Gu 等[26]以TFP 作为共溶剂制备了阻燃电解液,令石墨/LiNi0.5Co0.2Mn0.3O2全电池展示了良好的高温循环稳定性. 可见磷酸酯阻燃剂在提升电池安全性和高温锂离子电池性能等方面具有良好的应用价值.
尽管TFP 溶剂在改善电解液阻燃特性及电极界面稳定性具有突出表现,但其在锂硫电池中的应用有待开发,特别是其对金属锂及硫正极的稳定性和机理. 另外,基于TEP 的高浓及局部高浓电解液对硫正极的反应路径及锂金属的稳定性,仍有待于深入研究,以完整描绘磷酸酯阻燃电解液在锂硫电池上的应用. 因此,基于以上研究现状,本文章对高浓度TEP 电解液在Li–PAN/S 电池中的应用展开了深入研究,并以同样的Li 盐摩尔比和TTE 稀释梯度横向对比了TEP 和TFP 基局部高浓度电解液,详细解析了对两种溶剂分子在电池循环过程中的界面反应.
1 实验部分
1.1 电解液制备
双氟甲磺酰亚胺锂(LiFSI)在使用前通过玻璃干燥仪在130 ℃真空条件下干燥24 h,所用溶剂TEP、TFP、氟代醚(TTE)在使用前使用分子筛除去痕量水分,静置72 h 后进行电解液配制.
不同稀释比例的TEP/TTE、TFP/TTE 电解液在手套箱中配制,如表1.
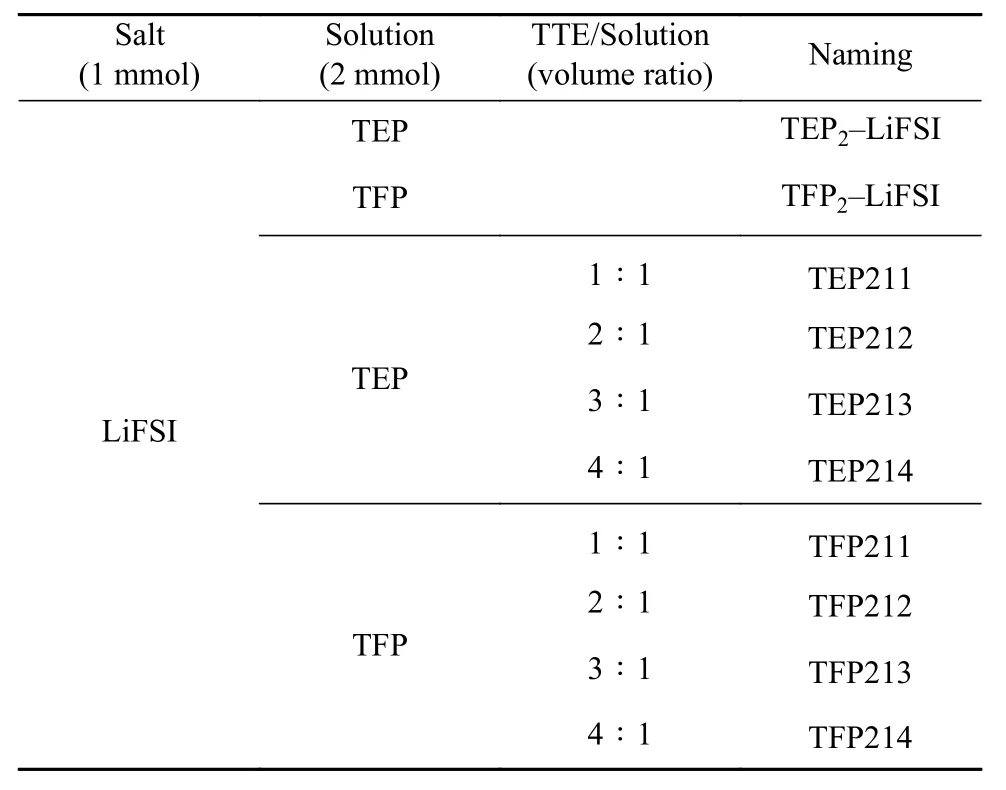
表1 磷酸酯基电解液配制与命名Table 1 Preparation and naming of phosphate-based electrolytes
1.2 硫化聚丙烯腈(PAN/S)正极材料的制备
通过焙烧法制备PAN/S 正极,具体过程如下:称取1.2 g 升华硫(S)和0.3 g 聚丙烯腈(PAN)粉末至玛瑙研钵中,研磨15~20 min 至混合均匀. 将研磨好的PAN/S 粉末放入长方形坩埚,用坩埚盖盖住其2/3,放入管式炉的石英管中. 用高纯氩气清洗10 min 石英管后,以2 ℃·min-1的速率升温至300 ℃,保温5 h 后自然降至室温,得到疏松的块状黑色固体. 将该固体在玛瑙研钵中研磨成粉即得到PAN/S 正极活性材料.
1.3 正极极片制备
称取1 g 聚偏氟乙烯(PVDF)和19 g N-甲基-2-吡咯烷酮(NMP)于玻璃瓶中,磁力搅拌24 h,得到透明且黏稠的5%质量分数 PVDF 分散液. 称取160 mg PAN/S 正极粉末、20 mg Super P 和400 mg 5%质量分数 PVDF 分散液至小烧杯中,补加1~1.5 mL NMP 溶剂,磁力搅拌12 h,得到均匀的正极浆料. 将正极浆料倾倒在涂碳铝箔上,用500 μm 的刮刀摊平,放入鼓风干燥箱中60 ℃干燥12 h. 干燥后将极片切成10 mm 直径的小圆片,依次称取质量后,在60 ℃条件下真空干燥12 h,取出后迅速放入手套箱中.
1.4 纽扣电池制备及测试
所有的CR2032 电池零件、Celgard 2500 隔膜等材料经过70 ℃干燥12 h 以上放入手套箱,维持手套箱的水、氧值在10-8mol∙L-1以下. 对于Li–PAN/S全电池,以负极壳、弹片、垫片、Li 片、隔膜、电解液、正极片、正极壳的顺序组装. 对于Li||Cu 半电池,使用直径为16 mm 的铜箔作为工作电极,置于正极侧. 对于Li||Li 对称电池,使用两块0.5 mm 厚的垫片分别负载两块Li 片,以任意Li 片作为工作电极置于正极侧. 电池的恒流充放电测试使用Neware 公司型号为CT2001A 的电池测试系统对电池进行性能测试,以此对比不同正极、不同电解液对电池性能的影响.
1.5 物理化学表征
本论文中使用Thermo Fisher 公司型号为Thermo Scientific K-Alpha 的X 射线光电子能谱仪对电池循环后的正、负极界面进行元素含量、化学键等分析. 所得到的测试结果以C 1s 结合能284.8 eV作为能量标准进行校正.
2 结果与讨论
2.1 电解液特性研究
通过直接点火分别测试TEP 和TFP 基电解液的阻燃特性. 如图1(a)和(b)所示,TEP 与TFP 基电解液在用火焰灼烧后均未出现燃烧现象,展示了良好的不燃性以及对玻璃纤维隔膜的阻燃特性.在灼烧过程中,观察到电解液不断蒸发并冒出少量烟;6 s 后,电解液蒸发殆尽,隔膜表面变得十分干燥,并在火焰直接灼烧的边缘部分出现焦黑,同时伴有大量白烟. 而商用碳酸酯电解液(图1(c))在接触火焰后迅速延烧,4 s 时火焰达到最大,燃烧14 s 后火焰逐渐熄灭. 说明与商用碳酸酯电解液相比,TEP 与TFP 两种电解液在未耗尽时均能够稳定发挥阻燃的功能,因而在密闭体系的Li–S 电池中不直接接触到明火导致电解液蒸发以及电解液未反应耗尽的情况下,磷酸酯基电解液可以实现十分安全的电池循环.

图1 不同电解液的点火测试照片. (a) TEP212;(b) TFP212;(c) 商用碳酸酯电解液Fig.1 Ignition test of different electrolytes: (a) TEP212; (b) TFP212;(c) commercial carbonate electrolyte
2.2 高浓度TEP 电解液电化学性能
首先测试了TEP2–LiFSI 高浓度电解液在Li–PAN/S 全电池中的性能表现,图2(a)展示了硫载量为0.7 mg·cm-2时电池在0.1C(1C=1675 mA·h·g-1)倍率下的循环稳定性,该电池具有十分优异的循环稳定性. 其首圈放电比容量高达2129.6 mA·h·g-1;从第二圈开始,电池的放电比容量在经过小幅度降低后开始持续增长,在80 圈时依然保持1666 mA·h·g-1的超高比容量,对应高达99.6%的S利用率,并且该电池的库伦效率一直在100%附近保持微小的波动. 图2(b)展示了该电池在不同循环圈数的充放电曲线,如图所示,第一圈放电曲线电压较低,并展示了远高于理论比容量的放电能力. 这是因为PAN/S 在首圈放电过程中,除了发生硫的锂化过程外,另有一部分Li 离子以插层的方式进入PAN 的共轭骨架中,贡献额外的放电容量,但此过程通常是不可逆的[20],因而伴随着极不正常的首圈库伦效率. 另外,该Li 离子的嵌入过程也提高了正极骨架的离子电导率,从而改善了电极的充放电动力学. 此外电解液在PAN/S 正极表面发生成膜反应也会贡献部分额外容量,该过程有助于在电极表面形成较为稳固的固/液界面. 在随后的放电过程中,可以观察到放电电位不断减小,这是正极离子电导率改善所带来的性能优化,最为关键的是,第2 圈和第80 圈的放电比容量基本保持一致,展示了稳定的循环特性. 值得注意的是,该磷酸酯电解液中,PAN/S 电极的放电平台为倾斜的单平台,展示出了固–固转化路径,因此消除了可溶性多硫化锂的穿梭效应,因而电池展现了优异的循环稳定性. 但在常用的醚基电解液中,PAN/S 电极在充放电循环中则会生成可溶性的多硫化锂,从而导致多硫化锂的穿梭,造成活性物质的损失及锂负极的钝化,进而恶化电池寿命[27-28].

图2 TEP2–LiFSI 电解液的电化学特性. Li-PAN/S 电池在0.1C 倍率下的(a)循环特性和(b)充放电曲线;(c) Li//Li 对称电池的极化电压曲线;(d) 图2(c)中选定区域的放大曲线;(e) Li 金属的沉积/剥离效率图; (f) 不同循环次数的沉积/剥离曲线;(g) 图2(f)中选定区域的放大曲线Fig.2 Electrochemical performance of TEP2–LiFSI electrolyte: (a) cycling performance and (b) charge/discharge curves of Li-PAN/S battery at 0.1C;(c) polarization voltage curve of Li//Li symmetrical battery; (d) enlarged curve corresponding to the selected area in Fig. 2(c); (e) deposition/stripping efficiency of Li//Cu cell; (f) deposition/stripping curve with different cycles; (g) enlarged curves corresponding to the selected area in Fig. 2(f)
通过Li||Li 对称电池和Li||Cu 半电池探究了TEP2–LiFSI 电解液中Li 的沉积/剥离特性. Li||Li对称电池的电流密度为0.1 mA·cm-2,面容量为0.1 mA·h·cm-2. 由图2(c)可以看出Li 金属可以在TEP2–LiFSI 电解液中稳定沉积/剥离150 h 以上,并且沉积/剥离过电位也随着循环的进行而减小.100 h 后,过电位低于0.1 V,并且电压曲线较为平稳,如图2(d)所示,说明随着循环的进行,Li 的沉积/剥离效率获得了极大提升,不可逆的Li 损耗也逐渐降低.
图2(e)展示了Li||Cu 半电池的沉积/剥离效率,电流密度为0.2 mA·cm-2,放电面容量为0.5 mA·h·cm-2.从图2(e)可以看出电池的初始库伦效率为92.5%,随着电池循环的进行,库伦效率逐渐升高并稳定在98.7%,展现出了较好的Li 沉积/剥离性能. 由图2(f~g)可以看出,首圈的Li 金属沉积过电位接近-90 mV,而剥离过电位接近88 mV,具有不对称性;50 圈后沉积/剥离曲线变得平坦,且沉积/剥离过电位极其相近,为57 mV,总体极化电压相对于首圈降低了64 mV,体现了较好的沉积/剥离稳定性.
虽然高浓度TEP2–LiFSI 电解液具有较好的全电池和Li 金属半电池性能,但在较高的硫载量和较大的电流条件下,电池的放电容量会有所损失.一方面厚电极的离子电子传输速率会降低;另一方面,由于高浓度电解液较差的离子运输特性,锂负极的沉积剥离表现出较高的极化,会使电池较快到达终止电压,从而降低电池容量. 因此为了提升电解液的离子传输特性,降低电极极化,在接下来的工作中,本文通过向高浓度电解液中添加低极性稀释剂TTE,并探索了不同的TTE 稀释比例对高浓度电解液性能的影响.
2.3 局部高浓度电解液的电化学性能
制备了不同稀释比例的TEP 和TFP 基电解液,并进行循环稳定性测试,电池首先在0.2C 倍率下活化两圈,再以0.5C 的倍率进行循环稳定性测试. 图3 为不同稀释比例的TEP 和TFP 基局部高浓度电解液的循环稳定性,其中正极S 载量约为1 mg·cm-2. 如图3(a)所示,TEP 基电解液的首圈放电比容量都在1800 mA·h·g-1以上[19],并在50 圈之前保持相近的容量衰减速率,在50 圈之后,基于TEP211 电解液的电池容量迅速衰减,80 圈后放电比容量仅剩565.3 mA·h·g-1,这可能是因为在1∶1稀释比例(TTE:TEP,体积比)条件下,电解液的黏度仍旧较大,在0.5C 较大倍率循环过程中随着正负极界面环境的不断恶化,电解液无法再提供足够的离子电导率,导致了电池比容量的快速衰减.与此同时,80 圈后TEP212~TEP214 电解液的放电比容量依次为1009.8、922.4、794.1 mA·h·g-1,随着稀释比例的增加,电池的容量衰减速率逐渐加大,TEP212 对应的2∶1 稀释比例体现出最优的容量保持率.

图3 TEP 基和TFP 基电解液对Li-SPN/S 电池电化学性能的影响. (a)TEP 基和 (d) TFP 基电解液在0.5C 倍率下的循环特性;(b) TEP 基和(e) TFP 基电解液在80 圈时的充放电曲线;基于(c) TEP212 和(f) TFP212 电解液的锂硫电池在不同倍率下的充放电曲线Fig.3 Effect of TEP- and tri(2,2,2-trifluoroethyl) phosphate (TFP)-based electrolytes on electrochemical performance of Li-SPN/S cells. Cycling performance of Li-SPN/S cells in (a) TEP- and (d) TFP-based electrolytes at 0.5C; charge/discharge curves of Li-SPN/S cells at 80 cycles in (b) TEPbased and (e) TFP-based electrolytes; charge/discharge curves of Li-SPN/S batteries based on (c) TEP212 and (f) TFP212 electrolytes at different rates
与TEP 基电解液相比,TFP 基局部高浓度电解液的总体性能较差,从图3(d)中可以看出,2∶1 稀释比例的TFP212 电解液展示出更高的容量保持率. 其中TFP214 电解液的放电比容量在47 圈时由200.6 mA·h·g-1陡降至53.9 mA·h·g-1,并在80 圈时持续衰减至14.2 mA·h·g-1,表现出最差的循环性能,这可能是因为负极侧发生了不均匀的Li 沉积,Li 枝晶最终刺穿隔膜导致了电池的失效. TFP213 电解液的行为模式与TFP214 类似,在79 圈时放电比容量从320.8 mA·h·g-1迅速衰减至46.7 mA·h·g-1,与TFP214 一样的失效机制. 而TFP211电解液则与TEP211 电解液的衰减模式类似,由于较大的电解液黏度导致电池容量迅速衰减. TFP212电解液则展示出了较好的循环性能,在80 圈后仍具有769.1 mA·h·g-1的放电比容量,但其终究不如TEP212 电解液的容量保持率.
图3 (b, e)展示了TEP 和TFP 基局部高浓度电解液在0.5C 倍率下第80 圈的充放电曲线. 从图3(b)中可以明显看出TEP211 电解液在充放电时表现出巨大的极化,这是由电解液过高的黏度而导致的动力学缓慢. 而图3(e)中TFP 基电解液的情况更为糟糕,TFP213 与TFP214 几乎无法发挥出容量,TFP211 也展示了较大的过电位,而TFP212 也仅能发挥出769.1 mA·h·g-1的放电比容量,并表现出远超于TEP212 电解液的极化电压.
进一步对比了TEP212 和TFP212 电解液在0.2C倍率下的充放电曲线以及0.5C 倍率下的第80 圈充放电曲线. 如图3(c, f)所示,在0.2C 倍率下,两种电解液的充放电曲线具有极高的一致性,说明在低倍率条件下两种电解液的电池性能差别不大;但在0.5C 倍率下循环80 圈后两者的充放电极化电压出现了巨大的差异. 其原因可能有两点,首先TFP 溶剂本身的黏度比TEP 溶剂高,在配制成摩尔比为2∶1(溶剂∶LiFSI)的电解液再经2 倍体积的TTE 稀释后,TFP212 的总体黏度仍然比TEP212要高;其次TFP 溶剂分子的支链中有较多的F 原子取代,在电池循环过程中于正负极界面上形成了不均匀的界面层,导致了电池放电比容量的恶化.
2.4 锂金属在局部高浓度电解液中的沉积/剥离行为
Li||Li 电池可以直观地反映Li 金属在电解液中的沉积/剥离行为,在电流密度为0.1 mA·cm-2、面容量为0.1 mA·h·cm-2的条件下测试了TEP212 和TFP212 电解液中金属锂的电化学特性. 如图4(a)所示,在锂的沉积/剥离过程中,TEP212 的过电位始终低于TFP212,此外两者的过电位都呈现逐渐减小的趋势. 图4(b)显示,TEP212 电解液中Li 沉积/剥离初期的过电位约为60 mV,相比于高浓度TEP2–LiFSI 电解液减小了约40 mV,并且TEP212中电压曲线较为平缓,这是因为在稀释体系中Li离子传输更为快捷,且电解液能更好的浸润Li 金属界面并充分发生界面成膜反应;而TFP212 电解液中,初始过电位在80 mV 左右,并且曲线呈现两个峰,第一个过电位峰为Li 金属从不均匀、离子电导率较差的界面膜中剥离所需要克服的能量势垒,因为不均匀的界面膜消耗形成了过多的“死Li”,所以很快进行了第二个峰剥离“新Li”的电化学行为. 在140 h 之后,TEP212 和TFP212 电解液的Li 金属沉积/剥离过电位分别为45 mV 和54 mV,并且曲线都十分平缓,表明在经过长时间的沉积/剥离后,Li 金属的界面趋于稳定,Li 的利用效率也都处于较高水平.
图4 TEP212 及TFP212 电解液中锂金属电化学性能对比. (a) Li//Li 对称电池的极化电压曲线; (b) 图4(a)中选定区域的放大曲线; (c) Li//Cu 电池库伦效率;(d)TEP212 电解液及(e)TFP212 电解液中锂的沉积/剥离曲线,插图为局部放大的曲线Fig.4 Comparison of electrochemical properties of lithium metal in TEP212 and TFP212 electrolytes: (a) polarization voltage curve of Li//Li symmetric battery; (b) enlarged curve corresponding to the selected area in Fig. 4(a); (c) coulombic efficiency of Li//Cu batteries; deposition/stripping curves of lithium in (d) TEP212 electrolyte and (e) TFP212 electrolyte, the illustration is a partially enlarged curve
进一步组装了Li||Cu 半电池,在电流密度为0.2 mA·cm-2、面容量为0.5 mA·h·cm-2的条件下对比了两种电解液中锂沉积/剥离的库伦效率. 如图4(c)所示,TFP212 电解液的库伦效率始终低于TEP212,呈现出不稳定的Li 沉积/剥离;前30 圈循环中库伦效率始终低于90%,90 圈之后库伦效率在95%~97%波动,基本趋于稳定. 而TEP212 电解液的初始库伦效率就达到了95.9%,并且在经过约10 圈的活化之后,库伦效率基本稳定在98%,呈现出稳定的Li 沉积/剥离.
图4 (d, e)对比了第1 圈和第140 圈锂沉积/剥离的电压曲线,如图4(d)所示,TEP212 电解液首圈的沉积过电位为-50 mV,剥离过电位为40 mV,经过140 圈循环之后的总体极化电压降低了30 mV,实现了稳定的Li 沉积/剥离. TFP212 电解液的过电位呈现与TEP212 相反的趋势,首圈的沉积过电位约为-75 mV,并且在剥离初期出现了较高的极化势垒,最高达到75 mV;140 圈循环之后,性能并没有得到较好地改善,沉积/剥离过电位都维持在80 mV左右,与首圈比稍有增加;在140 圈Li 剥离的后期,曲线出现了剧烈的抖动,这可能是由于表面活性Li 耗尽所引起的,表明界面环境已经十分恶化.因此,稀释后的TEP212 局部高浓度电解液在Li 金属沉积/剥离性能比TFP212 具有极大的优势.
2.5 局部高浓度电解液电池中电极表面成分分析
进一步探究了TEP212 和TFP212 两种电解液对电极表面组分的影响. 图5(a)为循环后PAN/S电极的F 1s 谱图,TEP212 中687.2 eV 和TFP212 中687.9 eV 处的拟合峰分别代表C—F/P—F 和C—F/S—F 键[24]. TFP212 电解液中正极表面存在较多的S—F 键,可能来自于S 的不可逆消耗或电解液中LiFSI 的分解,较高的面积比也表明此副反应较为剧烈. 图5(b),(c)和(d)分别展示了两种电解液中循环后Li 金属负极的C 1s、O 1s、F 1s 谱图,对比发现TFP212 体系中生成了更多C—O、P—O 键[19,24,29],F 1s 谱中也可以发现TFP212 体系中负极表面C—F/S—F 组分的面积比例较高,而LiF 的面积比例降低,这表明在TFP212 电解液中TFP 溶剂在Li 金属负极表面大量分解,并形成了大量的有机组分,这进一步阻碍了界面的离子/电子传输,加大了电池的极化和容量衰减. 表面XPS 分析表明TEP212电解液可以形成更加稳定的正负极界面.

图5 不同电极在电池循环后的XPS 谱图. (a) 正极F 1s;(b) 负极C 1s;(c) 负极O 1s; (d) 负极F 1sFig.5 X-ray photoelectron spectroscopy spectra of different electrodes after cycling: (a) F 1s spectra of the cathode; (b) C 1s spectra of the anode;(c) O 1s spectra of the anode; (d) F 1s spectra of the anode
2.6 TEP 基局部高浓度电解液的倍率性能
TEP212 电解液展示了较好的负极稳定性及正极界面特性,因而进一步探索了Li–PAN/S 电池在TEP212 电解液中的倍率特性. 从图6(a)可以看出TEP212 电解液中,电池0.1C 第二圈的放电比容量为1333.3 mA·h·g-1,S 利用率达到79.7%. 在1C、2C、3C 倍率下,电池的放电比容量分别为1038.1、921.4、702.4 mA·h·g-1,虽然在5C 倍率时的平均放电比容量只有315.9 mA·h·g-1,但在恢复小倍率之后容量基本恢复到最初的水平,展现了较高倍率条件下的稳定性能. 此外在循环过程中可以发现一个明显的现象,即在倍率发生改变的第一圈充放电时,电池往往难以快速到达该倍率下的平均放电比容量,这可能是由于以PAN/S 为正极活性物质的电池中,在正极侧发生的是固相转化较为缓慢,需要经历一定程度的活化才能够完全释放出容量. 从图6(b)可以看出,TEP212 电解液的充放电极化虽然随着倍率的增加而增加,但基本维持住了曲线的基本形态,只有在5C 超高倍率的条件下,巨大的极化导致了容量骤降.
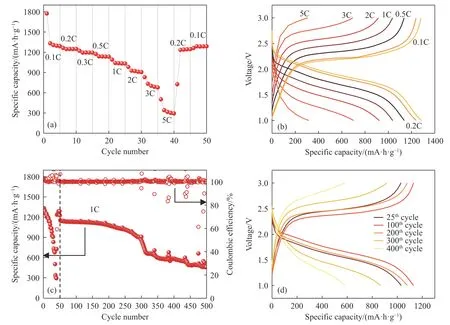
图6 (a) TEP212 电解液的倍率性能;(b)不同倍率下的充放电曲线;(c) TEP212 电解液在1C 倍率下的循环稳定性;(d)电池在1C 倍率下的充放电曲线Fig.6 (a) Rate performance of Li-SPA/S cell in TEP212 electrolyte; (b) charge/discharge curves at different rates; (c) long cycling performance of Li-SPA/S cell in TEP212 electrolyte at 1C; (d) charge/discharge curves at 1C
进一步测试了电池在1C 倍率下的长循环稳定性,如图6(c)所示,电池在倍率性能测试之后可在1C 的倍率下稳定循环约200 圈. 循环次数到300 圈左右,电池的放电比容量迅速从约900 mA·h·g-1衰减到约650 mA·h·g-1,并且库伦效率开始变得不稳定. 从图6(d)的充放电曲线可以看出电池在400 圈时放电电压降低,电池仅能贡献581.0 mA·h·g-1的放电比容量. 有趣的是,电池在首次1C 倍率放电阶段(即第25 圈)的比容量为1032.5 mA·h·g-1,而经历倍率测试后的第100 圈和第200 圈的放电比容量均超过了第25 圈,分别为1130.1 mA·h·g-1和1080.8 mA·h·g-1,并且其充放电过电位仍然处于较低的水平. 这可能是因为PAN/S 正极需要更多的充放电过程进行活化,以TEP212 为电解液时,较为活跃的充放电条件可能更有助于Li 对PAN 共轭骨架的插层,从而提升正极材料的离子电导率,并促进硫链的锂化过程.
3 结论
本文以LiFSI 为锂盐,TEP 和TFP 为主溶剂,TTE为稀释剂,研究了一系列基于1∶2 摩尔比的不同稀释比例的阻燃电解液,探究了其应用于Li–PAN/S 电池的性能并对界面反应的过程和机理进行了分析.
(1) 研究发现TEP2–LiFSI 高浓度电解液可以实现PAN/S 电极在0.1C 倍率下长期稳定循环,在100 圈后的放电比容量为1666 mA·h·g-1,具有99.6%的超高S 利用率.
(2) 稀释后的TEP2–LiFSI/2TTE(TEP212)电解液表现出优秀的倍率性能,在1C 的倍率下具有1038.1 mA·h·g-1的放电比容量,并在循环200 圈之后容量保持率达到86.7%. 与TFP 溶剂相比,TEP电解液能够在0.5C 的倍率下保持较好的循环稳定性,而TFP 电解液的电池容量衰减较快,并且表现出极大的充放电过电位.
(3) 我们通过Li 的沉积/剥离性能测试发现在TFP 基电解液中,生成的Li 金属界面极不稳定,不仅具有极低的沉积/剥离效率,在长期和循环中还会导致性能的快速恶化. 此研究表明,基于磷酸酯溶剂构筑阻燃电解液,能够获得高安全与高寿命,其分子设计应该不仅关注高阻燃特性,更应该关注其在锂金属负极电解质界面膜中的贡献以及带来的锂金属稳定性挑战.

