基于视听觉和运动反馈的脑机接口结合经颅直流电刺激对脑卒中患者上肢功能的效果
高玲, 褚凤明, 贾凡, 陈杰, 张明,3
1.徐州医科大学附属徐州康复医院,江苏徐州市 221003;2.徐州医科大学徐州临床学院/徐州市中心医院,江苏徐州市 221009;3.中国矿业大学机电工程学院,江苏徐州市 221116
0 引言
脑卒中是我国成人首要的致死、致残原因,具有高发病率、高致残率、低治愈率等特点[1]。随着人口老龄化加剧以及生活习惯、危险因素等的影响,脑卒中的疾病负担正在逐年增加[2-3]。脑卒中患者常遗留诸多慢性功能障碍[4],最常见的是上肢功能障碍,影响55%~75%患者的生活和工作[5-6],治疗周期长、预后较差[7],目前的常规康复综合使用多种康复手段,但仍有许多患者上肢功能恢复欠佳[8]。
脑机接口(brain-computer interface, BCI)技术是一种软硬件相结合的通信系统技术,能够将大脑运动意图信号通过计算机提取、解码并输出为控制外部设备的指令,驱动外部设备产生实际动作,实现大脑与外部环境的直接交互[9-10]。大脑的运动意图反映大脑的参与度,通过BCI 技术可以增加大脑参与度,进而显著增强运动相关区域的脑区激活[11],促进皮质重组,诱导大脑可塑性变化,有效促进脑卒中患者上肢功能恢复[12]。然而,如何使脑卒中患者高效、稳定地想象目标任务;如何有效监控虚拟任务的执行情况;如何准确捕获、识别和解码与任务相关的脑电信号,提高BCI 的信噪比;如何提高信号的传输速率;如何将脑电信号转化为视觉、动作、声音等,以达到多感官反馈增强BCI 的效果;如何解决BCI 的训练疲劳问题,保证有效的训练时间;如何提高BCI 的舒适度和患者的接受度等,仍然是BCI 领域的重大挑战[13-14]。本研究采用一种基于视听觉和运动反馈的新型BCI 系统,能给患者提供多重感觉刺激,并提供实时反馈,反馈时间短,时间效率高;临床使用方便,可以指导和监测患者目标任务想象;用户友好,在训练过程中不易感到疲劳[15]。
经颅直流电刺激(transcranial direct current stimulation, tDCS)是一种非侵入性的中枢刺激技术,能以恒定、低强度的直流电(0.5~2.0 mA)刺激大脑半球,影响神经细胞膜电位,进而调节皮质兴奋性[16],纠正脑卒中后大脑半球间的不平衡状态[17],增强神经可塑性,有利于促进脑卒中后上肢运动功能的改善[18]。
目前BCI 和tDCS 均在临床上得到了广泛应用[19],但两者结合使用的研究主要针对健康个体。本研究采用具有视听觉和运动反馈的新型BCI 系统,并将其与tDCS相结合,通过脑电图客观反映大脑活动[20],观察此方案对脑卒中患者上肢康复的效果。
1 资料与方法
1.1 一般资料
选取2023年3月至10月,在徐州医科大学附属徐州康复医院和徐州市中心医院康复医学科住院的脑卒中患者45例,均符合中国各类主要脑血管病诊断要点(2019)中脑卒中诊断标准[21],并经头部CT 或MRI证实。
纳入标准:①年龄18~75岁;②首次发生脑卒中;③单侧发病,病程< 6 个月,情况稳定;④上肢和手的Brunnstrom 分期均≤ Ⅳ期;⑤上肢屈肌张力改良Ashworth 分级≤ Ⅱ级;⑥简易精神状态检查评分≥ 21分,意识清楚,依从性较好;⑦患者本人签署知情同意书。
排除标准:①进展型卒中或蛛网膜下腔出血,病情不稳定;②并发严重心脏病、高血压等内科疾病及认知功能障碍;③并发严重肌张力障碍和/或不自主运动;④植入或携带可能干扰BCI 的起搏器,颅内或治疗区域有金属部件植入;⑤存在癫痫、脑肿瘤等;⑥依从性差不愿配合康复训练。
采用随机数字表法,将患者分为BCI组、tDCS组和联合组,每组各15 例。3 组基线资料无显著性差异(P> 0.05)。见表1。
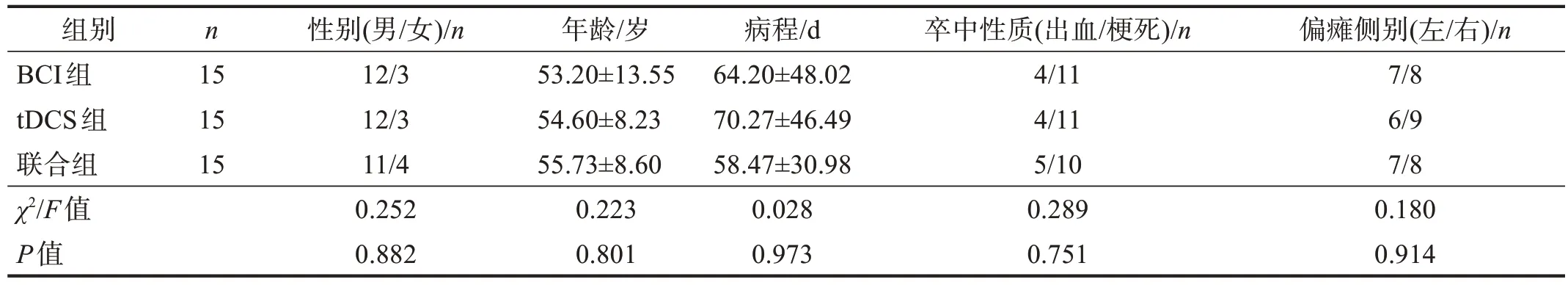
表1 3组基线资料比较Table 1 Comparison of baseline data among three groups
试验开始前,详细告知所有患者本试验的内容,包括可以获得的治疗利益和可能出现的不良反应等,患者均自愿参与,并签署知情同意书。
本研究由徐州市康复医院医学伦理委员会审批通过(No.XK-LW-20230324-025),并在医学研究备案登记系统备案(No.MR-32-23-050520),中国临床试验注册中心注册(No.ChiCTR2300071658)。
1.2 方法
3 组均接受常规康复治疗。在此基础上,BCI 组增加BCI,tDCS 组增加tDCS 治疗,联合组先行tDCS治疗,然后立即行BCI。每天1次,每周5 d,共4周。
1.2.1 常规康复
包括运动疗法(如主被动关节活动、Bobath 技术、平衡训练等)、作业疗法(如滚筒、磨砂板、木钉板训练,以及日常生活活动训练等)、物理因子治疗(如功能性电刺激等)。每次120 min。
1.2.2 BCI
在安静的房间内,由经过专业培训的治疗师进行。采用L-B300 脑电采集和康复训练系统(浙江迈联医疗科技有限公司)。患者舒适坐位,佩戴8导联脑电帽,包括左右耳夹电极,电极放置符合10/20 国际标准导联系统。患者双侧上肢固定在左右旋转轴上,根据显示屏上虚拟人物训练类型进行相应的运动表象(motor image, MI)训练,并遵循语音提示。显示屏右侧进度条实时显示患者运动意图的强度,当运动意图达到系统设定的阈值时,屏幕上的虚拟人物开始移动,给予患者视觉反馈,同时左右旋转轴开始转动,驱动患者上肢移动,向患者提供运动感知反馈,还有相应的语音提示对患者进行鼓励。当患者运动意图低于阈值时,虚拟人物停止运动,转轴停止转动,并有语音提示患者集中注意力。每次20 min。
1.2.3 tDCS
在安静的房间内,由经过专业培训的治疗师进行。采用VC-8000D 经颅电刺激仪(南京沃高医疗科技有限公司)。患者舒适坐位,全身放松,tDCS 电极放置根据10/20 国际标准导联系统确定,阳极置于患侧初级运动皮质(M1区),阴极置于对侧眼眶。刺激电极采用标准配置5 cm×5 cm 等渗盐水海绵电极片,通过弹性扣件固定在患者头部,阳极刺激,刺激强度2.0 mA。每次20 min。
以上训练遵循循序渐进原则,根据患者功能水平逐渐调整训练难度,鼓励患者积极主动参与,并注意观察患者反应,如有任何不适立即停止,并及时调整训练方案。
1.3 评定方法
由同一名不了解分组情况且经过专业培训的治疗师完成。
1.3.1 Fugl-Meyer 评 定 量 表 上 肢 部 分(Fugl-Meyer Assessment-Upper Extremities, FMA-UE)
包括上肢的反射、协调性和分离运动等,共33项,总分66分。评分越高,上肢功能越好。
1.3.2 上肢动作研究量表(Action Research Arm Test,ARAT)
包括抓、握、捏的能力和粗大动作完成情况,共19项,总分57分。评分越高,上肢功能越好。
1.3.3 改良Barthel指数(modified Barthel Index, MBI)
包括修饰、穿衣、进食等10 项日常生活基本活动,总分100分。评分越高,患者生活自理能力越好。
1.3.4 脑电图
采用JY-2440 数字脑电地形图仪(中国江苏锦源医疗科技有限公司)。电极根据10/20 国际标准导联系统进行放置,以双侧耳夹电极作为参考电极。滤波范围0~30 Hz,时间常数0.03 s,走速为30 mm/s。嘱患者闭上眼睛保持清醒和放松状态至少3 min。
采用MatLab 软件中的EEGLAB 和定制代码对采集到的脑电信号去除伪迹并进行定量分析,导出每个电极的δ、θ、α 和β 频段的平均功率,计算平均头皮δ-α 比(delta-alpha ratio, DAR)和功率比指数(power ratio index, PRI)。比值越小,患者功能预后越好。
1.4 统计学分析
采用SPSS 22.0 进行统计学分析。计量资料均符合正态分布和方差齐性,以(±s)表示,组内比较采用配对样本t检验,组间比较采用单因素方差分析,两两比较采用LSD 检验。计数资料以频数表示,采用χ2检验。等级资料采用非参数秩和检验。显著性水平α= 0.05。
2 结果
所有患者均完成试验,治疗期间没有发生不良反应。
治疗前,3 组FMA-UE、ARAT 和MBI 评分,以及DAR 和PRI 均无显著性差异(P> 0.05)。治疗后,3组各项评分均显著增加(P< 0.001),联合组最高(P<0.05)。见表2~表4。DAR、PRI 下降(P< 0.05),联合组最低(P< 0.05)。见表5~表6。
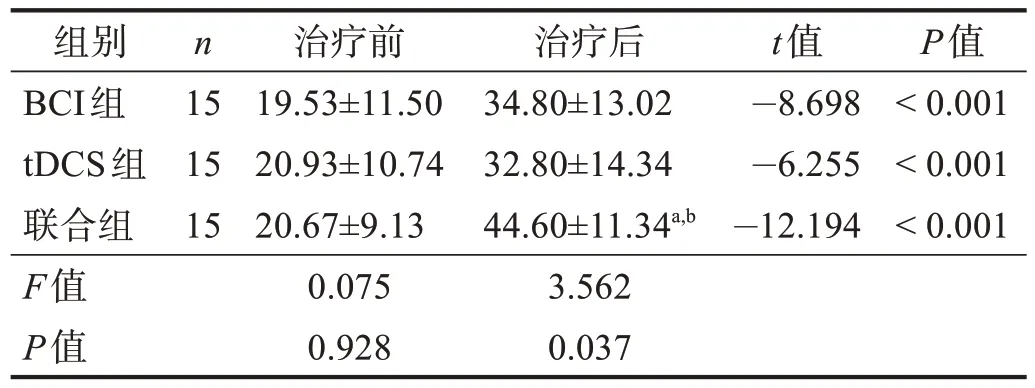
表2 3组治疗前后FMA-UE评分比较Table 2 Comparison of FMA-UE score among three groups pre and post treatment
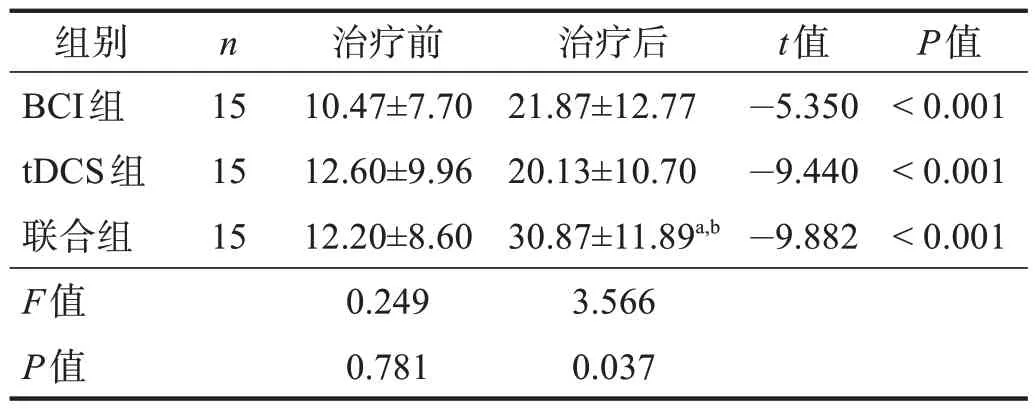
表3 3组治疗前后ARAT评分比较Table 3 Comparison of ARAT score among three groups pre and post treatment
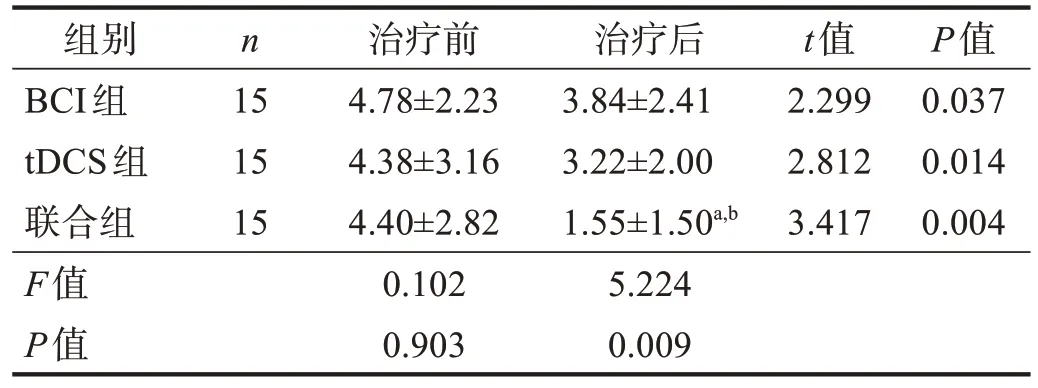
表5 3组治疗前后DAR比较Table 5 Comparison of DAR among three groups pre and post treatment
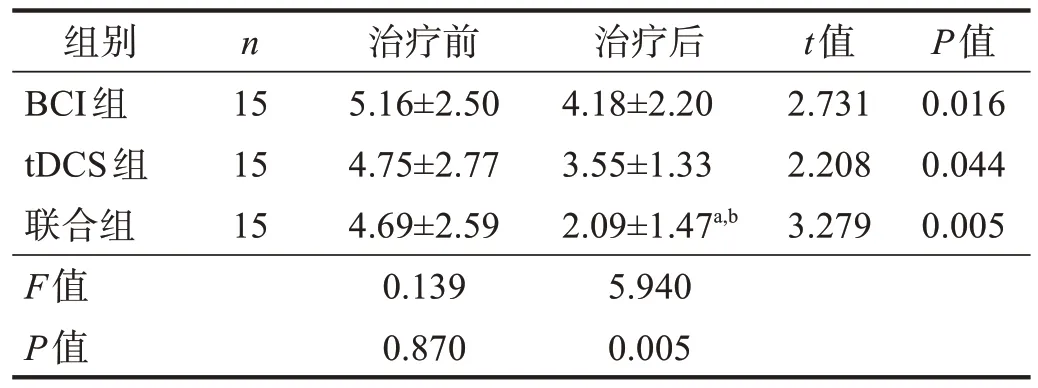
表6 3组治疗前后PRI比较Table 6 Comparison of PRI among three groups pre and post treatment
3 讨论
脑卒中是全球性重大公共卫生问题[22]。脑卒中可能直接影响运动系统皮质或皮质下区域的网络,损害连接关键区域的白质纤维,严重干扰网络内平衡[23];同时脑卒中可能改变经胼胝体抑制,使患侧半球的病理性抑制增强[24]。脑卒中后,大脑会自发产生可塑性改变,促进皮质功能和结构重组,从而修复或代偿受损的神经功能[25-26]。采用特定手段促进皮质特定区域激活和有效连通性增加,增强大脑可塑性,对患者运动功能恢复至关重要[27]。BCI和tDCS能直接刺激相关功能脑区,促进运动皮质激活,调节大脑神经活动和可塑性,有利于脑卒中患者运动功能和整体功能恢复[28-29]。
BCI 技术可以实时检测大脑产生的活动信号,并将其转换为有意义的输出,以控制外部设备,使患者以不依赖于外周运动控制的方式参与进来,有效规避受损的神经肌肉系统[30],为脑卒中患者的上肢康复提供了新的策略。产生脑电信号的方法有很多,其中MI 主动而直观,MI-BCI 系统对用户来说更为自然,能提供更好的控制感[31]。Liu 等[32]发现,MI-BCI 能改善患者上肢运动功能,提高注意水平。刘明月等[33]发现,MI-BCI 能改善患者的手功能和日常生活活动能力,提升患手屈曲、伸展和拇指活动时肌肉运动单位的募集和同步化放电水平。
本研究应用基于视听觉和运动反馈的新型BCI 系统,要求患者根据视觉图像和语音提示,集中注意力完成MI 任务。脑电信号经脑电帽采集,解码后通过蓝牙装置实时传输到终端设备(转轴和显示屏),以此控制运动意图达到阈值时转轴驱动的上肢运动和显示屏上虚拟人物的运动,给予患者视觉和运动反馈,同时还有相应的语音提示提供听觉反馈。上述反馈信息刺激大脑继续产生脑电信号,形成闭环学习通路。患者训练4 周后,上肢功能和日常生活活动能力得到提升。患者通过在大脑中不断模拟演练相关运动动作,能够在主观意愿驱动下产生比被动训练更强的皮质激活[34],并引起患者M1 区和运动前区的活动从健侧半球向患侧半球转移,使半球间激活重新平衡[35],增强患侧半球运动区域间和两半球间的功能连接[36];系统完全由患者通过MI 产生的与运动意图相关的特征脑电信号作为指标进行驱动,有助于引导患者持续主动地给出向下运动控制信号,并将控制信号准确应用到周围神经肌肉系统[15];积极训练是达到预期康复效果的前提[37],患者在完成MI 任务后,系统相应给予反馈,有助于提高患者训练积极性,增强自信,并帮助患者及时调整训练状态,提高治疗效果;同步、精确的视觉、听觉和运动反馈能强化诱导神经元同步性反复激活[33],从而增加神经元间的突触强度,增强患者运动学习和运动恢复能力;反复多次训练可能通过以上反馈,实现大脑与肢体的双向刺激[38],建立自上而下又自下而上的运动闭环,刺激损伤区域残余神经元重塑和神经网络重组,从而提高控制运动功能的神经元的传递效率[39],增强神经可塑性,促进基于Hebbian理论的运动恢复[40]。
tDCS 作为一种非侵入性的中枢刺激技术,具有无创、无痛、操作简单等优势,能够通过在头皮特定位置施加微弱直流电,调节皮质兴奋性,增加运动相关区域的活动[41]。其中阳极刺激能使神经细胞去极化,促进患侧皮质兴奋;阴极刺激则能使神经细胞超极化,抑制健侧皮质兴奋[42],已广泛应用于脑卒中患者上肢功能康复。韩雪等[43]发现,阳极tDCS 能提高患者的上肢运动功能,恢复感觉传导通路。Bolognini等[44]发现,双半球tDCS 能提高患者的握力和日常生活活动能力。本研究显示,患者经过阳极tDCS治疗4周后,上肢功能和日常生活活动能力均得到改善。tDCS 通过引起细胞静息膜电位的变化,调节大脑皮质兴奋性,阳极tDCS 可促进患侧神经元兴奋,纠正病理性抑制,重新恢复半球间平衡[45];通过影响Na+-K+泵的跨膜转运和局部跨膜离子浓度变化,促进突触功能重建[46];通过诱导长时程增强和上调脑源性神经营养因子等相关蛋白含量,调控大脑神经元活性,提高突触功效,调节神经可塑性[47-48];通过神经血管耦合等改善患侧大脑血供,增加局部脑血流量,有助于减少炎症和保护缺血区域的神经元[49];增加大脑患侧半球运动相关神经网络的功能连接,提高运动网络的整体效率[50],促进神经重组,有利于建立新的突触连接和恢复受损的肢体运动功能[19]。
对于大多数病情严重的脑卒中患者来说,单独采用一种治疗手段往往不能取得满意效果,联合运用多种康复干预手段具有重要意义。本研究显示,联合采用基于视听觉和运动反馈的BCI和tDCS,提高脑卒中患者上肢功能的效果更佳。这可能是因为在进行BCI前行阳极tDCS 治疗,预先激活患侧半球,兴奋患侧运动皮质,BCI 时能更快激活[51],有助于增强特征脑信号;患者在进行MI 任务时更容易集中注意力,训练效率得到提高;tDCS 可以调节事件相关去同步强度,使得脑电图能够检测到来自患侧半球的稳定信号,提高MI 信号检测的准确性[52],增强BCI 的效果;tDCS存在后续效应[53],能为BCI创造环境,有助于促进运动学习,提高BCI 诱导的运动学习能力[54];基于视听觉和运动反馈的BCI 不断在患者大脑中形成运动意向,并通过外周视听觉和运动感觉反馈给中枢,可强化正性反馈,加强正确的运动模式[32],促进受损的神经通路重建[55],在tDCS 治疗的基础上进一步提高治疗效果;BCI 和tDCS 均能直接刺激中枢神经系统,增强神经可塑性,联合应用可能产生协同效应,更大程度提高皮质兴奋性和神经可塑性,从而进一步改善上肢运动功能。
脑卒中患者大脑代谢减少,高频脑电波(α 波和β波)功率减弱,低频脑电波(θ 波和δ 波)功率增加[56]。DAR 和PRI与脑卒中患者功能恢复之间存在很强的相关性[57],其中DAR与美国国立卫生研究院卒中量表评分和改良Rankin 量表评分呈正相关[58],与FMA 评分呈负相关[59];PRI 与DAR 明显相关,但对θ 和β 活动也很敏感[60]。本研究显示,BCI和tDCS均可促进患者大脑活动正常化,进而促进运动功能的恢复,联合应用效果更佳。
本研究为单中心试验,样本量较小,干预时间较短。未来将进一步扩大样本量,进行长期随访,并探索应用其他客观指标评价康复的有效性。
4 结论
基于视听觉和运动反馈的BCI 与tDCS 联合应用,不受患者残余功能的限制,给上肢残余功能较差或丧失的患者提供了积极参与康复训练的机会。两种中枢干预手段相结合,可能产生协同作用,能更大程度促进脑卒中患者的上肢功能恢复。
利益冲突声明:所有作者声明不存在利益冲突。

