麻醉苏醒期间不同吸入氧浓度对腹腔镜胃癌根治术患者术后肺不张的影响
蔡信杰, 郭文雅, 汪洋, 李云
安徽医科大学第二附属医院麻醉与围术期医学科(安徽合肥 230601)
在围术期中为确保患者安全通常使用充足的氧气,可能导致肺泡塌陷和吸收性肺不张[1-2]。此外过量的氧气还会对心血管和神经系统造成不良反应[3-4]。在苏醒期间为预防可能的呼吸暂停而导致缺氧的发生,通常给予100%氧气通气。然而,即使短时间内呼吸100%的氧气也可能导致肺不张,甚至可以持续到手术后[5-6]。术中进行的肺保护性策略获得的益处可能会在这一过程中减弱甚至丧失[7]。此外随着微创手术的不断发展,腹腔镜下胃癌根治术的应用越来越多,术中气腹的应用也会损害呼吸功能[5,8-9],且接受此手术的患者大多是老年患者,发生术后肺部并发症的风险更大[10-11]。肺超声具有简单易用、便携、无创、直观、无辐射的优势,已广泛应用于临床监测和诊断。许多研究[2,12]表明,肺超声可以准确地评估肺通气损失的程度和诊断肺不张。本研究通过肺超声检查评估麻醉苏醒期间不同吸入氧浓度对腹腔镜胃癌根治术患者术后肺不张的影响。
1 资料与方法
1.1 一般资料 本研究经医院医学伦理委员会批准(YX2023-032),患者或家属签署知情同意书。选择2022年11月至2023年6月择期行腹腔镜胃癌根治术的老年患者,年龄≥65岁,体质指数(BMI)18.5~25 kg/m2,ASA Ⅱ~Ⅲ级。排除标准:患者拒绝参加试验,合并严重的呼吸系统、心血管疾病、肝肾功能损害、胸廓及脊柱畸形,最近3个月参与其他临床研究,术中转开放手术,术后不能脱离呼吸机或转入重症监护病房,术后5 d内二次手术,术中使用的通气策略无法维持患者氧合[血氧饱和度(SpO2)<94%或血氧分压(PaO2)<70%]。
1.2 肺超声检查 每个半胸以腋前线和腋后线为界限分为前部、侧部、后部三个区域,上下部分以乳头平面为分界线隔开,共分为12个肺区。扫描每个区域的肋间间隙,并对超声图像进行分析。每个肺区的肺超声评分(LUS)为0~3分,将12个象限的得分相加,计算出整体LUS,得分越高,表明通气损失越严重[13]。超过3个以上区域(约占总肺表面的25%)有任何肺通气损失的迹象则定义为显著肺不张[12-13]。每个区域LUS评分标准:正常通气0分(0~2条B线),轻度通气损失1分(≥3条B线),中度通气损失2分(多聚B线),重度通气损失3分(实变)。
1.3 麻醉方法 患者术前常规禁饮禁食,未给予术前用药。入室后开放上肢外周静脉,监测心电图(ECG)、血氧(BP)、SpO2、呼气末二氧化碳分压(PETCO2)、脑电双频指数(BIS),行桡动脉穿刺置管监测有创血压,行右侧颈内静脉穿刺置管用于监测CVP和术中补液。麻醉诱导:静脉注射舒芬太尼0.5 μg/kg、依托咪酯0.4 mg/kg、顺式阿曲库铵0.15 mg/kg。经口可视喉镜下行气管插管,连接呼吸机行机械通气并予以一次手法肺复张操作。麻醉维持:采用静-吸复合麻醉,吸入1%~2%七氟醚,静注丙泊酚4~8 mg/(kg·h)、瑞芬太尼0.1~0.3 μg/(kg·min)、顺式阿曲库铵 0.1~0.2 mg/(kg·h),维持BIS 40~60。术中补液以晶体液为主,当MAP下降幅度超过术前的20%时,酌情静脉注射去氧肾上腺素0.1 mg。手术结束前30 min停用顺式阿曲库铵和气腹结束时停用七氟醚,术毕停用丙泊酚和瑞芬太尼。
1.4 分组与处理 术中使用压力控制-容量保证(PCV-VG)通气模式,设置潮气量(VT)6 mL/kg,呼吸频率(RR) 12次/min,呼吸比(I∶E)1∶2,吸入气中的氧浓度分数(FiO2)40%,呼气终末正压(PEEP)5 cmH2O,吸入氧气流量为2 L/min,维持PETCO235~50 mmHg。气腹结束时再次予以肺复张操作后采用随机数字表法将患者分为两组:低吸入氧浓度组(L组),继续保持40%吸入氧浓度;高吸入氧浓度组(C组),将吸入氧浓度升高至100%。手术结束后,患者恢复自主呼吸或间歇性手动辅助通气,在拔管前,不常规进行呼吸道吸引,但如果有临床指征,则允许进行。当患者完全清醒并自主呼吸时,在没有任何正压的情况下拔除气管。然后患者被运送到麻醉后监护室(PACU)。持续监测外周动脉SpO2。如果患者在PACU中出现低氧饱和事件(SpO2<94%)[13],采用鼻导管吸氧。30 min后行肺超声检查。
1.5 观察指标 记录患者一般资料、手术时间、术中补液量;记录入室时(T0)、入PACU 30 min(T4)的LUS评分及术后肺不张的发生率。记录入室(T0)、气腹结束时(T1)、拔管时(T2)、出PACU时(T3)的HR、MAP,并行血气分析记录PaO2、OI。记录拔管后在PACU中SpO2<94%事件的发生率。于术前1 d(D0)和术后1 d(D1)、3 d(D2)、5 d(D3)测定第1秒用力呼气容积(FEV1)、用力肺活量(FVC)、1秒率(FEV1/FVC)。记录术后1 d临床肺部感染评分(CPIS)和术后7 d肺部并发症的发生情况。
1.6 样本量计算 本研究以术后肺不张发生率为主要指标计算样本量,根据预实验,对照组术后肺不张发生率为70%,实验组肺不张发生率30%,假设检验标准α=0.05,检验效能1-β=0.8,两组样本量1∶1,并考虑20%脱落,估测出共需要纳入74例患者。
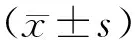
2 结果
2.1 临床资料的比较 本研究初始纳入74例患者,其中C组中有1例因超声仪故障及2例术后转入ICU被剔除。L组中有2例因术中转开放手术及1例术后拒绝配合肺功能检查被剔除。最终分析68例患者。两组患者年龄、性别、BMI、ASA分级、手术时间、输液量、气腹压差异均无统计学意义(P>0.05),见表1。

表1 两组患者临床资料比较
2.2 PaO2、OI、MAP和HR的比较 与C组相比,L组患者在T2时PaO2、OI明显降低(P<0.05),在T3时PaO2、OI明显升高(P<0.05)。两组在T0~3时HR、MAP差异均无统计学意义(P>0.05),见表2。

表2 两组患者PaO2、OI、MAP和HR的比较
2.3 LUS及肺不张、SpO2<94%的发生率比较 与T0时相比,T4时两组患者整体及各部分LUS均明显升高(P<0.05)。与C组相比,L组患者在T4时的整体及后部LUS明显降低(P<0.05),前部及侧部差异无统计学意义(P>0.05)。见表3。与C组比较,在PACU中L组患者中显著肺不张的发生率及SpO2<94%事件的发生率明显降低(P<0.05)。见表4。

表3 两组患者不同时间点LUS的比较 M(P25,P75)分

表4 两组患者PACU中显著肺不张及SpO2<94%的发生率比较 例(%)
2.4 不同时点肺功能指标的比较 与D0比较,在D1~3时两组患者的FEV1、FVC均明显降低(P<0.05),D1~3时C组FEV1/FVC明显降低(P<0.05),D1~2时L组FEV1/FVC明显降低(P<0.05)。与C组比较,D1时L组患者FEV1、FVC、FEV1/FVC均明显升高(P<0.05)。见表5。与C组比较,L组术后1 d CPIS评分(1.6±0.7vs.1.5±0.6)和术后7 d肺部并发症发生率[10例(29%)vs.8例(24%)]比较,差异无统计学意义(P>0.05)。

表5 两组患者不同时点肺功能指标的比较
3 讨论
3.1 肺部超声 与CT相比,肺超声是一种简单易用、便携、无创、直观、无辐射的技术,已广泛应用于临床监测和诊断[14-15]。研究[12-13]表明,在围术期,肺超声可以准确地评估通气损失的程度和诊断肺不张。LUS诊断肺不张的敏感度为87.7%,特异度为92.1%,诊断准确率为90.8%,LUS评分越高,说明肺不张越严重[9]。因此,在本研究中选择使用肺超声检查来评估麻醉苏醒期间不同吸入氧浓度对老年患者腹腔镜胃癌根治术患者术后肺不张的影响。
3.2 术后肺不张 在接受全身麻醉的患者中,即使是术前肺部无基础疾病的健康患者也会有60%~90%的患者会发生术后肺不张[7,9]。最常见的原因之一是在围术期使用高浓度氧从而导致的吸收性肺不张。理论上,因为肺泡内腔和毛细血管内混合静脉血之间的氧气分压梯度较大,氧气通过肺泡-毛细血管屏障的扩散速度更快,所以使用较高的氧气浓度增加了呼吸道闭合和肺泡塌陷的机会[7]。此外,在腹腔镜手术中,术中气腹也增加了压缩性肺不张的风险[9]。术后肺不张现已成为术后最常见的肺部并发症之一[2,7,16],同时肺不张也被认为是大多数术后肺部并发症(PPCs)发生的关键因素[9,17]。这些并发症会导致更高的发病率、死亡率和增加患者和医院资源的占用[9,18-19]。因此,要尽量减少术后肺不张的发生及严重程度。
在本研究中,麻醉苏醒期间应用了两种不同的氧气浓度(40%和100%),使用肺超声分析了全身麻醉术后肺部不同区域的通气损失。数据显示,两组患者术后与术前相比的LUC均明显增加且肺不张更多地发生在重力依赖的肺区(后部区域),这与以前的研究[9,20]结果一致。在麻醉仰卧位机械通气的患者中,由于重力作用,胸膜腔压力沿着重力轴逐渐增加。因此跨肺压(呼吸道压力减去胸膜压力),从腹部区域到背部区域逐渐降低[20]。当跨肺压力不足以维持肺背部依赖区域肺泡的开放时,就会发生肺不张。
3.3 术后氧合状况及肺功能 PaO2反映了外呼吸的功能状态指标,OI反映患者身体的氧合状况。在本研究中,与L组相比,C组患者于拔管时PaO2、OI更高,但这种优势并没有持续到术后,在出PACU时,L组患者显示了更高的PaO2、OI水平。此外,在PACU中,C组患者中SpO2<94%事件的发生率更高。
在本研究中,与C组的患者相比,L组的患者术后第1天的FEV1、FVC、FEV1/FVC明显增加,提示麻醉苏醒期间低FiO2可改善腹腔镜胃癌根治术患者术后早期肺功能,有利于预后。术后3 d及5 d两组的FEV1、FVC、FEV1/FVC与术前相比虽仍有下降,但两组间差异无统计学意义,这可能与患者的自身活动相关,术后第1天患者常于病床静息,3 d左右开始下床活动。研究表明,许多自然行为,如哭泣、咳嗽、打喷嚏、叹息或体位调整,都有肺复张的效果[20]。
3.4 术后肺部并发症 两组的患者CPIS、术后7 d内肺部并发症发生率虽有差异但无统计学意义。根据氧气暴露的浓度和持续时间的不同,过度产生活性氧化物可能会导致氧化应激,已被明确确定为导致肺泡和器官炎症损害的原因[3-4]。在本研究的麻醉苏醒期间虽使用100%氧浓度,但吸入时间相对较短。
3.5 局限性 首先,本研究数据结果仅限于接受特定手术无明显肺部疾病人群,肺部存在基础疾病或肥胖患者的应用还需进一步探索。其次,虽然肺部超声是测量肺部充气变化的有效工具,但CT仍然是测量肺不张的金标准。超声检查虽然是在分组盲法下进行的,但仍然会具有一定主观性。
综上所述,在老年患者腹腔镜胃癌根治术中,麻醉苏醒期间使用40%吸入氧浓度能够降低老年患者腹腔镜胃癌根治术术后肺不张的发生率及严重程度,改善术后早期肺功能。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:蔡信杰负责数据收集,论文撰写; 汪洋负责数据收集,数据统计;郭文雅负责数据收集,数据统计;李云负责研究设计,论文修改。

