胃癌患者血清c-Myc和PD-L1水平与临床病理特征及预后的相关性
于晶晶, 张丽柯, 余沛沛
南阳市第一人民医院 1检验科, 2肿瘤实验室(河南南阳 473000)
胃癌是一种常见的恶性肿瘤,多数患者确诊时已处于中晚期,治疗的方向多为靶向治疗和放疗[1]。研究表明中国每年胃癌发病率和病死率在我国同期恶性肿瘤中分别排第2位和第3位[2]。c-Myc是myc家族的磷酸蛋白,可调节细胞增殖、生长、分化、代谢和凋亡,并且在多种肿瘤中呈现高水平表达[3]。程序性死亡配体1(programmed death ligand 1,PD-L1)属于免疫球蛋白超家族中的分子之一,PD-L1免疫疗法是通过阻断PD-L1信号通路恢复人体自身免疫系统达到治疗多种肿瘤的目的,已经证实在胃癌、肺癌、恶性黑色素瘤、乳腺癌、膀胱癌等多种恶性肿瘤中治疗效果较好[4-5]。因此,本研究通过酶联免疫吸附测定法(ELISA)检测血清c-Myc和PD-L1的水平,分析二者表达与患者临床病理特征和预后的相关性,旨在为胃癌的有效诊治和评估预后提供可靠的参考依据。
1 资料与方法
1.1 一般资料 选取本院自2018年8月至2019年4月收治的96例胃癌患者作为研究对象。其中,男50例,女46例;年龄40~77岁,平均(56.50±7.16)岁。
纳入标准:(1)患者肿瘤为单发病变;(2)首次手术治疗的患者;(3)具有完整的病史资料;(4)患者手术前均没有进行新辅助化疗及放疗;(5)患者进行D2胃癌根治手术;(6)确诊为胃癌患者。
排除标准:(1)患者与其他胃部良性肿瘤合并;(2)患者为多发病变;(3)患者不是第一次手术治疗;(4)患者手术前进行新辅助化疗及放疗;(5)患者合并其他恶性肿瘤;(6)有精神障碍患者;(7)合并免疫缺陷疾病患者;(8)合并其他类型重症疾病患者,如脓毒血症、急性心脑血管病。
另纳入健康体检者96例为对照组,其中,男48例,女48例;年龄40~77岁,平均(56.71±8.44)岁。两组的性别、年龄之间差异无统计学意义(P>0.05),具有可比性。本研究经患者及家属签署知情同意书,且经本院伦理委员会批准。
1.2 方法
1.2.1 主要试剂 酶联免疫吸附测定法(ELISA)试剂盒(批号:FNab00431)购买于武汉华美生物工程有限公司,PD-L1试剂盒(批号:FNab06281)购买于武汉菲恩生物科技有限公司;酶标仪(型号:SpectraMax i3x)购买于美谷分子仪器(上海)有限公司。
1.2.2 样品采集 收集所有患者入院后次日清晨空腹外周静脉血3~4 mL,室温静置30 min,5 000 r/min离心8 min,留取上清液,分装于无菌EP管中,于-20℃冰箱中保存,待检。
1.2.3 ELISA法检测血清c-Myc、PD-L1水平 严格按照c-Myc、PD-L1ELISA试剂盒说明书配制一系列浓度的标准品溶液,采用酶标仪测定不同浓度标准品在450 nm处的吸光度值,绘制c-Myc、PD-L1的标准品回归曲线。于-20℃冰箱中取适量血清样本,解冻,测定各样本在450 nm处的吸光度值,依据标准回归曲线计算血清c-Myc、PD-L1水平。
1.2.4 随访 所有患者均于手术后进行系统随访,随访时间为3年,以患者入院检查方式或者微信、电话随访,最晚截止时间为2022年4月。记录患者术后生存状态,计算总生存率。随访期间无失访病例。

2 结果
2.1 血清c-Myc和PD-L1表达水平比较 与对照组相比,观察组患者血清c-Myc、PD-L1水平显著升高(P<0.05)。见表1。

表1 血清c-Myc和PD-L1表达水平比较
2.2 胃癌患者血清c-Myc和PD-L1表达的相关性 经Spearman相关分析显示,胃癌患者血清c-Myc和PD-L1表达呈正相关(r=0.431,P<0.05)。见表2。

表2 胃癌组织中c-Myc和PD-L1表达的相关性 例
2.3 血清c-Myc和PD-L1表达情况与临床病理特征的关系 c-Myc的表达与患者年龄、性别、肿瘤部位无关(P>0.05),与TNM分期、肿瘤直径、淋巴结转移、浸润深度和分化程度有关(P<0.05);PD-L1的表达与患者年龄、性别、肿瘤部位无关(P>0.05),与TNM分期、肿瘤直径、淋巴结转移、浸润深度和分化程度有关(P<0.05)。见表3。

表3 血清c-Myc和PD-L1表达情况与临床病理特征的关系 例(%)
2.4 血清c-Myc和PD-L1表达情况与胃癌患者3年生存率的关系 c-Myc低表达患者3年累积生存率为88.89%(32/36),高于高表达患者的3年累积生存率76.67%(46/60),差异有统计学意义(P<0.05);PD-L1低表达患者3年累积生存率为86.67%(26/30),高于高表达患者的3年累积生存率78.79%(52/66),差异有统计学意义(P<0.05)。见图1、2。
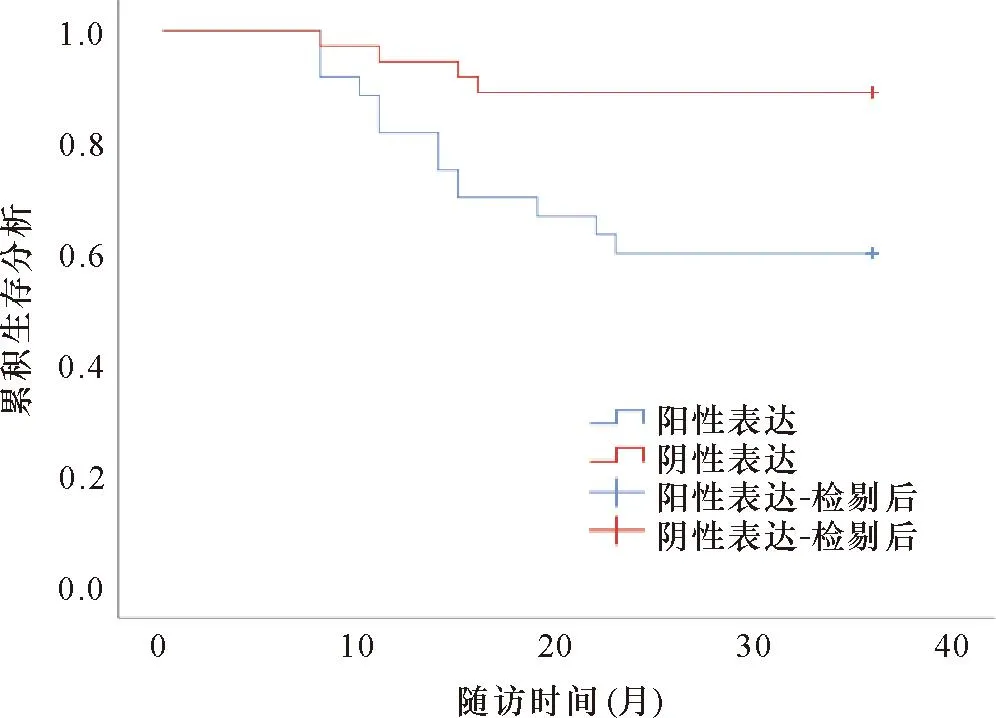
图1 血清c-Myc表达与胃癌患者3年累积生存率的关系

图2 血清PD-L1表达与胃癌患者3年累积生存率的关系
2.5 COX回归分析影响胃癌患者预后的危险因素 因变量以胃癌患者3年内是否去世,以c-Myc和PD-L1、TNM分期、淋巴结转移、浸润深度、肿瘤直径和分化程度为自变量进行单因素Cox回归分析,结果显示,c-Myc、PD-L1、肿瘤直径、TNM分期、浸润深度、淋巴结转移和分化程度均是影响胃癌患者预后的因素(P<0.05)。多因素Cox回归分析结果显示,c-Myc、PD-L1、TNM分期是影响胃癌患者预后的危险因素(P<0.05)。见表4。

表4 COX回归分析胃癌患者预后的影响因素
3 讨论
目前,胃癌的发生与发展机制仍然还不明确,有研究表明胃癌的发生是原癌基因、抑癌基因和错配修复基因多种基因综合作用的结果[6]。而多数学者认为,可能与饮食生活因素、地域环境、慢性胃炎、胃息肉、幽门螺杆菌感染等癌前病变,基因与遗传等多种因素有关。
胃癌的治疗主要有手术治疗、化疗、放疗等,并且效果较好,但胃癌患者生存质量和生存期的延长效果并不理想。
c-Myc的表达受多种机制调控,c-Myc蛋白表达的增加对肿瘤起有利作用[7-8]。本研究中胃癌患者c-Myc的表达升高,进一步验证前人理论,提示高水平c-Myc促进胃癌的进程。
c-Myc髙度表达于具有增殖活性的成年组织和胚胎组织上,如胃肠上皮组织和皮肤表皮组织中。Kozma等[9]和Yang等[10]通过研究发现c-Myc的表达水平越高,肿瘤发生转移的可能性越大。c-Myc促进肿瘤生长的主要机制包括促进血管生成、细胞不可控的生长、分化及基因组的不稳定等多种因素[11-12]。Onckia等[13]通过研究还发现c-Myc在原发肿瘤部位明显要低于转移部位的表达水平。本研究结果表明,血清c-Myc高表达与TNM分期、淋巴结转移、浸润深度、肿瘤直径和分化程度有关,提示c-Myc高表达可能与胃癌细胞的迁移与侵袭密切相关,与上述研究结果一致。进一步研究发现,胃癌血清中c-Myc低表达患者3年的累积生存率均显著高于高表达患者的3年累积生存率,且是胃癌患者不良预后的独立危险因素。表明c-Myc的高表达与胃癌患者的不良预后有关。类似的,Han等[14]也发现胃癌患者预后效果不好则血清c-Myc表达水平较高。
近年来PD-L1的表达及临床意义的研究比较少。PD-L1是肿瘤免疫逃逸机制中的关键分子,在抗肿瘤免疫功能中发挥着关键作用。PD-L1在肿瘤的免疫反应中起着负性调节作用,在多种恶性肿瘤中均存在异常表达。PD-L1是表达于巨噬细胞、淋巴细胞等炎症细胞中的程序性死亡受体1的结合配体,可以对淋巴细胞的功能进行抑制,从而发挥免疫调控作用[15]。既往国内外研究表明,PD-L1是肿瘤免疫逃逸的重要靶点[16-17]。有研究[18]指出,PD-L1在胃癌组织中呈明显高表达。这与本研究中胃癌患者PD-L1的表达升高的结果一致。进一步研究发现,c-Myc与PD-L1表达呈正相关,表明二者相互作用,促进胃癌进展。此外PD-L1表达与TNM分期、淋巴结转移、浸润深度、肿瘤直径和分化程度有关,提示PD-L1参与胃癌的发生、发展。大量研究也证明,PD-L1是胃癌患者预后的独立标志物,其在不良预后中表达较高[19-20]。本研究中胃癌患者血清中PD-L1是不良预后的独立危险因素,与上述研究结果一致,表明PD-L1的高表达与胃癌患者的不良预后关系密切。本研究仅探索胃癌患者血清中c-Myc和PD-L1的表达水平以及与预后的相关性,其具体机制还需进一步研究。
综上所述,胃癌患者血清c-Myc和PD-L1表达增加,与胃癌患者临床病理特征有关,对患者的预后评估存在一定的参考价值。进一步研究将扩大研究样本量,为胃癌的有效诊治提供参考依据。
利益相关声明:所有作者声明无利益冲突。
作者贡献说明:于晶晶:实验操作,论文撰写,数据整理,统计分析;张丽柯:研究指导,论文修改;余沛沛:数据整理,统计分析。

