动物疫病活载体疫苗研究进展
周凯钰太,潘俊慧,王素春,禹兰平,杨文静,梁晚枫,孙福亮,王楷宬
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 延边大学,吉林延吉 133000;3. 农业农村部动物生物安全风险预警及防控重点实验室(南方),山东青岛 266032)
人类日益增长的动物产品需求,致使畜禽疫病防控方式更为严苛。疫苗接种是预防和控制畜禽疫病最为有效且经济的方法。畜禽接种的疫苗主要包括灭活疫苗和弱毒疫苗,但二者分别存在保护效力弱和毒力返强的问题。随着DNA 重组技术以及反向遗传及基因编辑等技术的不断进步,研究人员的研究重点开始偏向于基因工程疫苗。其中,活载体疫苗(live vector vaccine,LVV)因生产成本低、保护力强、安全性能佳,可在载体上插入多个外源基因等优点,受到了研究学者的广泛关注。本文分别对病毒和细菌活载体疫苗进行综述。
1 病毒活载体疫苗
病毒活载体疫苗,是指将目的基因插入到病毒载体的非必需区,构建能表达相应抗原的重组病毒。目前用于构建病毒活载体疫苗的载体分为两大类:一是DNA 病毒,如腺病毒(adeno virus,Adv)、 腺相关病毒(adeno-associated virus,AAV)和痘病毒等[1];二是RNA 病毒,如新城疫病毒(NDV)、流感病毒等[2]。通过敲除病毒载体的非必需基因、突变编码毒力基因等手段,可以增加病毒载体可插入片段的容量,保证其自身的生长特性、免疫原性及安全性。
1.1 腺病毒载体疫苗
第一代腺病毒载体是将复制基因E1或E3敲除,但在使用时需对其进行纯化,否则将诱导机体产生严重的炎症及免疫反应;第二代腺病毒载体是将表达DNA 结合蛋白的E2基因进行突变,使其在不适宜温度范围内不表达基因产物,但该方法可使病毒滴度急剧下降,不适用于动物疫病免疫;第三代腺病毒载体需要有辅助病毒和互补细胞系来包装产生病毒颗粒,其仅保留约500 bp 的顺式作用元件。根据能否复制,腺病毒载体还可分为复制型腺病毒和复制缺陷型腺病毒。复制型腺病毒的表达效率和免疫原性较高,而复制缺陷型腺病毒的安全性更高,因此复制缺陷型腺病毒应用范围较广。目前已有商品化载体及包装系统可供选择,如Ad-Easy 和Ad-Max 包装系统。也可将流行腺病毒作为载体,将外源基因插入,进行多价苗制备,或在腺病毒载体上融合表达佐剂基因,提高疫苗免疫原性。近年来腺病毒载体疫苗部分相关研究进展情况见表1。

表1 腺病毒载体疫苗研究进展情况
腺病毒能在哺乳动物机体内诱导较强的体液免疫反应。腺病毒载体疫苗在猪病防控方向应用研究较多,如非洲猪瘟(ASF)、猪流行性腹泻(PED)和猪繁殖与呼吸综合征(PRRS)等。研究学者将表达非洲猪瘟病毒(ASFV)的B602L、B646L、CP204L、E183L、E199L、EP153R、F317L、MGF505-5R基因的重组腺病毒载体和重组牛痘病毒载体注射至猪体内,攻毒后,与对照组相比,重组腺病毒载体免疫组的胃、肝淋巴结病毒载量降低至1/1 000,而重组牛痘病毒载体免疫组的胃、肝淋巴结病毒载量降低至1/100[13]。研究学者使用Ad-Easy 包装系统来表达ASFV p72 蛋白的重组腺病毒载体,试验结果表明Ad5-ASFV-p72 复制缺陷型腺病毒可以有效表达P72 蛋白[14]。上述结果均表明,腺病毒载体具有开发商业化ASFV 疫苗的潜力。腺病毒载体在禽类疫病防控方面应用较少,多为AIV 方向的应用。研究早期多将AIV 的HA基因与腺病毒载体连接,进行病毒包装。现多将AIV相对保守的表位融合构建至腺病毒载体上。研究学者选择AIV 相对保守的表位、M2 胞外结构域及部分HA 基因进行融合构建至腺病毒载体上[15]。关于反刍动物的腺病毒载体疫苗报道较为少见。在腺病毒载体上表达了口蹄疫病毒(FMDV)P1、3C 和VP2 蛋白,动物试验结果显示该重组腺病毒载体对口蹄疫具有广泛保护作用[16]。研究人员利用重组腺病毒载体共表达鼠伤寒沙门氏杆菌鞭毛蛋白及狂犬病病毒的糖蛋白,进一步提高了对狂犬病病毒的保护效果[17]。
1.2 痘病毒载体疫苗
重组痘病毒是最早用于商品化的兽用活载体疫苗。痘病毒基因组大小为180~300 kb,由于其基因组过大且不具备感染性,无法通过反向遗传的方式来进行重组病毒构建,目前主要通过同源重组的方式构建病毒载体,也有使用CRISPR/Cas9 技术来构建重组病毒。痘病毒载体在一些临床研究中诱导的免疫应答及自身免疫原性较低,但可通过敲除痘病毒载体抑制宿主免疫应答的免疫调节基因,如细胞因子基因和细胞因子受体基因来解决这一问题。缺失痘苗病毒基因组中的细胞凋亡相关基因F1L、白介素18(IL-18)结合蛋白基因C12L或者Ⅰ型干扰素信号抑制基因C6L等,均能够增强疫苗诱导的特异性应答水平,提高免疫细胞的数量、功能和持续时间[18]。近年痘病毒载体疫苗部分相关研究进展情况见表2。
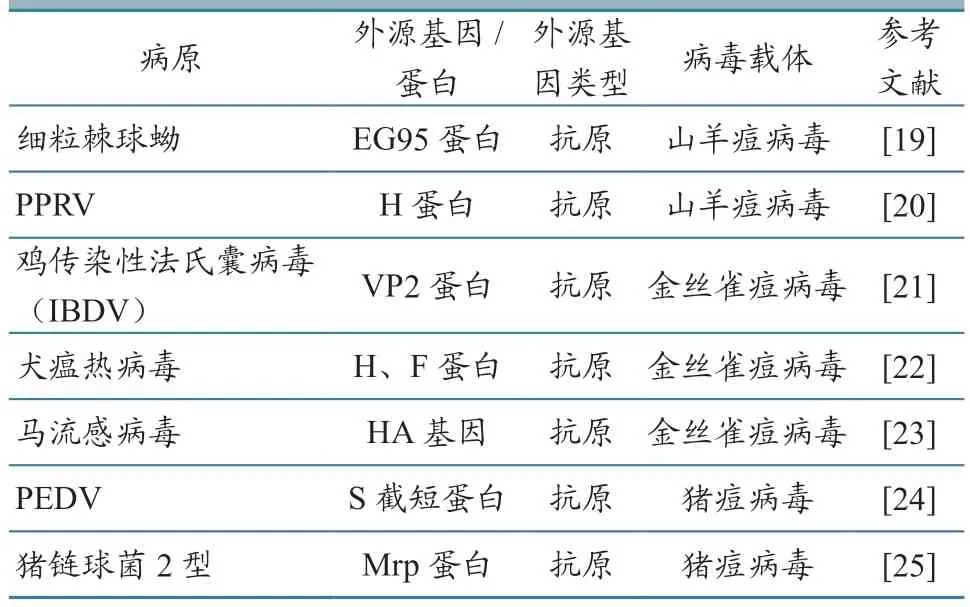
表2 痘病毒载体疫苗研究进展情况
重组禽痘病毒疫苗的黏膜递送能力优于重组DNA 疫苗或重组牛痘病毒疫苗,在接种后96 h 未检测到活性病毒基因表达,且病毒仅感染初始疫苗接种部位,不会被传播到脾脏或肠道等。目前,重组禽痘病毒多用于禽类疫病的疫苗开发。如研究人员将IBDVVP2基因插入到重组禽痘病毒载体上,发现该载体可对SPF 鸡产生一定水平的保护作用[21]。也有研究将反刍动物外源基因插入禽痘病毒载体中,在小鼠和绵羊中评估了单独表达VP2或VP2/VP5联合表达的重组禽痘病毒载体,结果发现其可诱导产生更高水平的中和抗体[26]。还有研究将增强免疫效果的细胞因子基因(IL-18、IL-6、IFN II)与抗原基因同时插入载体中进行表达,以增强载体疫苗免疫效力[27-28]。反刍类动物疫苗研究中山羊痘病毒载体也常被应用,如利用山羊痘病毒载体特异性表达O 型FMDVVP1基因、PPRVF基因[29-30]。研究学者用山羊痘病毒载体表达布鲁氏菌外膜蛋白OMP25,发现该重组病毒载体可特异性表达目的基因[31]。猪痘病毒载体也被应用于表达PRRSV 多表位肽、猪链球菌2 型保护性抗原[32-33]。
1.3 疱疹病毒活载体疫苗
疱疹病毒基因组大小约150 kb。疱疹病毒载体可持续刺激免疫系统,产生较高水平的保护性抗体,且可脱离细胞以冻干形式保存,实现长时间运输。早期重组疱疹病毒构建是采用同源重组技术,但该技术不仅基因重组效率低,而且重组毒株和亲本毒株难以分离,导致试验周期长。目前主要通过人工染色体(BAC)感染性克隆构建重组疱疹病毒。也有方法通过构建病毒基因组Fosmid 文库,在菌体中对病毒基因组进行改造,虽然该方法显著提高了获得病毒突变体的效率,但步骤复杂[34]。也可基于CRISPR/CAS9 系统构建重组疱疹病毒载体,从而进行特定位点的缺失或替换,但该方法实际操作困难且基因脱靶率高[35]。近年内疱疹病毒载体疫苗部分相关研究进展情况见表3。
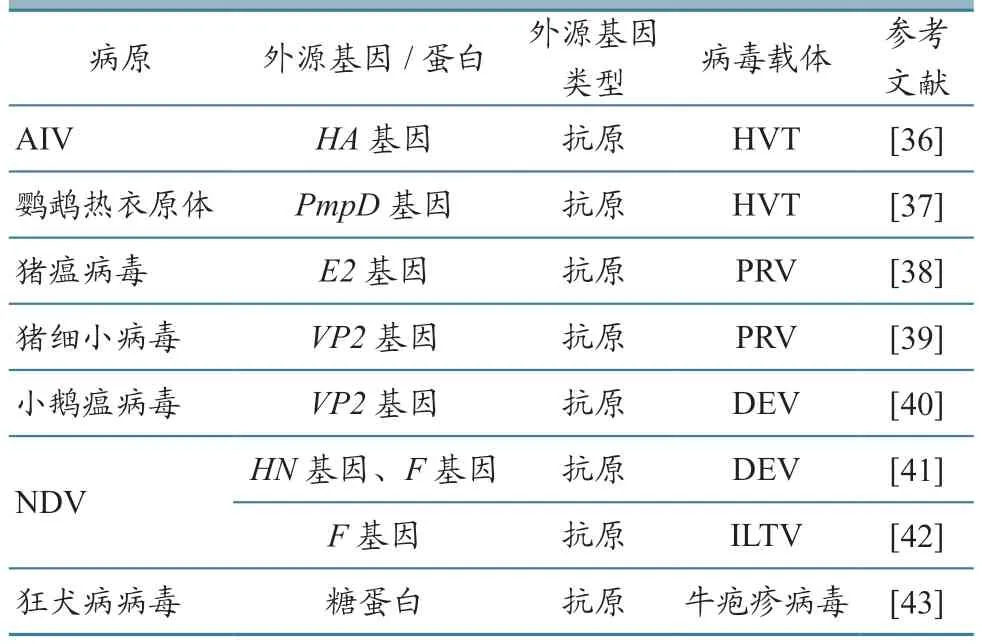
表3 疱疹病毒载体疫苗的研究进展情况
火鸡疱疹病毒(herpesvirus of turkey,HVT)是一种天然的非致病性α 疱疹病毒,其可作为最常用的疱疹活载体疫苗来表达外源基因及预防鸡马立克氏病。目前HVT 在禽类疫病方向应用较多,如可融合表达NDVHN、F基因,IBDVVP2、gB、gD基因[44-45]。有研究[46]将IBDV 的VP2基因插入HVT 基因组的4 个不同位点,构建出4 株重组病毒来评估不同位点与病毒诱导抗体能力之间的关系,通过试验证明rHVT/IBD(UL45-46)具有较低的生长活性,可稳定引发高水平中和抗体,而rHVT/IBD(UL3-4)表现出中等的增殖特性,可诱导产生较高水平抗体。鸭瘟病毒(duck enteritis virus,DEV)常被用作水生家禽疫苗病毒载体。有研究人员通过构建DEV 疫苗株的Fosmid 文库,在病毒感染性克隆的基础上将DEV-I 型VP0基因和H5 亚型AIV 基因分别插入DEV 基因组中[47]。在猪病方面,研究学者利用同源重组技术构建共表达PEDV S 蛋白和猪轮状病毒VP7 蛋白的PRV 三联基因工程疫苗株,结果发现该重组株外源基因稳定存在;将ASFVCD2V基因插入基因缺失的PRV基因组中,经试验证明了其遗传稳定性、毒力、免疫原性和保护能力[48]。
1.4 NDV 载体疫苗
NDV 属于单股负链不分节段的RNA 病毒,常用弱毒NDV 构建重组病毒载体表达外源基因。NDV 在反向遗传操作系统中外源基因可插入位点灵活,但研究[49]证明外源基因插入位置越接近病毒基因组的3'末端则外源蛋白表达量越高,但对病毒复制的干扰也更强。研究[50]表明,NDVP基因和M基因之间的非编码区是外源基因的最佳插入位置。NDV 载体疫苗可以通过饮水、滴鼻或点眼等方式进行免疫,与其他种类的病毒活载疫苗相比,免疫方式便利且成本较低。在反向遗传系统操作中,负链RNA 病毒不同于正链RNA 病毒,其自身没有感染性,因此需要NP 蛋白来帮助转录和复制。目前,构建成功的反向遗传系统NDV 毒株有La Sota、V4-C、Beaudette C、Hitchner B1 等。NDV 载体疫苗部分相关研究进展如表4 所示。
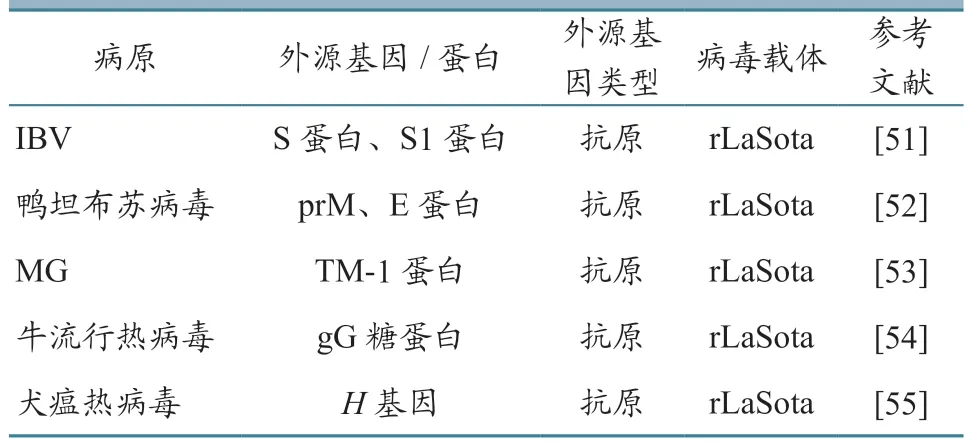
表4 NDV 载体疫苗研究进展情况
在我国,2007 年第一个NDV 载体疫苗——禽流感、新城疫重组二联活疫苗(rL-H5 株)获得农业部注册,并在临床上得到广泛应用。目前,NDV 载体多被用于禽类疫病防控,大多将AIV 的HA 基因插入NDV 载体上[56]。也有文献[57]报道,利用NDV 载体表达IBDV VP2 蛋白和ILTV gD 蛋白,可产生一定的免疫原性。对反刍动物也可应用NDV 载体疫苗进行免疫。Liu 等[58]构建了表达中东呼吸综合征冠状病毒(MERS-CoV)S 蛋白的重组NDV,经在小鼠和双峰驼中进行免疫原性评估发现,该重组病毒可诱导小鼠和骆驼产生MERSCoV 中和抗体。
1.5 其他动物病毒载体疫苗
有研究[59]构建了IBV 疫苗株反向遗传系统,将相同血清型致病株M41、beaur 的S基因置换,结果发现该重组疫苗株能同时保护M41、beaur 株对被攻毒动物的攻击。有研究[60]构建了PRRSV反向遗传系统,发现所得重组病毒的毒性与亲本毒株相似,并可同时表达猪瘟病毒C 株E2基因和PCV-2 ORF2 基因。有研究[61]构建了水泡性口炎病毒反向遗传系统,并在此基础上将AIV 的HA基因和艾滋病病毒(HIV)的Gag和Env基因插入该载体中获得重组病毒,发现该重组病毒能特异性表达目的基因,且表达水平较高。除此之外,麻疹病毒、弹状病毒、黄病毒等具有在宿主中高效复制的特点,因此在病毒载体疫苗领域中也受到了相应关注。
2 细菌活载体疫苗
细菌活载体是指利用基因编辑方法将细菌的毒力基因致弱或敲除,并将病原体的抗原基因整合到细菌基因组或插入到质粒中,获得能表达目的基因的重组菌株。根据细菌载体的特性,将细菌载体分为减毒致病菌与非致病菌两类。细菌活载体疫苗具有保护外源DNA 不被降解、操作流程简单、培养方便、成本低、可诱导更高水平黏膜免疫等优点,同时也存在免疫效率不足和免疫抗原耐受的问题。用于细菌活载体疫苗的载体包括乳酸菌(Lactic acidbacteria)、沙门氏菌(Salmonella)等[62]。
2.1 乳酸菌活载体疫苗
乳酸菌属于革兰氏阳性菌,相比减毒疫苗和灭活疫苗,重组乳酸菌疫苗能够递呈抗原并诱导机体产生多种细胞因子,同时能够在人体肠道中持续定殖,长期释放特异性抗原蛋白引起机体免疫反应[63]。研究[64]构建的pValac 质粒,提高了乳酸菌向宿主细胞内部传递的效率,并能将其传递到猪肾细胞系内部。乳酸菌表达外源抗原主要有胞内、分泌和锚定3 种形式,多数研究认为锚定型重组菌能诱导机体产生更高水平的抗体。重组乳酸菌载体疫苗可以充当黏膜佐剂及抗原递呈剂,可在呈递目的基因的同时诱导机体产生IL-2 和IL-6,可提高重组载体黏膜给药能力。但乳酸菌活载体疫苗也存在在机体存活时间短、抗原表达水平有限等问题。乳酸菌活载体疫苗部分相关研究进展见表5。

表5 乳酸菌载体疫苗研究进展情况
目前,乳酸菌载体在动物疫病防控中的应用较多。在猪病方面,有研究[70-71]构建了可特异性表达PEDV 抗原基因的重组乳酸菌载体,并利用蛋白锚定技术将蛋白锚定在菌体表面。大多数传统的质粒递送载体使用抗生素基因作为选择性标记,这容易导致抗生素积累和基因污染。有研究[72]利用丙氨酸消旋酶基因代替抗生素基因进行筛选,并构建了表达PEDV 中和表位抗原基因的重组乳酸菌,将其注射至小鼠体内,发现可诱导小鼠体内IgG 水平升高。Shonela 等[73]构建了一株可特异性表达猪轮状病毒VP7 抗原的重组乳酸菌,将其注射至小鼠体内,发现可诱导高水平滴度的抗体。有研究[74]构建了可特异性表达鹅细小病毒VP7基因的重组乳酸菌载体,将其注射至小鼠体内,发现可使机体产生免疫反应。在禽病防控方面,乳酸菌更多作为佐剂来增强疫苗效果。有研究[68]构建了可特异性表达鸡IL-17B 基因的重组乳酸菌载体,经动物试验发现,实验组病毒载量明显低于对照组。目前,重组乳酸菌载体在反刍动物疫病防控方面的研究较少,可能是由于反刍动物消化系统结构及功能复杂导致重组乳酸菌载体在机体上表达的目的蛋白水平较低。有研究[75]构建了可特异性表达牛流行性腹泻病毒抗原基因的重组乳酸菌,将其经口递送至小鼠体内,发现可诱导小鼠产生较高水平的免疫反应。但这两项研究均未涉及牛的动物实验,所以未知其实际保护效力。
2.2 沙门氏菌活载体疫苗
沙门氏菌属于革兰氏阴性菌。突变型伤寒杆菌和鼠伤寒杆菌自身无法产生毒素且可在宿主肠道内长时间存活,能够诱导机体产生较高的免疫水平[76]。口服沙门氏菌减毒活疫苗除可以诱导肠道上皮的局部免疫外,还可诱导全身体液免疫和细胞免疫,同时可减少有害物产生。但在研制口服沙门氏菌减毒活疫苗过程中,必须考虑其在机体中的停留时间,毒力过弱可能导致其在机体定殖时间过短,无法引发免疫反应,故现构建减毒沙门氏菌载体时,更倾向于构建自毁减毒沙门氏菌。乳酸菌活载体疫苗部分相关研究进展见表6。

表6 沙门氏菌载体疫苗研究进展情况
最早通过化学和紫外线照射方式使沙门氏菌毒力基因发生突变从而达到减毒效果,后来发现带saoA基因的重组减毒肠炎沙门氏菌rSC0016 和rSC0012 株能够引起机体较强的免疫反应,近几年通过磷酸转移酶系统发现ptsI和crr基因突变菌株在诱导黏膜免疫反应方面非常有效[81]。减毒沙门氏菌载体多用于动物细菌病防控。有研究[82]构建了重组减毒沙门氏菌载体,使其表达猪链球菌特异性抗原或在沙门氏菌内包装病毒颗粒,以起到对该病原的保护作用。利用重组减毒沙门氏菌载体向小鼠体内递送猪肺炎支原体P42 和P97 抗原,发现小鼠体内细胞因子水平升高,并能抵御毒株攻击[83]。有研究[84]构建了表达布鲁氏菌抗原(SodC、Omp19、BLS 和PrpA)的重组减毒沙门氏菌载体,发现其可抵御小鼠和山羊免于布鲁氏菌的攻击。利用减毒沙门氏菌载体表达铜绿假单胞菌外膜蛋白F1I2,将其经皮下接种和口服给药后,发现皮下注射实现了更高的血清IgG 滴度和IgA 滴度[85]。减毒沙门氏菌载体在病毒病防控方向应用较少。利用重组减毒沙门氏菌载体向仔猪体内递送猪传染性胃肠炎病毒(TGEV)和PEDVS基因,可诱导仔猪产生较高水平的免疫应答反应[86]。
2.3 其他细菌活载体疫苗
大肠杆菌(Escherichiacoli)属于革兰氏阴性菌,其生长周期短,且重组质粒能稳定遗传。如今已发现大肠杆菌有多个种类,部分大肠杆菌菌株对机体具有一定的益生效果,同时大肠杆菌能够在机体肠道中定殖,进而刺激机体产生体液免疫反应[62]。近年来,有研究[87]构建了一株可特异性表达新型冠状病毒(SARS-CoV-2)抗原的重组大肠杆菌,可作为SARS-CoV-2 的候选疫苗株。Zhong等[88]证明重组枯草芽孢杆菌可以诱导机体产生局部的黏膜免疫、体液免疫和细胞免疫反应,可用于猪肺炎支原体感染的预防。
3 活载体疫苗抗原呈递策略
活载体疫苗的载体种类和抗原呈递方式会决定其外源蛋白的表达水平、安全性和免疫效果。抗原呈递的途径主要有MHC Ⅰ类和MHC Ⅱ类限制性抗原呈递途径。内抗原蛋白与抗原呈递细胞结合,并与MHC Ⅰ/Ⅱ分子结合,展示于抗原呈递细胞表面,诱导机体发生相应的免疫反应[89]。抗原呈递细胞包括B 淋巴细胞、巨噬细胞、树突细胞。活载体疫苗常用的抗原呈递策略有载体-宿主平衡致死系统、微生物表面展示系统等。
3.1 载体-宿主平衡致死系统
构建载体-宿主平衡致死系统,首先要将编码细菌生长繁殖的必需基因敲除,使细菌只能在特定添加某种营养物质的培养基中生存。可通过将含必需基因的质粒转化进繁殖缺陷菌的方式,使其能够在基础培养基上正常繁殖,也可通过使用生长繁殖所需的必需基因代替抗生素基因,以有效避免抗生素污染,使重组细菌载体疫苗在机体中稳定繁殖并产生良好的免疫反应。通常对减毒细菌载体进行改造或敲除的基因为表达必须营养物质基因部分片段。目前,该系统已被应用于开发乳酸菌、沙门氏菌、单核增生李斯特菌、大肠杆菌等多价疫苗中。
3.2 微生物表面展示系统
微生物表面展示系统是将重组蛋白锚定到细菌表面,使外源抗原展示在微生物表面。利用该方法可使抗原呈递水平比细胞质抗原呈递水平更高[90]。在疫苗研究领域,应用的微生物表面展示系统主要包括细菌表面展示系统与杆状病毒表面展示系统。
3.2.1 细菌表面展示系统 细菌表面展示系统是在原核表达系统的基础上,利用跨膜结构域、脂蛋白锚定、共价连接或非共价连接方式等将外源蛋白与细菌表面蛋白锚定连接[90]。革兰氏阳性菌的抗原呈递方式不同于革兰氏阴性菌。革兰氏阳性菌细胞壁厚,存在的膜蛋白较少,外源蛋白锚定困难,因此不能直接采用表面呈现方法进行外源蛋白呈递,而需要通过构建佐剂的方式使革兰氏阳性菌能够成功在其表面呈递抗原。有研究[91]通过处理乳酸菌得到了细菌形状的肽聚糖聚合体,它也被称为革兰氏阳性增强子基质(GEM),该结构缺乏细菌细胞壁成分和细胞质内物质,抗原可通过肽聚糖结合附着在GEM 颗粒表面。革兰氏阴性菌细胞壁较薄,膜蛋白容易表露在其表面。目前已有研究[92]构建了一株减毒沙门氏菌,发现其外源蛋白可与自身转运蛋白MisL 融合,因而提高了T 细胞对其免疫性的应答能力。
3.2.2 杆状病毒表面展示系统 以细菌为载体的表面展示系统采用的是原核表达系统,该系统难以表达结构复杂的生物蛋白。而杆状病毒表面展示系统属于真核生物展示系统。该系统允许大片段外源基因插入,因而能有效地在病毒粒子表面展示外源蛋白,而且可以对外源蛋白进行糖基化加工和折叠等翻译后修饰,尤其适合需进行特异的翻译后加工才能有效折叠和具有生物活性的高等真核生物细胞表面蛋白和分泌蛋白的展示。在该系统中,杆状病毒表面膜蛋白gp64 与外源蛋白融合,并在信号肽作用下转运至质膜从而引起免疫反应[93]。
4 展望
目前,细菌活载体疫苗和病毒活载体疫苗作为主要的活载体疫苗种类,在预防疾病方面均有不同的优缺点,应根据实际情况选择最优最适合的活载体疫苗种类,将其免疫效果发挥至最佳水平。同时,活载体疫苗抗体呈递方式的进步,提高了目的抗原在机体中的呈递效率,使其保护效力增强。尽管活载体疫苗在预防和控制动物疾病方面具有潜力,但仍需要进一步完善相关研究。通过对微生物载体基因组和遗传特征的深入研究,可以开发出更安全、稳定和高效的活载体疫苗。此外,对抗原呈递机制的深入研究非常重要。了解活载体疫苗如何诱导免疫反应,以及如何与宿主免疫系统相互作用,将有助于优化其设计,改进其效力。通过持续和完善的研究,不断改进活载体疫苗的设计和应用,可更有效地预防和控制各种疾病。

