微流控芯片环介导等温扩增技术检测3 种猪圆环病毒
石艳萍,邓 飞,周丽媛,李 丽,邵 靓,陈 斌,张孟思,邱明双,陈弟诗
(四川省动物疫病预防控制中心,四川成都 610041)
猪圆环病毒(porcine circovirus,PCV) 属于圆环病毒科圆环病毒属成员,目前已发现了PCV1、PCV2、PCV3、PCV4 共4 种基因型。通常认为,PCV1 不具有致病性,PCV2 可引起多种临床疾病,给全球养殖业带来了巨大经济损失,引起各国养猪业的高度重视。近年来,美国学者Phan 等[1]和Palinski 等[2]发现繁殖障碍母猪、皮炎肾炎综合征(porcine dermatitis and nephropathy syndrome,PDNS)猪、心肌炎猪和多系统炎症病变猪组织中存在一种新的PCV,其Cap 基因序列与PCV2 的相似性仅为24%~26%,将其命名为PCV3。我国学者采用PCR 方法从临床发病猪肺和淋巴结组织样品中也检出了PCV3,证明我国也存在该病毒[3-4]。2019 年,在我国又发现一种新型PCV——PCV4[5]。PCV4 对仔猪也具有致病性,对养猪业构成极大的威胁。目前PCV 检测主要依靠免疫学和分子学检测技术,但是免疫学技术敏感性和特异性较差,分子学检测常用的PCR 方法也存在抑制问题,加之PCV2 和PCV3 感染能导致相似的临床症状,PCV4 也没有快速有效的检测方法,因此十分有必要建立一种快速、高效、敏感、特异的检测方法来区分这3 种具有致病性的PCV。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP), 由日本学者Notomi 等[6]发明,是一种核酸恒温扩增技术,其依赖于BstDNA 聚合酶大片段的置换活性,利用4条特异性引物在60~65 ℃、1~2 h 条件下完成对目标片段序列的等温扩增,具有经济实用、高效、快速和简便等特点,已被用于多种猪病原的检测,如猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒等。微流控芯片技术是通过生物学、化学、医学以及电子、材料、机械等多学科交叉,将分子生物学、化学分析、医学等领域所涉及的样品前处理、分离及检测等过程集成到几平方厘米的芯片上,从而实现分析技术的微型化、自动化、集成化和便携化,具有样品消耗少、检测速度快、操作简便、多功能集成、体积小和便于携带等优点,已在多个领域得到应用[7-8]。此外,微流控芯片体积小巧、操作简单,极大拓展了现场诊断的应用空间[9],与LAMP 相结合更是得到了许多研究者的青睐[10]。本研究分析了微流控芯片LAMP 法在3 种PCV 核酸快速检测中的性能和应用性,并与商品化PCV荧光定量检测试剂盒检测结果进行比较分析,以期为PCV 的鉴别检测及该病防控提供技术参考。
1 材料与方法
1.1 样品
非洲猪瘟病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒和猪细小病毒阳性样品,均来自四川省动物疫病预防控制中心实验室;3 种分别含有PCV2、PCV3、PCV4 目标序列的质粒,购自生工生物工程上海股份有限公司,分别依次10 倍稀释至106~101copies/μL;36 份实际样本核酸,采自四川省多个猪场。
1.2 主要试剂
3 种PCV(PCV2、PCV3、PCV4)荧光定量PCR 检测试剂盒,微流控芯片和反应液,磁珠法核酸提取试剂盒,均购自宁波爱基因科技有限公司。PCV2、PCV3 和PCV4 芯片检测孔均包埋了对应引物,PCV 混合芯片检测孔依次包埋了PCV2、PCV3、PCV4 共3 种病毒引物。引物,购自生工生物工程上海股份有限公司。PCV2、PCV3、PCV4对应的检测孔包埋引物用量分别为,90 μmol/L 的PCV-F3 和PCV-B3 引物各0.5 μL,180 μmol/L 的PCV-FIP 和PCV-BIP 引物各2.0 μL。
1.3 主要仪器
PCR 仪,购自杭州博日公司;微流控芯片检测仪(型号MA2000),购自宁波爱基因科技有限公司。
1.4 引物设计
通过NCBI GenBank 寻找目标序列,并针对目标序列设计引物。

表1 PCV 恒温扩增引物
1.5 核酸提取
采用磁珠法核酸提取试剂盒,按试剂盒说明书操作。
1.6 核酸扩增程序
将18 μL 反应液与32 μL 模板核酸混合,加入到芯片加样孔,再将加样孔用封口膜封住,上机。反应条件:温度设定为63.5 ℃,时间设定为30 min;运行程序:低转速1 600 r/min 离心10 s,高转速4 600 r/min 离心30 s。
1.7 灵敏度测试
将10 倍倍比稀释的标准质粒作为模板分别进行恒温扩增,确定出最低拷贝浓度,试验设空白对照。
1.8 重复性测试
使用104copies/μL 的标准质粒DNA 为模板进行试验,重复8 次,计算变异系数(CV),评价其重复性。
1.9 交叉特异性测试
以104copies/μL 的PCV2、PCV3、PCV4 标准质粒DNA 为模板,分别使用PCV2、PCV3、PCV4 引物测试标准质粒,评估引物的交叉特异性。
1.10 特异性测试
以非洲猪瘟病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒和猪细小病毒基因组DNA 为模板,使用已包埋PCV 引物的芯片进行扩增,分析其特异性。试验设无核酸水阴性对照。
1.11 应用实际样本测试PCV 联检芯片灵敏度及符合率
分别将PCV2、PCV3、PCV4 质粒倍比稀释至106~101copies/μL;先将充分混匀的核酸样本和荧光预混液全部加进加样孔,然后利用离心力来定向驱动样本混合液流动,使其均匀分配到4 个反应孔,经恒温扩增并实时荧光读取,信号输出,呈现结果,最后与荧光定量PCR 对比灵敏度。选取36 份实际样本核酸,分别进行微流控芯片LAMP 扩增和荧光定量PCR 扩增,然后对比结果。
1.12 数据的统计分析
用PCV 微流控芯片快速检测芯片配套的微流控恒温扩增仪自动分析软件进行数据统计分析,对照试剂盒的扩增结果用荧光定量PCR 仪自动分析软件进行数据统计分析。
2 结果与分析
2.1 灵敏度测试
将PCV2、PCV3、PCV4 质粒倍比稀释至106~101copies/μL,发现PCV2、PCV3 和PCV4 的最低检测限均可达到102copies/μL(图1)。
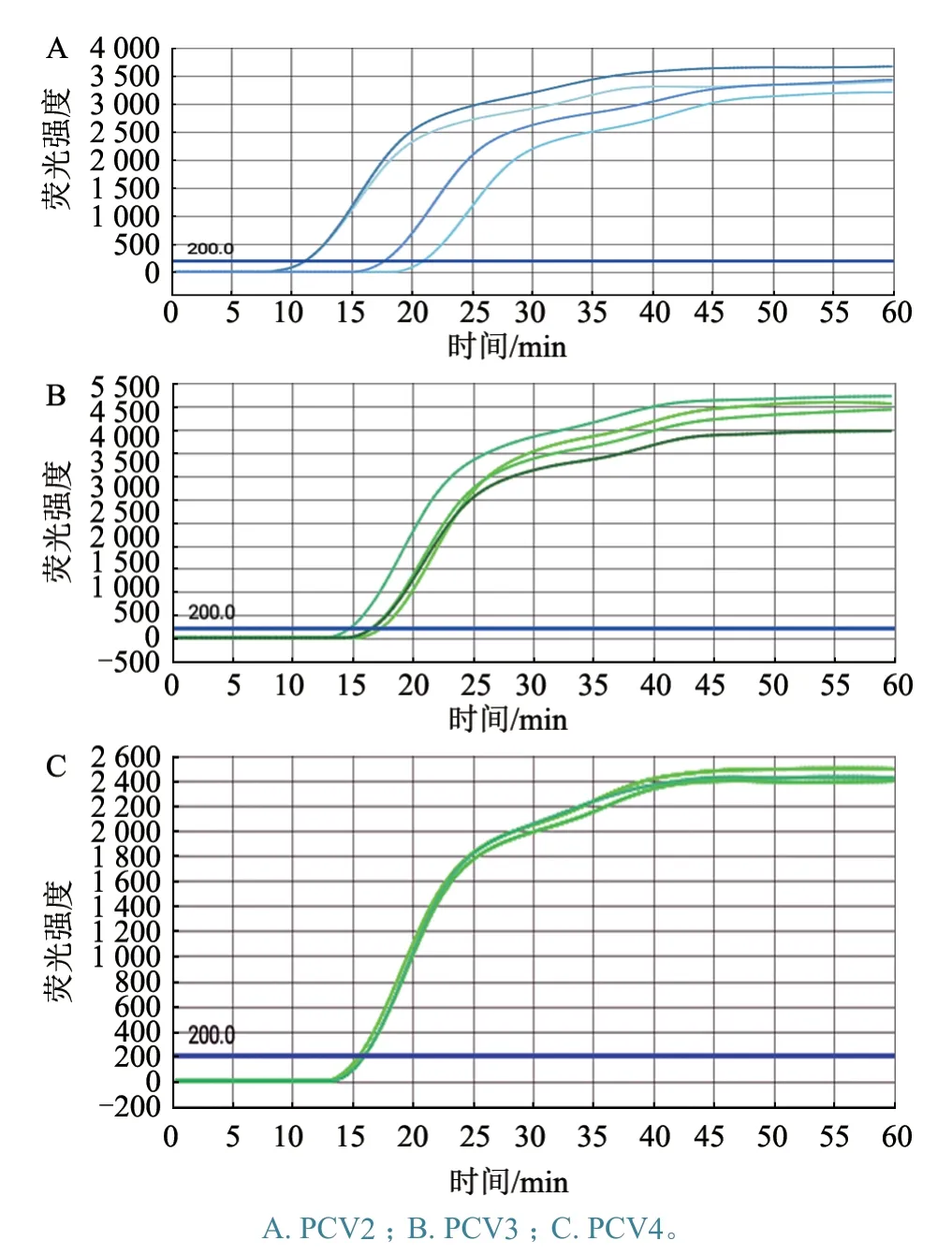
图1 灵敏度扩增结果
2.2 重复性测试
选取浓度为104copies/μL 的3 种PCV 标准质粒DNA 为模板,重复扩增8 次。扩增结果见图2,各浓度的扩增Ct 值以及重复性测试CV 值见表2。该方法测出重复性CV 值均小于2%,说明本研究所建立的微流控芯片LAMP法具有良好的重复性。
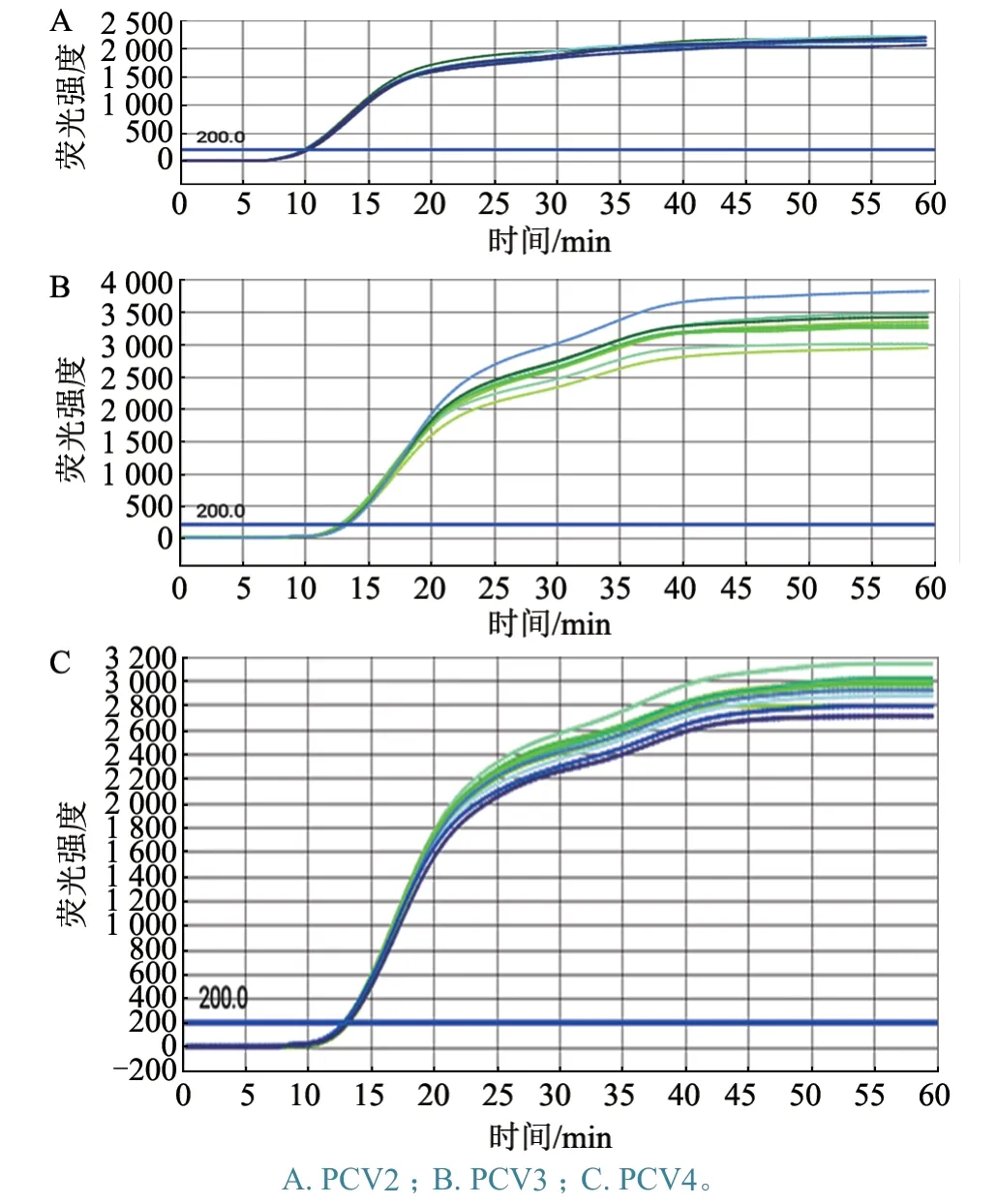
图2 重复性扩增结果

表2 3 种PCV 重复性测试结果(Ct 值)
2.3 交叉特异性测试
选取浓度为104copies/μL 的3 种PCV 标准质粒DNA 为模板,分别用PCV2、PCV3、PCV4 引物扩增标准质粒(图3),结果各引物只能扩增出相应的质粒,说明该方法具有良好的交叉特异性。

图3 交叉特异性扩增结果
2.4 PCV 特异性扩增
采用非洲猪瘟病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒和猪细小病毒阳性样本,对PCV 微流控芯片LAMP 法分别进行特异性分析(图4),除阳性样本3 种PCV 出现明显“S”形扩增曲线外,其他样本检测结果均为阴性,无交叉反应,说明该方法对3 种类型PCV 特异性良好。

图4 特异性扩增结果
2.5 3 种PCV 联检芯片的灵敏度和符合率实际样本测试
微流控芯片具有A—H 共8 个扇区,每个扇区有8 套反应系统,每套反应系统具有加样孔、分液孔、排气孔、毛细管道、反应孔等结构。图5 所示,A1/B1/C1/D1/E1/F1/G1/H1 是PCV2 检测孔,A2/B2/C2/D2/E2/F2/G2/H2 是PCV3 检测孔,A3/B3/C3/D3/E3/F3/G3/H3 是PCV4 检测孔,A4/B4/C4/D4/E4/F4/G4/H4 是对照检测孔。

图5 检测芯片孔位
本试验通过梯度稀释混合阳性样本,分析微流控芯片LAMP 法的敏感性。结果如表3 所示:实际样本中,PCV2、PCV3、PCV4 微流控芯片LAMP 法的检出限分别是103、104、103copies/μL,其中PCV2 微流控芯片LAMP 法的检测灵敏度高于荧光定量PCR 1 个梯度,PCV3 和PCV4 微流控芯片LAMP 法则与荧光定量PCR 的灵敏度一致。

表3 3 种PCV 恒温扩增与荧光定量PCR 灵敏度对比结果
分别使用微流控芯片LAMP 法与荧光定量PCR 法,对36 份实际样本以及模拟样本进行检测。扩增结果(表4)显示:PCV2 使用微流控芯片LAMP 法检出阳性11 份,阳性率为30.5%;PCV3使用微流控芯片LAMP 法检出阳性7 份,阳性率为19.4%;PCV4 使用微流控芯片LAMP 法检出阳性5 份,阳性率为13.9%。PCV2、PCV3 和PCV4的荧光定量PCR 检测结果均与微流控芯片LAMP法检测结果相同,符合率均为100%。
3 讨论
PCV 目前包括4 个基因型——PCV1、PCV2、PCV3 和PCV4。PCV1 与PCV2 具有极为相似的基因组结构与组成,大小均为1.76 kb 左右,两者的核苷酸同源性达76%以上,且它们的大多数核苷酸序列区域具有高度一致性,故在设计PCV2 引物时需要特别注意,否则所设计引物很可能对PCV2 的特异性不足,易于混淆检出PCV1。2003 年以前PCV2a 为主要流行毒株,而近年来PCV2b 感染较为普遍[11]。2016 年10 月,从流产胎猪中检测到高拷贝的PCV3 基因组。国外报道PCV3 感染可能与猪皮炎和母猪繁殖障碍相关,但其致病性还不十分清楚。同样,PCV4 作为一种新出现的基因型,其相关报道也不多,其流行情况、致病性、传染性也不明确。这些病毒的检测方法主要有PCR、荧光定量PCR 和核酸探针[12]。我国学者采用PCR 方法进行了大量样品检测,但需要价格昂贵的PCR 检测仪器。荧光定量PCR 及核酸探针方法条件要求更高,很难普及推广。而LAMP不需要昂贵的仪器设备,在等温条件下就能快速完成反应。目前该项技术已被广泛用于细菌、病毒、寄生虫检测和动物胚胎鉴定等领域[13]。
本研究采用微流控芯片LAMP 法和荧光定量PCR 法对3 种PCV 样本进行检测,发现微流控芯片LAMP 法方法的灵敏度、重复性和特异性等性能均不低于荧光定量PCR 法,符合对3 种PCV 的检测要求。
实际操作中,在分析3 种PCV 的特定核苷酸序列区域差异后设计引物,在试剂中加入纳米金材料,吸附ssDNA 和蛋白酶,抑制升温过程中的非特异性反应,达到热启动的目的,避免在升温过程中的非特异性反应,且对PCV 以外的其他常见猪源病毒均无扩增现象,显示出高特异性。重复性试验的CV 值均低于2%,显示出很好的可重复性。荧光定量PCR 检测时间较长,一般在1 h 以上,加样量复杂,对仪器要求高,而微流控芯片快速检测时间仅需要30 min,检测时间节约了1/2。在敏感性测试上,本研究的微流控芯片LAMP 法灵敏度不低于荧光定量PCR 法。另外,本研究建立的针对PCV 的微流控芯片LAMP 法,操作过程中加样孔采用封口膜密封,杜绝了污染造成的假阳性风险。同时将反应试剂预埋于微流控芯片上,用户只需加入样品,操作简便,仪器配备锂电池,便于现场快检。本方法也可以实现同一样品多个不同指标联检的目的。
随着猪病毒混合感染情况越来越严重,在进行猪病诊断过程中,常规PCR 和荧光定量PCR 技术虽然准确性和灵敏度较高,但是要消耗大量的检测试剂,需要足够多的仪器设备以及大量的重复工作,这些问题给实验室造成了巨大压力[14]。本研究建立的3 种PCV 联检方法,只需1 次反应,就能检测3 种病毒,节约了一半的检测成本,整个检测时间只需30 min,能够满足临床快速检测的需求,可用于猪病毒混合感染的临床检测。
本研究仅对3 种PCV 一次配置的试剂及对应的荧光定量PCR 检测试剂盒某一批号的检测结果做了简要比较分析,样本量有限,结果并不能代表各试剂的整体检测性能。阳性样本数量亦有限,如有条件,需扩大临床样本量,进一步对不同试剂的核酸提取质量等指标进行有效评价,以验证PCV微流控芯片快速联检试剂的各项性能,为不同类型的猪相关病原检测及监控提供有力工具。同时,随着微流控和基因芯片等新技术不断应用于动物疫病检测领域[15-16],未来PCV 的病原学检测将更加快速、准确及自动化,必会进一步为猪病防控提供有效支持。

