3 种方法检测禽网状内皮组织增殖病毒人工感染鸡胚孵化雏鸡的带毒比较
徐凤霞,孙万里,张亚文,常 爽,王一新,赵 鹏
(山东农业大学动物科技学院,山东泰安 271018)
禽网状内皮组织增殖病(reticuloendotheliosis,RE) 是由禽网状内皮组织增殖病病毒(reticuloendotheliosis virus,REV)感染引起的一种病毒性肿瘤病和免疫抑制性疾病,临床主要表现为免疫抑制、致死性网状细胞瘤以及生成慢性肿瘤等[1]。REV 的自然宿主有鸡、火鸡、鸭、鹅等禽类,其中火鸡最易感染,实验室常用鸡作为研究宿主[2]。REV 极易引起低日龄禽类患病,导致患禽抵抗力下降,继发其他细菌病或者病毒病。而成年禽类对REV 抵抗能力强,感染后一般不出现症状或仅出现一过性病毒血症[3]。从REV 抗体阳性鸡的肝脾组织中分离得到REV-C45 株后,我国研究学者在国内各个地区进行了流行病学调查,结果在多个地区检测到REV[4-9]。目前,尚未有商品化生物制品或药物来有效防控RE,同禽白血病等垂直传播性疾病一样,可考虑实施种源净化等措施来控制该病。
REV 感染禽主要表现非特征性临床症状,即便剖检后肝脏、胸腺或法氏囊等器官出现特征性病变,仍然难以与其他免疫抑制病区分[10],因此仅通过临床表现及剖检实现对REV 感染的鉴别诊断难度较大,需要通过实验室检测加以确诊。垂直传播是REV 最重要的传播方式,通过特定时间和特定检测技术及时发现并淘汰垂直传播感染鸡是开展REV 净化的关键步骤。为此,本研究通过鸡胚卵黄囊接种,人工构建了REV 垂直传播感染SPF 雏鸡模型,分别采集出壳后鸡的胎粪/泄殖腔棉拭子和血液,比较病毒分离、RT-PCR 和荧光定量RTPCR 这3 种常用病原检测技术在不同检测节点的REV 阳性检出率,以期为实施REV 种源净化提供参考数据。
1 材料与方法
1.1 毒株与实验动物
REV 野毒株LN1201 株,为2012 年山东农业大学实验室从某父母代种鸡场疑似患禽肿瘤病的鸡血浆中分离得到,已完成全基因组测序(GenBank登录号KU641115.1)。SPF 鸡胚,购自山东济南斯帕法斯家禽有限公司。接种REV 的鸡胚孵化至21 日胚龄后,鸡出壳饲养于山东农业大学SPF 实验动物房内。
1.2 抗体与检测试剂盒
REV 特异性单克隆抗体小鼠纯化腹水11b118,由山东农业大学家禽肿瘤病和免疫抑制病研究室制备和保存,其效价为1:8 000;FITC 标记的羊抗鼠IgG 抗体(批号Q10328),购自北京全式金生物技术有限公司;病毒RNA 提取试剂盒(批号R68740200000I26V003),购自美国OMEGA 公司;Evo M-MLV 反转录试剂盒(批号A4A2926)和SYBR Green ProTaqHS 预混型qPCR 试剂盒II(批号A4A3047),购自湖南艾科瑞生物工程有限公司。
1.3 动物试验设计
取50 枚SPF 鸡胚,待孵化至6 胚龄时,经卵黄囊接种LN1201 株病毒液,接种剂量为1 500 TCID50/枚,作为卵黄囊感染组,代表REV 经鸡胚垂直传播感染;另取同胚龄SPF 鸡胚10 枚接种等体积生理盐水,正常孵化后作为空白对照组。孵化出壳后采集雏鸡胎粪/泄殖腔棉拭子和抗凝血,接种DF-1 细胞进行病毒分离或提取核酸进行分子生物学检测。
1.4 不同日龄鸡胎粪/泄殖腔棉拭子及血液样品的REV 分离
分别于雏鸡出壳后1、7、14、21、28、35、42、49、56、63 及70 日龄时,对鸡胚卵黄囊感染组和空白对照组无菌采集抗凝血及胎粪/泄殖腔棉拭子,对抗凝血3 000 ×g离心2 min 分离血浆,对胎粪/泄殖腔棉拭子涡旋混匀后取上清液,经0.22 μm 滤器过滤;将上述血浆及滤液无菌操作接种于DF-1细胞,维持7 d后以细胞固定液固定细胞,以REV 特异性单克隆抗体11b118 作为第一抗体,FITC 标记的羊抗鼠IgG 作为第二抗体,通过间接免疫荧光法(IFA)检测各组的REV 病毒血症及胎粪/泄殖腔棉拭子REV 分离率,观察试验结果并记录阳性率。
1.5 不同方法检测各节点REV 核酸
根据GenBank 上已发表的REV 全基因组序列,使用Primer 6.0 软件设计针对REVpol基因的引物用于检测样品的RNA,引物序列见表1。参照OMEGA viral RNA 提取试剂盒使用说明,从胎粪/泄殖腔棉拭子和抗凝血样品中提取核酸后进行RT-PCR 检测。荧光定量RT-PCR 检测,按照艾科瑞生物工程有限公司SYBR Green ProTaqHS 预混型qPCR 试剂盒II 说明书,用优化好的反应条件,在罗氏荧光定量PCR 仪上进行SYBR Green 实时荧光定量PCR 扩增。

表1 用于检测REV 的引物
2 结果与分析
2.1 不同方法检测1 日龄雏鸡血浆及胎粪REV 阳性检出率比较
接种REV 的鸡胚共孵出雏鸡25 只,另外25只鸡胚孵化期间出现死胚或鸡胚破壳力不足致小鸡不出壳且剥开有血,死亡时间集中在17~20 胚龄。如表2 所示,对卵黄囊感染组1 日龄出壳的SPF鸡血浆进行检测,发现荧光定量RT-PCR 检出率最高(100%,25/25),其他依次为病毒分离(96%,24/25)、RT-PCR(36%,9/25);对卵黄囊感染组1 日龄出壳的SPF 鸡胎粪进行检测,发现3 种方法的阳性检出率均低于血浆。可以看出,对于1日龄雏鸡血浆,荧光定量RT-PCR 和病毒分离用于净化时检测REV 垂直传播的效果俱佳。
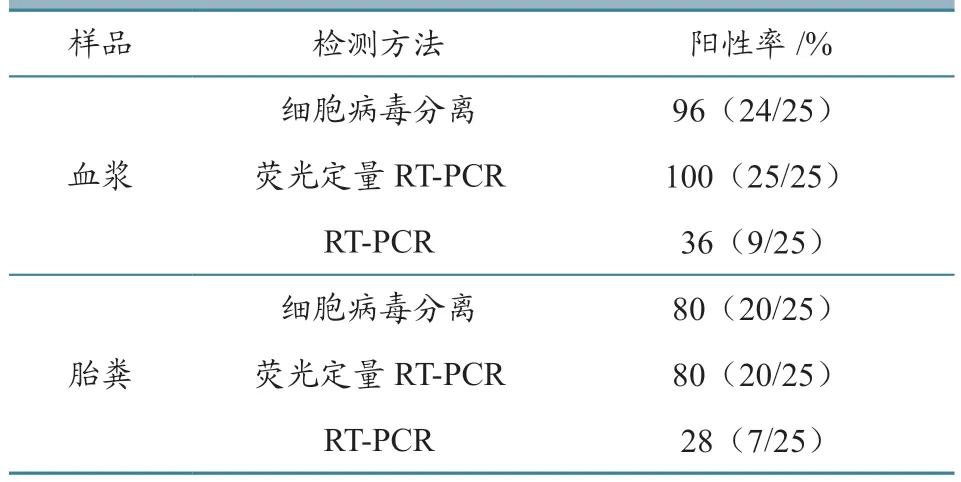
表2 1 日龄雏鸡血浆及胎粪抗原检测与病毒分离结果
2.2 不同方法对不同日龄鸡血浆的REV 动态检测
各组于7~70 日龄每隔1 周无菌采集抗凝血,分别采用细胞病毒分离、RT-PCR 以及荧光定量RT-PCR 检测REV,比较不同方法的阳性检出率。如表3 所示:不管采用何种检测方法,空白对照组血液中始终未分离到REV 或检测到REV 核酸,表明空白对照组SPF 鸡始终保持REV 阴性,并且各检测方法特异性良好。卵黄囊感染组血液的病毒分离阳性检出率从7 日龄时的89%很快升至100%,并且在随后的监测周期内基本保持100%,表明REV 通过垂直传播容易形成持续性病毒血症;荧光定量RT-PCR 的阳性检出率在监测周期内始终保持100%;普通RT-PCR 的阳性检出率显著较低,最高时仅为67%,可能造成漏检。上述结果与1日龄雏鸡血浆及胎粪REV 的检测总体一致。

表3 不同检测方法对7~70 日龄鸡血浆的REV 动态阳性检出率 单位:%
2.3 不同方法对不同日龄鸡泄殖腔棉拭子的REV动态检测
如表4 所示:与雏鸡血液的动态检测结果总体一致,空白对照组泄殖腔棉拭子始终未分离到REV 或检测到REV 核酸,表明空白对照组鸡群始终保持阴性,且检测方法特异性较好。整个试验期间,卵黄囊感染组试验鸡均持续不断通过粪便向外排毒,7 日龄时,病毒分离、RT-PCR 以及荧光定量RT-PCR 均能从泄殖腔棉拭子中检测到REV,但不同时期3 种检测技术对泄殖腔棉拭子的阳性检出率动态规律与血液并非完全一致。有时泄殖腔棉拭子REV 阳性检出率低于同时期血液,如7 日龄时泄殖腔棉拭子和血液经RT-PCR 检测阳性检出率分别为21%和32%;有时高于同时期血液,如70日龄时分别为100%和40%。但结合病毒分离及荧光定量RT-PCR 数据,发现血液中的REV 阳性检出率总体上高于粪便。由此表明,REV 在血液和粪便中的带毒排毒并非完全一致,因此为提高净化检测效率,在进行实际病原监测时不能只依赖一种检测方法或样本。
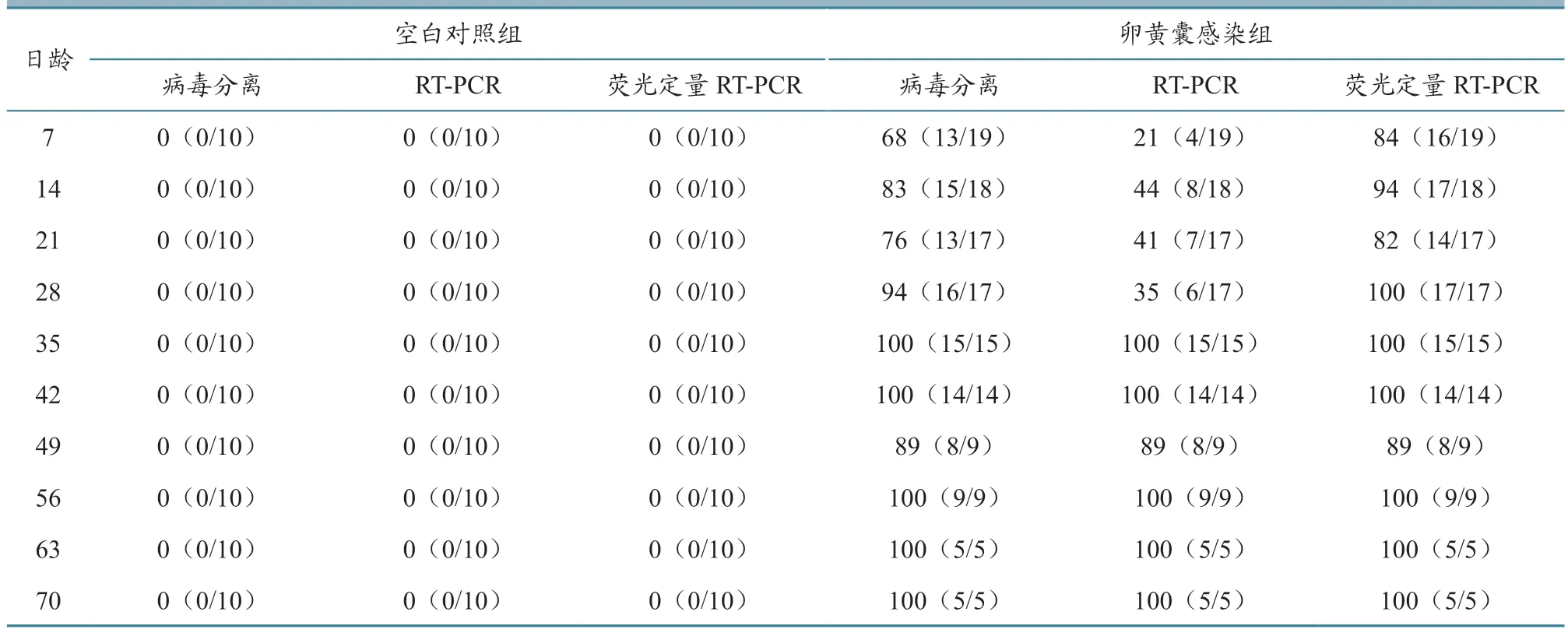
表4 不同检测方法7~70 日龄鸡泄殖腔拭子的REV 动态阳性检出率 单位:%
3 讨论
REV 是鸡群中一种常见的垂直传播性免疫抑制病毒,可引发肿瘤和免疫抑制,严重危害养禽业[11-12]。REV 与禽白血病病毒(avian Leukosis virus,ALV)有很多相似性,它们同属于逆转录病毒、免疫抑制性病毒,均可以垂直传播。目前,对于禽白血病,主要实施种源净化加以控制。种源禽白血病净化依赖于摸清ALV 排毒规律,需要通过研究和比较可靠的检测样品和方法实施净化淘汰[13-15]。
在实施禽白血病净化检测时,出壳雏鸡的胎粪检测是实施净化的重要步骤,目前最简单快速的初筛方法就是采集出壳雏鸡胎粪进行ALV 群特异性衣壳蛋白27(p27)抗原检测,以此首先检测出经垂直传播感染带毒的雏鸡,这一检测步骤对于尽可能早地检出和淘汰ALV 阳性雏鸡,最大程度降低垂直传播及其带来的早期水平传播极为重要[16-17]。参照这一重要步骤,本研究通过鸡胚卵黄囊接种人工构建了REV 垂直传播感染雏鸡模型,待鸡出壳后分别采集胎粪/泄殖腔棉拭子和血液,使用病毒分离、RT-PCR 和荧光定量RT-PCR 这3 种病原学检测方法进行检测,发现不管是检测胎粪/泄殖腔棉拭子还是血液,3 种方法检测结果均可很好地显示出REV 垂直传播感染的特性,但不同样品和不同方法阳性检出率有差异。如:荧光定量RT-PCR检测1 日龄雏鸡血液REV 阳性检出率达到100%,检出率最高;细胞病毒分离的阳性检出率始终较高,不管是胎粪/泄殖腔棉拭子还是血液,检出率与荧光定量RT-PCR 检测基本接近。
不管是REV 还是ALV,通过鸡胚垂直传播时容易形成持续性病毒血症。7~70 日龄连续的抗凝血检测结果也进一步证实了这一点,荧光定量RTPCR 检测REV 阳性检出率始终为100%,多数时间点细胞病毒分离的REV 阳性检出率也为100%。通过两种检测方法检出率对比,发现各检测时间点的胎粪/泄殖腔棉拭子REV 检出规律与雏鸡血液总体一致,荧光定量RT-PCR 和病毒分离对胎粪/泄殖腔棉拭子的REV 检出率始终不高于血液,特别是在前三周龄内。在实施REV 净化时,荧光定量RT-PCR 比病毒分离具有更为明显优势:首先,在试验人员的操作要求方面,病毒分离试验中涉及的细胞培养、血浆分离、血浆接种细胞等均需无菌操作,而荧光定量RT-PCR 操作相对简便,能够使鸡场及时发现隐性感染鸡,尽早淘汰患病母鸡,从而减少经济损失;其次,由于REV 接种DF-1 细胞并不能产生明显的细胞病变,因此需要结合IFA才能完成对REV 的检测,导致传统的病毒分离方法容易受到IFA 试验中单抗及二抗质量的影响,而荧光定量RT-PCR 只需通过特定引物或探针对核酸进行扩增,可明确检出结果,避免漏检;最后,荧光定量RT-PCR 可同时检测多个样本,极大提高了检测效率。
试验结果同时表明,对粪便进行REV 核酸检测虽然可以简便而有效检出感染和携带REV的鸡,但检出率低于血液,造成粪便检出率较低的原因一部分可能是由于血浆从分离到接种一直是无菌操作,而粪便样本相比于血浆成分复杂,必须使用滤器过滤后才可接种细胞,且温度对REV 的影响较大,粪便样本无菌处理极有可能导致部分病毒死亡,因此在实施净化时要结合血液检测才能更好地全面检出所有感染的雏鸡。
综上,本研究在构建了REV 垂直传播感染模型基础上,比较了病毒分离、RT-PCR 和荧光定量RT-PCR 对各时间点血液和胎粪/泄殖腔棉拭子样品的REV 阳性检出率,这些规律为未来制定科学的种鸡REV 净化程序奠定了基础。

