纳米孔测序技术对一份禽流感病毒阳性样品的分子溯源
高志强,汪 琳,刘 环,白子龙,赵相鹏,蒲 静,张 伟
(中国海关科学技术研究中心,北京 100026)
禽流感病毒(avian influenza virus,AIV)属于正黏病毒科A 型流感病毒属,是唯一能感染禽鸟的正黏病毒。A 型流感病毒可感染多种禽鸟,而水禽是其主要贮存宿主。目前已发现AIV 有18种血凝素(haemagglutinin,HA)亚型和9 种神经氨酸酶(neuraminidase,NA)亚型。迄今为止,自然发生的高致病性禽流感疫情均由H5 或H7 亚型AIV 引起。而禽类中广泛存在的低致病性H5 或H7 亚型AIV 可因基因突变而转变为高致病性毒株,而且很可能发生外溢,跨种感染人类和哺乳动物,一直备受关注[1]。
在对AIV 进行检测和分子流行病学调查时,检测的时效性和准确性缺一不可,特别是在疫情暴发时进行分子溯源和快速全基因组测序,对于疫情控制起着至关重要的作用。常规的禽流感分子流行病学调查需要进行病毒分离鉴定,通过RT-PCR扩增各基因片段并进行Sanger 测序,或者通过以Illumina 平台为主的二代建库测序[2-3]。基于病毒分离后进行的全基因组测序,对生物安全条件要求较高,往往需要生物安全三级以上条件;同时一、二代测序技术读长短,测序时间长,文库制备和数据处理复杂,因此测序时间较长,常常需要2~3 周甚至更长时间。近年来,纳米孔测序技术凭借其操作简便、长读长,以及快速和实时读取测序数据的优势,在病原测序领域广受青睐[4-5]。针对样品中的病原体,采用“叠瓦式”靶向富集技术,可实现低丰度病毒的快速全基因组测序[6];进一步采用灭活型采样技术,可以降低AIV 分子溯源的生物安全风险,极大提高AIV 分子溯源的便利性。
本研究选取实验室保存的AIV 核酸阳性灭活拭子样品,提取病毒基因组,应用靶向引物池对病毒全基因组进行富集后,使用纳米孔测序技术进行快速测序,在6 h 内获得了样品中病毒的全基因组序列,经序列分析比对,表明其为H5N5 亚型AIV,序列覆盖度为96.44%,是一种基因重配病毒。本研究首次采用靶向纳米孔测序技术直接进行拭子样品中AIV 的全基因组测序,为口岸动物及产品的精准检测提供了新的可靠方法。
1 材料和方法
1.1 被检样品
灭活AIV 核酸阳性鸭泄殖腔拭子样品,来自某鸭场送检,由本实验室保存。
1.2 主要试剂
病毒基因组DNA/RNA 提取试剂盒(DP3165),购自天根生化科技有限公司;A 型流感病毒全基因组靶向捕获试剂盒(BK-WIFA024),连接法测序多样本DNA 建库辅助试剂盒(BK-AUX024),购自杭州柏熠科技有限公司;连接测序试剂盒(SQK-LSK110)、无扩增条形码扩展试剂盒(EXP-NBD104),芯片清洗试剂盒(EXP-WSH004),Spot-ON Flow Cell 测序芯片(FLO-MIN106D),均购自NANOPORE 公司;M-MLV 反转录酶、RNA 酶抑制剂,购自Promega 公司;HSTaqDNA聚合酶、dNTP 等,购自TaKaRa 公司;引物及双标记探针,均委托生工生物工程(上海)股份有限公合成。
1.3 主要设备
Qubit Flex 荧光计、QuantStudio 5 荧光定量PCR 仪,为Thermo Fisher 公司产品;GridIONx5纳米孔测序仪,为NANOPORE 公司产品。
1.4 核酸提取
测序当天,充分振荡拭子样品,然后吸取200 μL 使用商品化病毒基因组DNA/RNA 提取试剂盒提取核酸,洗脱于60 μL 无核酸酶水中,4 ℃保存备用。
1.5 荧光RT-PCR 检测
依据国家标准GB/T 27539—2011[7]合成引物探针,配制反应体系,进行A 型流感病毒通用荧光RT-PCR 检测,确定Ct 值范围。
1.6 A 型流感病毒全基因组靶向捕获
使用Qubit Flex 荧光计测定核酸浓度后,应用A 型流感病毒全基因组靶向捕获试剂盒,按照操作说明进行全基因组序列的靶向捕获。
1.7 AIV Nanopore 文库构建
首先将约300 ng 捕获产物使用连接法测序多样本DNA 建库辅助试剂盒,按照说明进行末端修复,修复后使用试剂盒中的配套磁珠纯化试剂纯化产物,应用无扩增条形码扩展试剂盒中的NB01 和NB02 条形码,按照说明分别对纯化产物进行条形码连接;连接结束后,使用试剂盒中配套磁珠纯化试剂纯化产物,将NB01 和NB02 两管产物混合后连接Adapter,反应结束后再次使用试剂盒中配套磁珠纯化试剂纯化产物,即为构建的文库。
1.8 测序及芯片清洗
按照操作说明将试剂盒中Flush Tether 和Flush Buffer 混合均匀,制备成测序芯片缓冲液,将测序芯片排气后,将缓冲液从Priming port 匀速推入管路;将构建的文库与试剂盒中适当体积的测序Buffer 及Loading Beads 混匀后,匀速滴入芯片SpotON sample port 孔中;关闭各个阀门,将芯片装载到GridIONx5测序仪上进行测序。测序结束后,使用芯片清洗试剂盒,按照说明对测序后的芯片进行清洗,清洗后加入Buffer 置于4 ℃正向密封保存。
1.9 数据处理与分析
测序过程中可实时进行碱基识别(basecalling),运行1 h 后,将输出文件夹中的barcode01 和barcode02 文件夹中的*. fastq 文件整合到一个文件夹中,导入BAIYITECH 流感病毒全基因组分析模块进行序列拼接和初步分析,初步确定测序覆盖率和毒株亚型。
1.10 进化分析
在GISAID 网站通过BLAST 分析拼接到的序列,确定各片段最大核苷酸相似性最大的毒株,并下载相应参考毒株HA和NA基因片段核苷酸序列进行系统进化分析。用MAFFT 7.52 软件进行序列比对,采用 Geneious 9.0 软件的UPGMA 方法构建病毒序列系统进化树。
2 结果
2.1 荧光RT-PCR 检测与核酸质量浓度定量
该阳性样品经荧光RT-PCR 检测,结果Ct 值为21.97(图1),阳性对照为AIVM基因体外转录RNA。经Qubit Flex 荧光计定量,核酸质量浓度为4.54 ng/μL,吸取10 μL 提取的RNA 进行靶向捕获和后续的文库构建和序列测定。
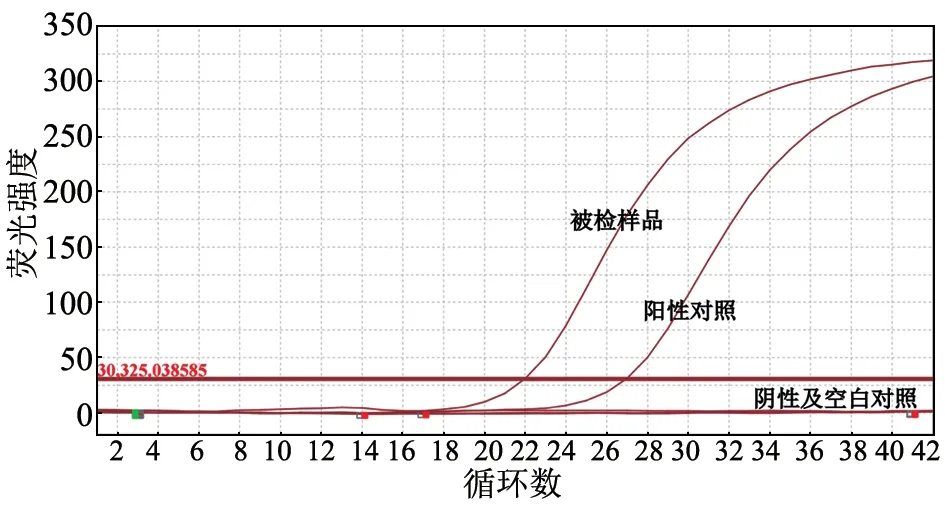
图1 阳性样品荧光RT-PCR 扩增结果
2.2 样品中AIV 测序
将序列数据导入BAIYITECH 流感病毒全基因组分析模块进行序列组装和初步分析。序列鉴定结果显示,样本中的病毒为H5N5 亚型AIV,序列覆盖度为96.44%。鉴定桑基图见图2,产生数据碱基数与读长分布见图3,测序覆盖度汇总见表1。
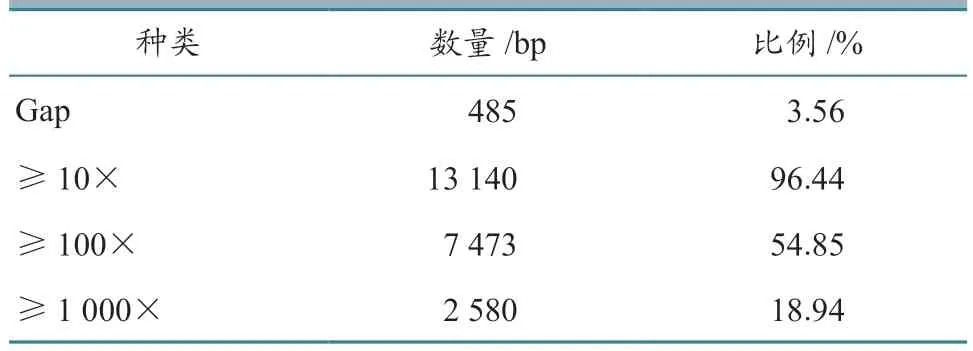
表1 测序覆盖度汇总

图2 序列鉴定桑基图
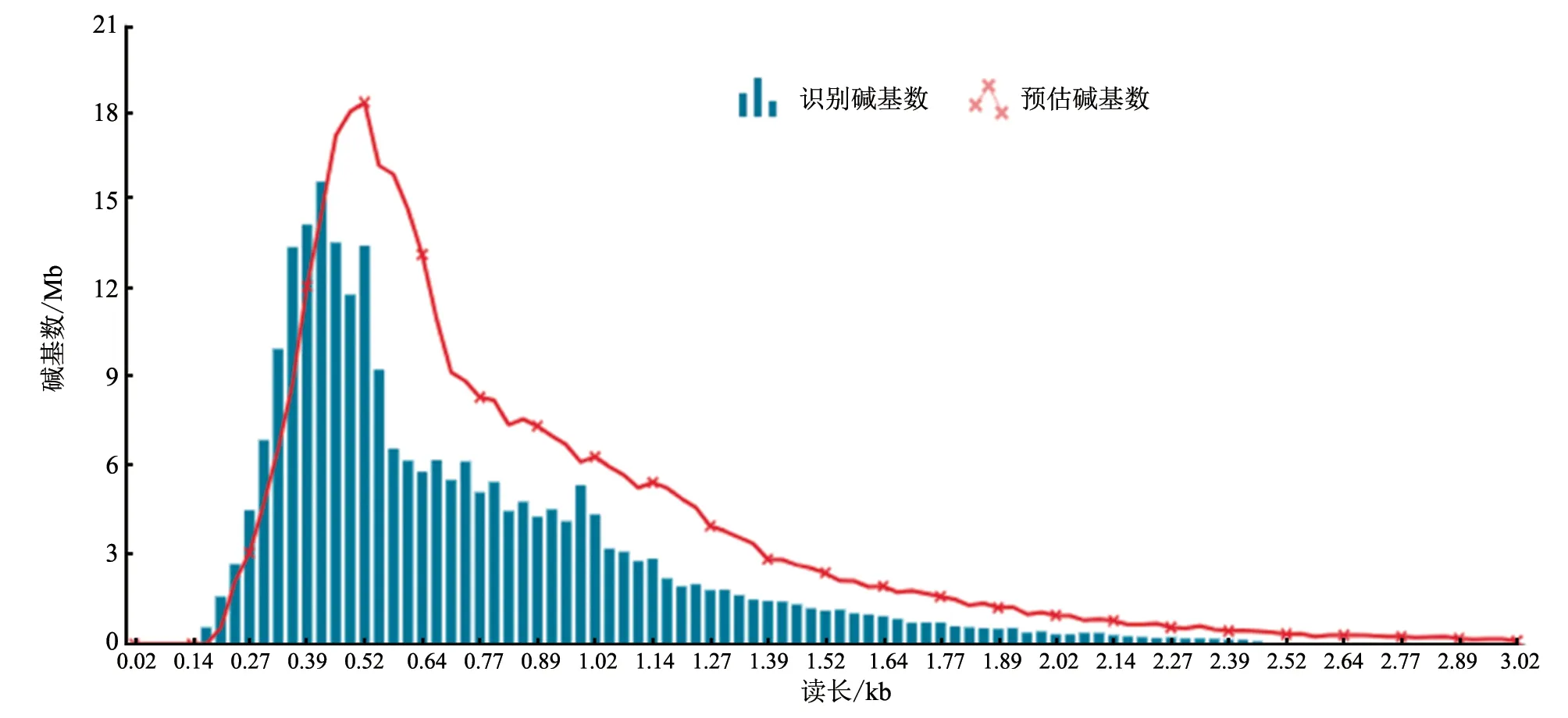
图3 碱基数与读长分布
2.3 样品中毒株分子特征分析
本研究采用纳米孔测序获得样品中AIV 的8个基因片段序列基本信息见表2(包括各基因长度、编码氨基酸序列长度及相似性最高毒株),其中PB1基因中有约480 bp 的序列未被测出,未能对其氨基酸序列长度进行推导;各基因片段序列Blast 分析均显示,样品中的病毒为鸭源H5N5 亚型AIV,与样品已知信息相符。HA 氨基酸裂解位点分析结果显示,序列为PLREKRRKR/GLF,具有5 个连续的碱性氨基酸,为高致病性AIV 分子特征[1],未发现向SAα2-6Gal 转变的氨基酸突变[8]。

表2 各个基因片段序列基本信息
2.4 进化分析
根据GISAID 网站Blast 比对结果以及该网站公布的H5 亚型病毒相关不同谱系毒株序列,经MAFFT 比对后,采用Geneious 内置UPGMA方法,分别针对HA和NA基因绘制进化树。结果显示,该病毒HA和NA基因分别与A/duck/Eastern China/031/2009(H5N5)和A/duck/Eastern China/008/2008(H5N5)亲缘关系最近,位于同一分支。HA谱系划分为2.3.4,NA为欧亚谱系。HA和NA基因进化分析结果分别见图4 和图5。

图4 样品中病毒(A/duck/BJHK/22)HA 基因进化分析结果

图5 样品中病毒(A/duck/BJHK/22)NA 基因进化分析结果
3 讨论
随着候鸟迁徙和人类活动,高致病性禽流感在全球范围内时有发生,给养殖业和人类健康带来严重挑战。高致病性禽流感不仅可对养禽业造成致命打击,而且一些毒株经过不断变异累积,遗传特征可发生演变,进而突破种间屏障传播给人和其他哺乳动物,甚至发生人际传播。因此联合国粮农组织(FAO)、世界动物卫生组织(WOAH)以及世界卫生组织(WHO)均将禽流感监测作为三方联盟的优先事项之一,呼吁世界各国加强监测[9]。
由于高致病性AIV 生物安全等级较高,常规的血清学以及基于核酸扩增的方法尽管可以对禽流感作出确诊,但由于AIV 的高变异特性,难以对其进行精确亚型鉴别以及致病性分子特征分析。尽管目前涌现了很多针对HA 或NA 亚型鉴别的荧光RT-PCR 方法,但由于AIV 同一亚型不同株型序列差异大,因此这些方法仅适用于一定时间和地域范围内的流行株检测[10-12]。此外,对于检测到的病毒阳性样品,及时开展分子溯源意义重大,不仅可以推测病毒来源,还可以对HA 氨基酸裂解位点序列以及HA 蛋白的受体结合特性进行评估,这对于疫情扩散风险研判与防控策略制定都具有重要指导意义。对病毒基因进行测序无疑是最直接有效的分子溯源方法,而常规非靶向测序方法往往需要较高的病毒浓度,需要进行病毒分离后再测序,生物安全风险较大。而基于靶向富集的纳米孔测序技术,不仅简单、快速,而且无需病毒培养,可显著降低生物安全防护水平。当然,尽管纳米孔测序技术有许多优势,但仍然存在设备价格高,测序完成需要配套数据库进行序列拼装,生物信息学分析能力要求高门槛等问题,因而限制了本技术的推广应用。
本研究以实验室保藏的1 份AIV 灭活拭子样品作为研究对象,结合靶向富集技术,对样品中的病毒全基因组核酸序列进行了测定和序列分析,发现10×序列覆盖度达到96.44%,仅PB1基因约480 bp 序列未被有效测出,推测可能是该区域靶向引物扩增效率不高所致,提示富集方法需进一步优化。测到的序列覆盖所有关键序列和位点信息,因此可有效对该病毒进行分子溯源。溯源信息显示,该毒株是源自我国南方的鸭源病毒,其HA基因为2.3.4 谱系。H5N1 亚型的2.3.4 谱系早在2005 年就在国内传播,而N5 为欧亚谱系,因此本次测定到的H5N5 亚型毒株谱系可溯源至2009 年我国东部检测到的基因重排毒株。氨基酸裂解位点分析显示,样品中的病毒具有高致病性AIV 分子特征,但仍保持SAα2-3 Gal 受体结合位点特征,未发现向SAα2-6 Gal 转变的氨基酸突变,提示该样品中的病毒不具备向人传播的能力[8]。另一方面,基于纳米孔测序的靶向富集技术一般采用 “叠瓦式” PCR方法进行靶核酸富集,由于富集体系中至少含有几十条引物,不同引物扩增效率存在差异,因此根据样品中病毒核酸质量浓度的不同,采用不同的循环扩增次数,对于含量相对较高的模板(Ct <30),往往采取低于30 次的循环次数,以避免部分扩增产物占比过高,影响测序结果的覆盖度。本研究测序样品中的病毒核酸质量浓度较高,Ct <30,因此富集循环次数设定在25,取得了较为满意的测序覆盖度。
4 结论
本研究对灭活拭子样品中的病毒核酸进行靶向富集后,采用纳米孔技术进行了全基因组序列测定,确定样品中病毒为H5N5 亚型高致病性AIV,其HA基因为2.3.4 谱系,NA基因为欧亚谱系,表明靶向纳米孔测序技术可直接用于拭子样品中流感病毒的全基因组测序,其快速、便捷,适用于动物流感病毒的快速分子鉴定与溯源。

