铬氧化物材料在锂电池中的应用与研究进展
张 遥,张泽峰,2,张 洋,乔学荣,康洪波
(1.中国电子科技集团公司第十八研究所,天津 300384;2.哈尔滨工程大学烟台研究院,山东烟台 265502;3.河北建筑工程学院信息工程学院,河北张家口 075000)
锂离子电池(LIB)与其它可充电电池相比具有更高的能量密度和循环寿命,使其在各个领域都有着广泛应用。目前已商用的正极材料如LiCoO2、LiFePO4、LiMn2O4、三元正极(NCM 或NCA)等,比能量已经由120 Wh/kg 提升到300 Wh/kg[1],已接近理论极限,因此研究人员将目光转向新材料的开发。近年来,铬氧化物因其高能量密度和低放电倍率下的高容量而备受关注。多电子反应的氧化铬,如Cr8O21、Cr(III)2[Cr(VI)O4]2Cr(VI)4O13,因其具有较高的理论比容量(642 mAh/g,1 210 Wh/kg)和较高的工作电压(3.0 V,vs.Li+/Li)而备受关注,其理论比容量是MnO2(308 mAh/g)、LiNi0.8Co0.1Mn0.1O2(280 mAh/g)的两倍多。其他高价铬氧化物如Cr2O5和CrO2也是最具有发展前景的正极材料,它们可以通过插层反应机制储存锂[2],因此具有超过200 mAh/g 的放电比容量。此外,铬氧化物不仅能作锂电池正极材料还能作为负极材料,Cr2O3既有较大的理论比容量又有较低的放电平台,而且其对锂具有较高的电化学活性,成本也较低,因此作为锂电池负极材料有较好的竞争力和前景。本文详细介绍了三种铬氧化物材料的制备方法和改性手段的研究进展。
1 锂电池Cr8O21正极材料研究进展
1.1 Cr8O21充放电机理研究
Cr3O8是所有铬氧化物正极材料中电化学性能最好的,Norby 等[3]应用中子衍射技术将Cr3O8的精确化学计量比标定位Cr8O21,其结构如图1 所示。[CrO6]八面体单元为Cr2O3单元层,[CrO4]四面体单元为CrO3单元层。(001)平面的距离为1.17 nm。这种结构具有很多适合锂离子存储的空间,而且铬元素可以实现从正六价到正三价的转变,实现多电子转移,因此Cr8O21有着非常高的理论储锂容量。
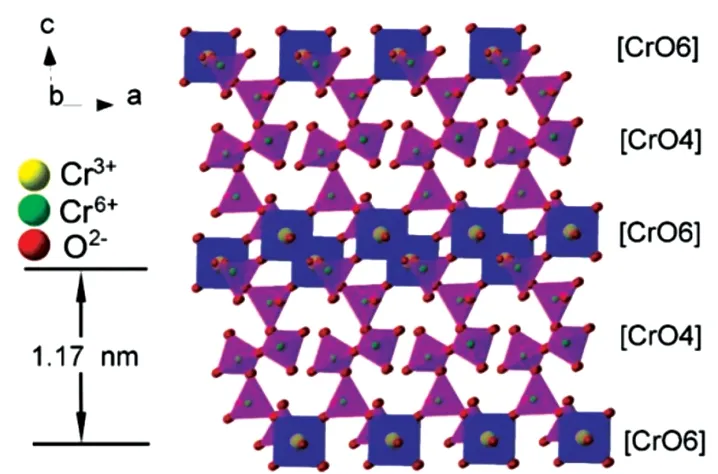
图1 Cr8O21晶体结构[4]
Feng 等[4]在氧气气氛下,将CrO3在260~280 ℃进行煅烧,保温48 h 以上,将冷却后的样品进行研磨、超声分散、过滤洗涤,再用干燥箱烘干,得到纯净的Cr8O21样品。在这种条件下制成的Cr8O21首次放电比容量为395 mAh/g,并且有265 mAh/g 的可逆比容量。但由于X 射线衍射光谱法(XRD)数据有限,并没有构建化学或电化学锂化Cr8O21的完整晶体结构,只能大致绘制嵌脱锂结构演变图,如图2 所示,推测出Cr8O21(Cr8O21=Cr2O3+6 CrO3)嵌脱锂的反应机理为:
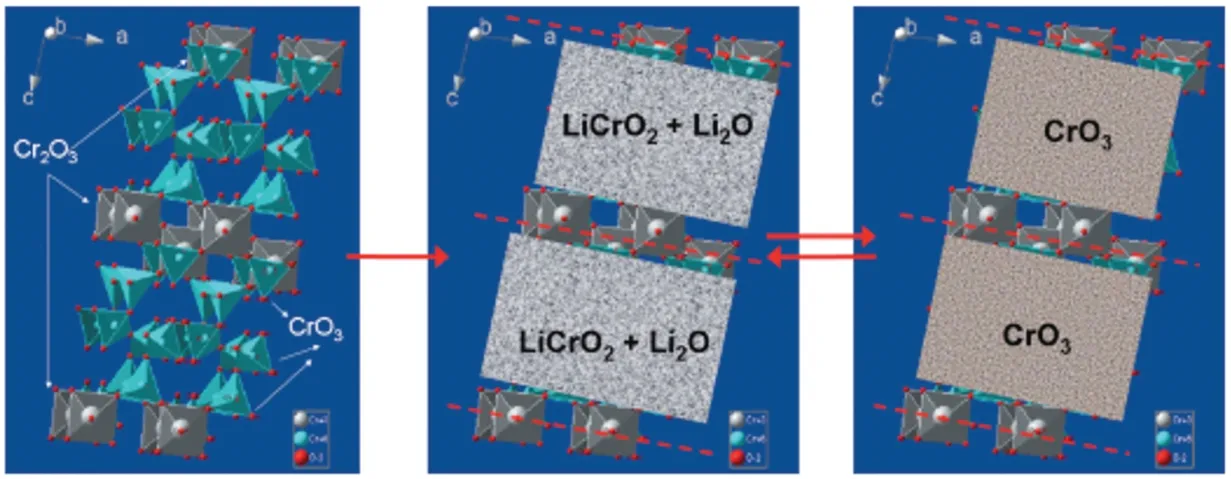
图2 Cr8O21与锂反应过程的机理示意图[4]
刘东旭[5]为进一步阐明氧化铬充放电的机理,又进行了深入研究。将三氧化铬晶体粉末在管式炉中不通任何气体进行煅烧,设置升温速率为5 ℃/min,升温到325 ℃,热解持续2 h 后,自然冷却到室温,产物命名为5-325。根据5-325 的Li-CrOx电池充放电过程中非原位XRD 图,判断出首次放电过程中[图3(a)]第一个电压放电曲线末端没有新相生成,表明发生的是一种单相的电化学反应,推测为锂离子主要嵌入到了六价铬[CrO4]四面体中,形成了LixCrO4,随着放电的进行,嵌入到六价铬[CrO4]四面体中的锂离子不断增多,六价铬[CrO4]四面体结构不稳定,同时又由于三价铬[CrO6]八面体层状在C 轴方向上的束缚,导致LixCrO4发生分解反应,产生LiCrO2和Li2O,反应式如下:
首次放电完成后,六价铬[CrO4]四面体结构被完全破坏,最终产物为LiCrO2和Li2O,而实际上Li2O 作为活性物质几乎不可逆,那么在随后的循环过程中,只有LiCrO2进行可逆的脱嵌锂。充放电反应方程式可以写成:
滕久康等[6]以CrO3为原料,在氧气气氛中,270 ℃下煅烧48 h 制备Cr8O21样品。将样品组装成扣式电池,在电流密度0.05 mA/cm2下放电到2.0 V。由于Cr8O21的第1 个平台结束和第2 个平台开始都在3.0 V 左右,因此,取3.0 和2.0 V 为放电测试点。将放电至3 V 时的样品与新鲜样品的XRD 图进行比对,如图4 所示,推测出Cr8O21首次放电机理为:从3.5 V放电至3.0 V 为锂离子嵌入Cr8O21内部的过程;从3.0 V 放电至结束为锂离子与Cr8O21反应生成LiCrO2和高度不可逆的Li2O 的过程。
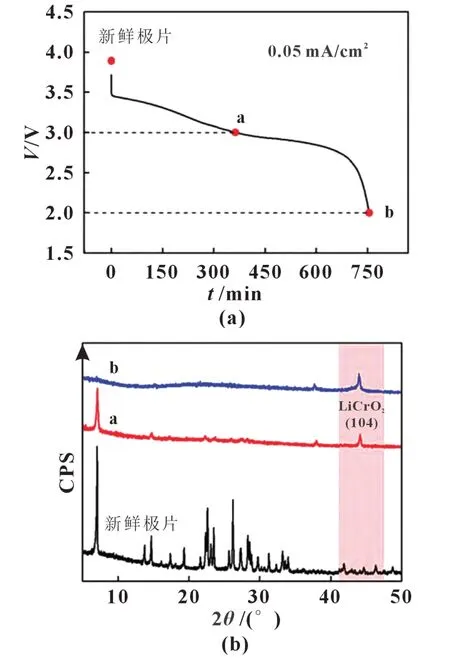
图4 Cr8O21样品放电曲线及测试取点图(a)与正极极片的取点XRD测试图(b)[6]
陈淼淼等[7]在空气气氛中通过两步热解法制得了纯相Cr8O21,并利用X 射线光电子光谱法(XPS)和XRD 图谱初步探索了Cr8O21的电化学反应机制。XPS 表征结果显示,Cr8O21的充放电反应是Cr6+/Cr3+之间的三电子氧化还原反应。通过XRD 分析可知,在首次放电曲线的第一个电压平台,Li+嵌入Cr8O21的[CrO4]亚晶格区,生成无定形产物LixCrO4,当放电至第二个电压平台时,生成了LiCrO2微晶。在后面的充放电循环过程中,LiCrO2进行可逆的电化学氧化和还原反应,可逆容量保持率仍较高,表现出良好的循环稳定性。
1.2 Cr8O21的制备及性能
Cr8O21的制备方法分为高温固相法和水热合成法[8],两种方法各有优势和缺点。高温固相法需要通入氧气并且需要较高的能量供应来维持高温反应条件,这导致材料制备过程中能源消耗较大,危险性较大;材料的颗粒感较强,导致其容量不能完全放出;温度控制要求高,一旦超过290 ℃,制备得到Cr8O21样品就会生成少许Cr2O5杂相。但高温固相法的操作简单,可在短时间内完成反应,通常只需要将适当比例的原料混合,并置于高温反应器中进行加热反应,不需要复杂的设备和技术条件,适合工业大规模生产。水热合成法的优势是所得产品物相均匀、纯度高、结晶良好、产率高,但缺点是所需的高温、高压反应设备较为复杂,需要耐高温、耐高压的材料和设备,因此其成本相对较高。
Popov 等[9]认为Arora 等合成的活性物质中含有未反应的CrO3,导致在循环过程中表现出更多的容量衰减。因此,其团队研究制备了一种具有更好可逆性和更低容量衰减的材料。按照三氧化铬与硫酸铵的质量比为95∶5 在270~290 ℃反应釜中加热24、48、72 和96 h。并在多种不同的铬氧化物中,鉴定出热分解时间48 h 的Cr8O21正极材料性能最好。实验结果也证明,热解时间对材料的性能有非常大的影响,其中热解48 h后得到的产物在0.5 mA/cm2电流密度下的首次放电比容量高达322 mAh/g,而其他温度的样品首次放电比容量要比其低20~50 mAh/g;在循环100次时仅损失19 mAh/g,容量保持率为94.8%,展现出了良好的循环性能。并通过非原位XRD 研究了材料首次不可逆容量损失的原因,证明了不可逆容量损失是由于材料中未分解的CrO3和低价态的杂质在前两次被还原后变得不可逆,并且在随后的循环过程中被逐渐分解或者转变为了非晶相。
吕星迪[10]将干燥后的CrO3放入管式炉中,在通氧气下升温至270 ℃保温48 h,得到的产物经过研磨、过滤除去未分解的CrO3,再经干燥得到Cr3O8。通过研究发现:当煅烧温度低于270 ℃或保温时间小于48 h 时,Cr3O8的结晶度会降低,同时产物中还会存有大量未分解的CrO3;随着管式炉内温度不断升高,Cr2O5、CrO2等其它铬氧化物会产生。恒流充放电结果表明:Cr3O8正极材料首次充电比容量达到340 mAh/g,15 次循环以后可逆比容量仍保持300 mAh/g 以上,循环效率保持在95%以上。同时还发现材料容量衰减非常快,这是因为样品中残留的CrO3氧化能力太强,直接与电解液发生作用,而且CrO3本身也不具备可逆嵌锂的结构。
吕星迪虽证明分解温度和时间会影响Cr3O8的纯度,从而影响电化学性能,但可惜的是没有确定CrO3热分解温度和Cr2O 等其它杂相生成温度。这为后续实验提供了研究方向。
滕久康等[11]以CrO3为原料,采用高温固相法制备正极材料Cr8O21,系统研究了热处理时间对Cr8O21结构、电化学性能的影响。将原料在270 ℃下通氧气气氛保护,分别热处理2、6、12、24、48 h,通过XRD分析得出,热处理时间由2 h 增加至48 h,CrO3转换成Cr8O21比例不断增加;延长至48 h,样品的XRD 图与标准Cr8O21的XRD图基本吻合,材料此时的纯度与结晶度最好,基本为纯Cr8O21。将制备样品作为正极材料,制备成CR2025 扣式电池,在0.05 mA/cm2下恒流放电时,放电比容量达到383.26 mAh/g;以0.1 mA/cm2恒流放 电,比 容量为346.17 mAh/g;以0.5 mA/cm2进行恒流放电,放电比容量也有280.32 mAh/g。从0.05 mA/cm2增至0.5 mA/cm2,材料容量保持率为73.14%,表明热处理48 h 的Cr8O21具有高容量、倍率性能优异的特点。
随后,滕久康等[6]又探究热解温度对Cr8O21性能的影响。以CrO3为原料,在氧气气氛中,分别在250、270、290 和310 ℃下煅烧48 h,通氧气冷却至室温后,将产品研磨均匀过孔直径75 μm 筛,获得四种不同温度条件下制备的Cr8O21样品。热重分析表明了固态CrO3变为液态的融化温度为200 ℃左右,热分解点为260 ℃左右。通过XRD 分析得到270 ℃下制备的Cr8O21样品纯度最高,而后继续升温会使Cr8O21转变成Cr2O5,Cr8O21纯度不断降低。能量散射光谱(EDS)分析结果也表明样品270 ℃的Cr/O 原子比最接近标准Cr8O21的Cr/O 比。
陈淼淼等[7]在空气气氛中通过两步热解法制得了纯相Cr8O21。第一步,先在260 ℃进行热分解反应,保温12 h;第二步,在270 ℃热解12 h 制备样品。并使用金属锂片作负极,制备得到的样品为正极材料,制备成CR2016 扣式电池。研究结果表明,所制备的Cr8O21在0.1C下的初始放电比容量高达400.4 mAh/g,平均放电电压约为3.04 V,表明所合成的纯相Cr8O21材料具有良好的电化学性能。材料首次放电时,2.0C的放电比容量为0.1C的84.6%;第二次放电时,2.0C的放电比容量为0.1C的80.3%。这些结果显示所制备的材料具有优良的倍率性能。此外,在充、放电倍率皆为0.1C时,第二次放电的比容量为304.4 mAh/g,在100 次循环后的可逆比容量为269.9 mAh/g,除去首次放电,从第二次循环开始计算,材料容量保持率达88.7%,表现出良好的循环稳定性。
孟庆飞等[12]采用一步煅烧法由CrO3制备Cr8O21,并在氧气氛围下,探究了煅烧温度和煅烧时间对电化学性能的影响。煅烧温度分为250、270、290、300和360 ℃,煅烧时间分为6、12、18、24、30、48 h。煅烧12 h 时,通过XRD 分析得出在250 ℃时存在大量CrO3,270 ℃时CrO3消失,出现Cr8O21;随着煅烧温度持续增加至290 与300 ℃,Cr2O5不断生成;而在360 ℃时产物中已含有大量影响电池放电性能的Cr2O5。在270 ℃条件下,通过优化煅烧时间至24 h,其对应的XRD 结果如图5 所示,整个图谱与标准Cr8O21一致,且没有出现其他杂峰,表明延长煅烧时间至24 h 可以有效提纯Cr8O21。
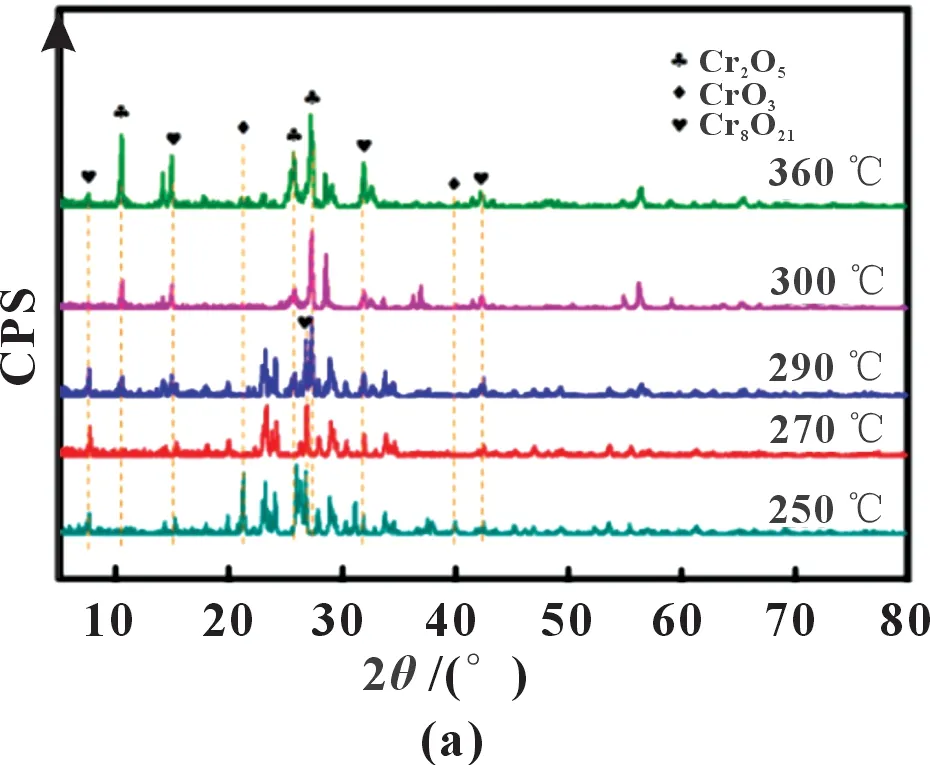
图5 不同煅烧温度下煅烧12 h(a)以及在270 ℃下煅烧12和24 h(b)所得产物的XRD图谱[12]
将样品制备成CR2032 扣式电池,在30 mA/g 条件下进行放电,结果表明放电性能随着煅烧温度的提升而下降,温度270 ℃条件下的样品具有最好的放电性能,其首次放电比容量为357 mAh/g,平均放电电压3 V。在探究煅烧时间对电化学性能影响时发现样品的首次放电比容量整体上呈先增加后减少的趋势,如图6 所示,当煅烧时间为24 h 时得到的样品性能最佳。研究还表明电流密度在3 000 mA/g 条件下放电时对应的比容量为180 mA/g,容量依然能保留50%以上,可见其具备良好的倍率性能。在30 mA/g 电流密度下,对电池进行20 次循环后,放电比容量能保持在80%以上;-45 和65 ℃下,其放电比容量分别为200 和364 mAh/g,表明其具备良好的循环稳定性和电化学性能。
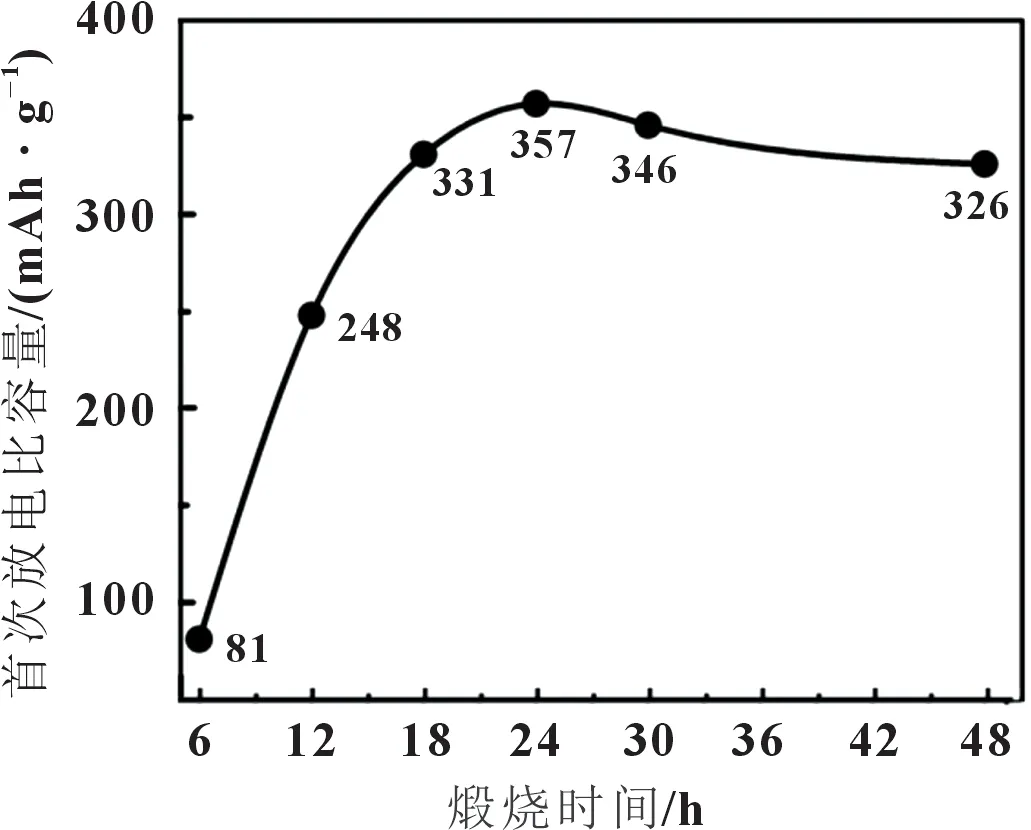
图6 不同煅烧时间与放电比容量曲线图
Liu 等[13]采用无水三氧化铬(CrO3)在270 ℃的流动氧气中热分解48 h 以上,然后冷却至室温,制得产品中含有未分解的CrO3,可以用蒸馏水进一步去除,得到纯净的Cr8O21。充放电测试表明,所制备的正极材料在0.16 mA/cm2下恒流放电,首次放电比容量为390 mAh/g,循环3 次时可逆充电比容量为265 mAh/g,有较好的循环性能。XRD 表征表明,当锂离子嵌入后,Cr8O21内部的四铬酸盐基团被破坏,转变为另一种层状结构材料,出现了一种新的相,新相保留了Cr8O21材料的结构,层间变成Li-Cr-O 无序体系。彭庆文等[14]认为结构上部分不可逆改变是造成Cr8O21首次充放电效率较低的原因。循环伏安(CV)结果表明,在少数放电过程中,新相完全形成。不可逆相变是前几个循环中不可逆容量损失的主要原因,而颗粒脱落是后续循环中容量衰减的主要原因。
Liu 等[15]采用CrO3为起始原料,分别在325、350和375 ℃煅烧2 h,制备了铬氧化物Cr8O21和Cr2O5,并将其作为可充电锂电池正极材料。将325 ℃、5 ℃/min 加热速率下的CrOx样品作为正极材料,制成CR2025 扣式电池,在电流密度为10 mA/g 时,具有365 mAh/g 的高比容量和1 108 Wh/kg 的比能量。即使在100 mA/g 的高电流密度下,该材料也显示出298 mAh/g 的初始放电比容量和50 次循环后56.4%的相对较高的容量保持率,表现出良好的电化学性能。CrOx在100 mA/g 下表现出较高的放电容量和良好的循环性能,这主要与CrO3在该条件下热分解得到的Cr8O21和Cr2O5复合结构的协同相互作用有关。此外,利用X 射线衍射和XPS 分析了循环过程中氧化铬的结构演变和价态,验证了氧化铬正极材料锂化过程中释放产物LiCrO2的可逆性。
通过对各项工作分析可知:三氧化铬在受热分解过程中存在两个稳定的中间态,分别是260 ℃开始生成的Cr8O21和290 ℃生成的Cr2O5。在270 ℃时,Cr8O21的纯度最高,温度超过375 ℃时热解制备的氧化铬为单相的Cr2O5。氧化铬材料首次放电的比容量会随着煅烧时间延长呈现先增加后减少的趋势。这是因为煅烧时间过短会导致CrO3不能完全分解,CrO3的氧化性强,容易与电解液反应且会腐蚀集流体,对电池造成破坏性的影响,造成不可逆容量损失[16]。煅烧时间过长时,材料的结构和结晶度也不会出现大的偏差,不仅浪费能源还增加了危险性,综合各文献可确定煅烧24 h 为最优。除此之外,首次放电比容量还与热解温度有关,会随着温度的提升而下降。热解温度270 ℃时放电性能最好,这是因为随着温度进一步提高,会生成低价态铬氧化物如Cr2O3和Cr2O5等,这些物质与Cr8O21相比具有较差的锂离子嵌脱能力,因此材料的比容量显著降低。材料循环性能也会受到热解温度的影响,由于氧化铬材料首次放电后会有较大的不可逆容量损失,所以循环性能基于第二次来分析。
1.3 Cr8O21的改性及应用
Cr8O21应用最多的改性方法有两种。第一种是形成复合材料,将Cr8O21与其他功能材料进行复合,可以充分利用各材料的特性,形成具有协同效应的复合材料,例如,与金属、碳材料等复合,提高电化学性能等。第二种是表面修饰,通过在Cr8O21表面引入活性基团或修饰层,可以增加循环稳定性。
Yang 等[17]采用行星球磨的方法将Cr8O21包覆在LiNi0.5Co0.2Mn0.3O2正极材料表面。测试结果表明,当复合正极材料中Cr8O21的包覆量从0 增加到7.5%(质量分数)时,LiNi0.5Co0.2Mn0.3O2的放电比容量从155 mAh/g 增加到175.5 mAh/g,不可逆比容量损失从23.9 mAh/g 降低到2.4 mAh/g。这主要是因为Cr8O21的加入起到了锂嵌入氧化物的作用,使得在初始循环过程中Li+无法嵌入到LiNi0.5Co0.2Mn0.3O2中。此外,电化学测试结果表明,包覆Cr8O21后的NCM523材料的循环性能和倍率性能都得到了提升,并通过电化学阻抗结果分析出了包覆层通过抑制电解液/电极寄生反应,抑制了循环时阻抗的增加,从而提高了电池的容量保持率和速率性能。
顾婷婷[18]使用Cr8O21对尖晶石LiNi0.5Mn1.5O4(LNMO)材料进行表面包覆,从而改善LNMO 的电化学性能,包覆量为1%、3%、5%、7%(质量分数)4 个梯度。电化学测试结果表明,包覆量5%(质量分数)的材料具有较高的放电容量和倍率性能,在0.1C和5C下的放电比容量分别为126.6、107 mAh/g,而纯LNMO 的放电比容量分别为120.3、75 mAh/g,不论大倍率还是小倍率,包覆量5%的材料的放电比容量皆超过纯LNMO,也高于其他几种样品;1C下循环100 次后容量保持率为93%,循环160 次后的容量保持率依然在85%以上,证明具有良好的循环性能。同时,Cr8O21有效地阻止了LNMO 与电解液的直接接触反应,减小了界面阻抗,从而使电化学性能有所提升。
邓朝文等[19]为了提高锂铬氧化物电池的电性能,将高比容量的氟化碳材料掺杂到铬氧化物材料中制备成复合极片,并使用金属锂片作负极,制备得到的样品为正极,组装成CR2430 扣式电池。证明通过辊压使得电极材料更加密实,如图7 所示,细小颗粒填充到大的缝隙,材料压实密度得以提高,可以减少电解液的吸收量,提高电池能量密度。通过放电曲线可以得出两种物质分别在各自的电压平台下工作。随着氟化物含量的增加,放电比容量和放电比能量也在逐步提高,证明氟化物与氧化物共混可以提高电池的放电性能。

图7 样品的SEM图[19]
Zhang 等[20]为了提高电池的循环性能,在Cr8O21上涂覆Al2O3原子层沉积(ALD)涂层,以修饰电极与电解质之间的界面。先以CrO3薄片为起始原料,在280 ℃的氧气流(20 mL/min)下煅烧7 h,冷却至室温后,所得产品用玛瑙砂浆研磨,通过300 目筛网筛分,得到Cr8O21粉末。再将聚氧化乙烯(PEO)(LiTFSI)/四氢呋喃(THF)溶液(PEO 与LiTFSI 摩尔比为8∶1)浇铸在Cr8O21电极上,然后在70 ℃下干燥12 h,得到PEO基固体聚合物电解质膜的Cr8O21电极。结果表明,经过12 次ALD 循环后的电极表面上的Al2O3层厚度约为4 nm,此时的样品表现出最佳的循环性能,在0.1C条件下进行第125 次循环,放电比能量为630 Wh/kg,放电比容量为260 mAh/g;当涂层循环次数低于12 次时,放电比容量在10 次循环后迅速下降到200 mAh/g左右;超过12 次时,较厚的Al2O3层会抑制锂离子的扩散,从而使循环性能恶化。
喻肖[21]为了改善CuF2的电化学性能,合成了Cr8O21/CuF2复合正极材料。先将铬基氧化物CrO3与草酸镍(NiC2O4·2 H2O)研磨均匀后置于马弗炉中,以1 ℃/min 的升温速率升至290 ℃,保温30 h 后,自然冷却至室温,得到产物Cr8O21。再通过球磨工艺在180 r/min 的条件下球磨30 min,将Cr8O21对CuF2进行复合,包覆量为2.5%、5%、7.5%(质量分数),得到Cr8O21/CuF2复合材料。在球磨后样品的XRD 光谱中,只观察到Cr8O21与CuF2的特征衍射峰,表明Cr8O21的添加并没有改变CuF2相结构。从复合材料在0.1C下的首次放电曲线可以看出,如图8 所示,随着Cr8O21的质量不断增加,放电比容量也在不断增大。这说明通过与Cr8O21复合,可以有效改善CuF2导电性能,从而提高了放电比容量。电化学结果表明,包覆7.5%(质量分数)的材料具有较好的倍率性能和较高的放电电压平台,1C下的放电比容量仍有0.1C时的91.9%,而此时纯的CuF2样品放电比容量仅有0.1C下的83.7%,表明Cr8O21的复合对于改善正极材料高倍率下的能量密度具有良好的效果。Cr8O21也对CuF2的循环性能有一定提升,Cr8O21复合量由0 升至7.5%(质量分数)时,在第三次循环后,放电比容量分别为56、65、75.1 与96.7 mAh/g,容量保持率随Cr8O21的复合量增加有一定提高。
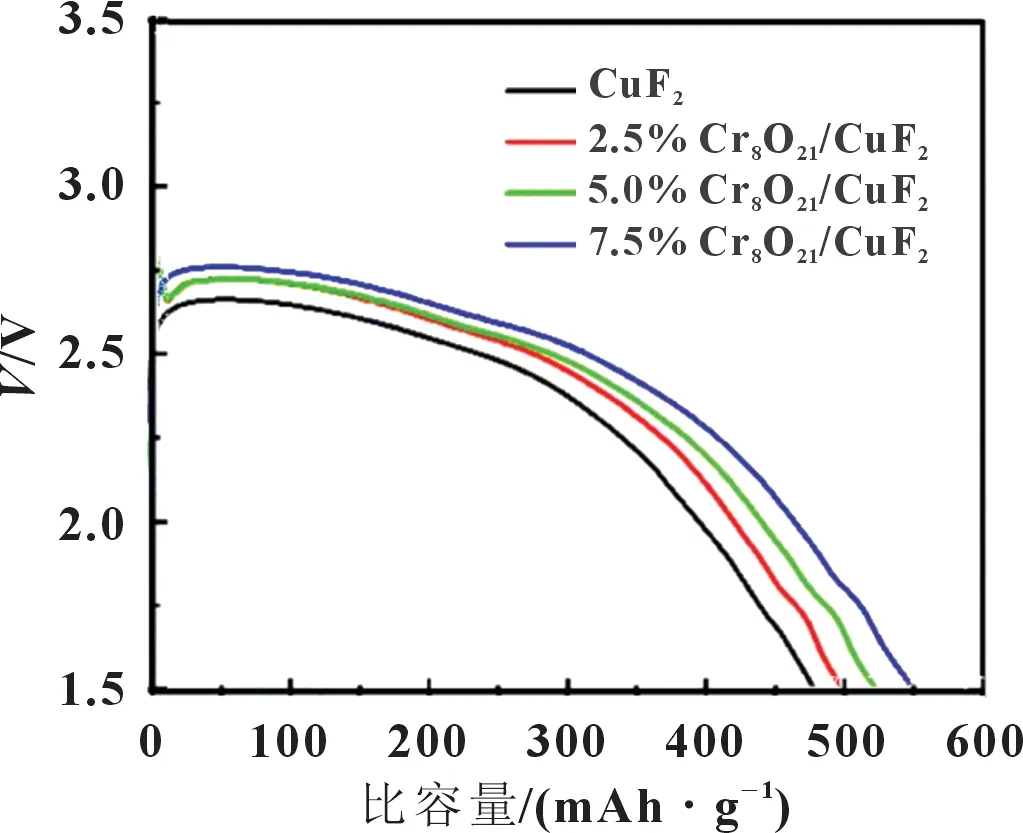
图8 复合不同量Cr8O21的CuF2复合材料的首次放电曲线[21]
在Cr8O21表面涂覆均匀致密的Al2O3层不仅可以防止聚乙烯氧化物的氧化作用,还可以促进锂离子的输运,进而提高循环性能,但是Al2O3层也不能过厚,较厚的Al2O3层会抑制锂离子的扩散,从而使循环性能恶化。Cr8O21也可包覆在某些正极材料表面,形成复合材料,Cr8O21的加入起隔离电解液的作用,减小界面阻抗,从而提高电池的循环性能和倍率性能,但是Cr8O21的包覆量也不能过高,过高的包覆量会导致第一次放电容量与第二次放电容量之间的衰减变大。
2 锂电池Cr2O5正极材料研究进展
Cr2O5是一种高能量正极材料(250 mAh/g,819 Wh/kg)[22],工作电压高于3 V,能量转化效率远高于CoO(54.6%)、RuO2(54.9%)。Cr2O5的制备相比较于Cr8O21,其热处理温度要求更高,耗能更多,但无需通入氧气保护,且其价格低,具有良好的循环性能和高能量密度而得到关注。Hewston 等运用红外光谱、XRD、电子顺磁共振谱确定了Cr2O5中铬元素的价态分布为:Cr23+Cr46+-O15。其电化学反应时也拥有“三电子”转移特性。
2.1 Cr2O5的制备及性能
Suzuki 等[23]将Cr2O3粉末填充在致密的MgO 或石英坩埚中。臭氧发生器在纯氧气气氛中放电,产生含有约5%(体积分数)臭氧的气体混合物。同时,将2%(体积分数)Ar 与原始氧气混合以增加臭氧浓度。将混合气体通过Al2O3管吹向坩埚中的Cr2O3粉末,Al2O3管用水冷却。抽气后,引入O2+Ar 气体并加热,温度稳定后,产生臭氧。经过一段时间反应后,停止臭氧的产生,样品在炉中冷却。研究发现当温度在480 K 以下时,除了少量未反应的Cr2O3外,还发现CrO3。在500 K 以上时,才 有Cr8O21和Cr2O5等氧化物形成。在此阶段,Cr8O21、Cr2O5等主要是由CrO3分解而成。通过相关文献报道,CrO3在没有通氧气条件时的熔点为470 K,CrO3在空气或氩气气氛中的分解顺序为CrO3→Cr8O21→Cr2O5→CrO2,并在720 K以下最终分解为Cr2O3。可惜的是Suzuki 等没有明确的证据表明观察到的Cr8O21和Cr2O5是由Cr2O3和O3直接反应形成的。想要制备纯Cr2O5可能需要精确控制温度、氧气压力和时间[24]。
Feng 等[25]以CrO3粉末为原料,在空气气氛下分别在350、375 和400 ℃下煅烧2 h,再在玛瑙研钵中研磨成Cr2O5细粉。将制得的样品作为正极材料制备成扣式电池。通过首次充放电曲线分析出,首次放电过程分为两个部分进行,第一个过程与固相溶解有关,第二个过程与两相反应有关。非原位XRD 和CV 曲线证明锂嵌入Cr2O5的过程是高度可逆的,锂对Cr2O5的第一次电化学还原过程形成了具有不同晶体结构的可逆u-LixCr2O5。电化学结果表明,首次放电容量随煅烧温度的升高而减小,以0.5C进行放电时,在350 ℃下煅烧的三氧化铬样品的比容量最高,约为273 mAh/g,400 ℃下煅烧的样品比容量较低,约为220 mAh/g。但不同温度下的Cr2O5样品都具有良好的循环性能,特别是400 ℃下煅烧的样品,在100 次循环后的容量保持率为96%,具有最佳的循环性能。375 ℃时样品的比能量可达819 Wh/kg,能量转换效率约为83%,这高于LiCoO2材料的550 Wh/kg[24]。但充放电电位相差较大,约为0.5 V,说明样品的倍率性能不是很好,有待进一步提高。
2.2 Cr2O5改性及应用
Wang 等[26]通过简单的机械研磨法将Cr2O5与LiNi0.8Co0.15Al0.05O2(NCA)复合,合成了NCA@Cr2O5复合电极。先将CrO3置于箱式炉中,在350 ℃下煅烧2 h,得到Cr2O5粉末,再在研钵中研磨成Cr2O5细粉,最后再用研钵将NCA 和Cr2O5研磨30 min,按照Cr2O5的 含 量 分 为15%、30%、45%(质 量 分 数)NCA@Cr2O5复合材料。以NCA@Cr2O5样品为正极材料,组装CR2025 扣式电池。通过比较不同Cr2O5含量的NCA@Cr2O5复合材料在0.1C和2.0~4.3 V 电压范围的首次充放电曲线,发现随着Cr2O5含量的增加,充电容量减小,放电容量增大。实验结果也表明,Cr2O5的加入抑制了电位的快速衰减,所有复合样品在低电压下的循环稳定性能都有所提高。30%(质量分数)Cr2O5样品具有最佳的循环和倍率性能,而包覆量15%(质量分数)的首次充放电效率最高,从无Cr2O5时的87.5%提高到94.2%。包覆量45%(质量分数)时,容量保持率从无Cr2O5时的58.5%提高到2.0~4.3 V 范围内的69.3%。NCA@Cr2O5复合电极结合了NCA 的高倍率容量特性和Cr2O5的稳定性,在提高循环稳定性、初始放电容量和低截止电压(2.0 V)安全性方面发挥了协同作用,与NCA 正极材料相比,NCA@Cr2O5复合材料不仅可以为Li+的嵌入/迁出提供额外的稳定位点和通道,弥补活性Li+位点的损失,防止循环过程中Li+的积累,而且可以保护NCA 电极免受黏附在NCA 界面上的Cr2O5纳米颗粒对电解质分解的腐蚀。
臧永[27]将CrO3置于箱式电炉中,在空气气氛下350 ℃烧结2 h 后随炉冷却。随后将得到的产物研磨成Cr2O5超细粉末,得到缺锂态正极材料。再将Li1.2Ni0.2Mn0.6O2与不同质量的Cr2O5粉体混合,在研钵中研磨均匀,按照Cr2O5的含量分为Li1.2Ni0.2Mn0.6O2/xCr2O5(x=0.17,0.34,0.51,质量比)复合材料。以Li1.2Ni0.2Mn0.6O2/Cr2O5复合材料为正极组装成CR2032扣式电池。通过对首次充电曲线分析得出,随着Cr2O5相含量比例的提高,首次充电比容量逐渐降低。在0.05C充放电时,富锂相材料循环比容量随Cr2O5含量的提高而略有降低,但可以通过改善Cr2O5材料表面形貌,提高Li1.2Ni0.2Mn0.6O2/Cr2O5复合材料的循环性能。最后又提出了富锂相材料与缺锂态正极材料Cr2O5的简单复合可以做到人为控制富锂相材料的首次库仑效率。
Ding 等[28]将缺锂的Cr2O5阴极与富锂的Li1.2Ni0.13Co0.13Mn0.54O2(LNCM)阴极物理混合,形成复合阴极LNCM@xCr2O5(x=0,0.1,0.2,0.3,0.35,0.4,质量比),以利用富锂组分在第一次充放电过程中产生过多的锂。经过电化学测试,采用LNCM@Cr2O5(x=0.35)和Li4Ti5O12(LTO)作为正极和负极,组装成一个完整的电池,在0.025 A/g(0.5~2.96 V)时的充放电比容量分别为203.5 和198.8 mAh/g,充放电效率为97.7%,第2 次和第3 次循环的放电比容量分别为249和252 mAh/g,远高于第一次循环的放电容量,这是因为在第一次循环后L-rich@0.35 Cr2O5阴极未完全激活。在50 次循环后,比容量仍保持在234 mAh/g,具有94%的容量保持率,拥有良好的循环稳定性。
冯绪勇[29]以CrO3为原料直接加入到氧化铝坩埚中,在375 ℃下热解得到Cr2O5样品。将制得的样品为正极,制成CR2032 扣式电池,热解温度越高,Cr2O5容量越低,这是因为高温下样品会产生一定的氧空位,容量随着氧空位的增多而降低。充放电区间由1~4.5 V 减小到2~4.5 V 时,400 ℃的样品在100次循环后可以保持220 mAh/g 的比容量。虽然Cr2O5在1/3C小电流下的比容量较高,大约为250 mAh/g,但是在大倍率下会很快衰减,8C时只剩下一半容量,10C时容量基本没有了,说明Cr2O5的导电性能不佳,有待进一步改善。将Cr2O5分别采用丁基锂和LiI 进行锂化,实验结果表明,使用LiI 作为锂原,可以在短时间合成结晶度较好的样品,在0.2C下首次放电比容量也有190 mAh/g,但在前几次循环时容量衰减较快,在0.4C下后续循环会逐渐趋于稳定,100次循环后比容量仍有125 mAh/g,具有较好的充放电性能,能够作为正极材料。
相比较于Cr8O21,Cr2O5的制备需要加热到更高的温度,耗能较多,而且Cr2O5的比容量和比能量相对于Cr8O21要低。这是因为Cr2O5在离子嵌入/脱嵌过程中容易发生结构破坏,从而导致较差的倍率性能和容量衰减。但是,Cr2O5可以与其他富锂的正极极材料复合形成复合电极材料,或者对其进行锂化处理,都可以提升电化学性能。Cr2O5也可以与碳、硅、氧化物等材料结合形成复合正极材料,以提高电化学性能。
3 锂电池Cr2O3负极材料研究进展
铬氧化物中能够用作锂电池负极材料的主要是Cr2O3,目前的研究工作也集中在改善Cr2O3性能上,如提高材料的导电性、控制体积膨胀以及稳定固体电解质界面膜(SEI)是近来研究的主要方向。由于Cr2O3拥有较高的理论比容量(1 058 mAh/g)和较低的标准电势(1.085 V),与其他过渡金属氧化物相比有着明显的优势,主要反应机理与其他过渡金属氧化物相同:Cr2O3+6 Li↔2 Cr+3 Li2O。但原始Cr2O3的循环性能很差,需要使用一些方法对其进行改进,提高电化学性能。
3.1 Cr2O3的制备及性能
赵思维等[30]通过水热法制备三种前驱体材料(MIL-53-Cr、MIL-101-Cr 和MIL-102-Cr),再将前驱体材料在空气氛围下400 ℃煅烧4 h,得到三种不同形貌的Cr2O3样品。电化学测试显示,在1C时,Cr2O3(MIL-101-Cr)首次放电比容量最高,为642.8 mAh/g,但衰减很快,第二次放电比容量不足300 mAh/g,而由MIL-102-Cr 制得的Cr2O3首次放电比容量为574.7 mAh/g,虽略低于前者,但其循环性能较好,经过100次循环后,其比容量稳定在200 mAh/g 左右,比Cr2O3(MIL-101-Cr)经过100 次循环后的容量高出一倍,并且在0.1C下,首次放电比容量可以达到840 mAh/g,与Cr2O3的理论比容量接近。
王鹏家等[31]以六羰基铬[Cr(CO)6]为原料超声溶解进甲醇中,制备成前驱液。再以N2作为载气(流量为1 L/min),通过雾化瓶将前驱液通入到340 ℃的氧化铝基底上,待前驱液消耗完后,持续以0.3 L/min 流量通入N2。等氧化铝基底冷却至室温后,在其表面获得一层暗绿色的Cr2O3薄膜,随后将氧化铝基底置于箱式炉中在600 ℃条件下热处理24 h。由此方法制成的Cr2O3薄膜是由很多颗粒粒径在50 nm 左右不规则的椭球形颗粒组成,厚度约为20µm。
桂阳海等[32]采用一种微波气-液界面法制备Cr2O3纳米材料。以九水硝酸铬、乙二醇为原料,将配置好的混合溶液置于微波反应釜中,在180 ℃条件下微波反应1 h。再将制备的材料进行洗涤、离心、干燥,得到Cr(OH)3蓝绿色粉末。随后将所得前驱体在600 ℃高温煅烧3 h,得到Cr2O3材料。如图9所示,扫描电子显微镜法图表明微波气-液界面法制备的Cr2O3纳米颗粒均一,平均粒径为108.5 nm。

图9 微波气-液界面法制备Cr2O3的SEM图[31]
3.2 Cr2O3改性
为了改善Cr2O3性能,并满足特定应用需求,可以通过掺杂其他金属或非金属元素,这样可以改变其电子结构、晶体结构和表面性质,从而调控其催化活性和化学特性,通过碳包覆方法也可以改善锂离子电池正极材料导电性及表面特性。另外,构建纳米结构也可以提高材料的容量保持率。
Bai 等[33]使用九水合硝酸铬,先通过水热法,最后在270、350、430、500 ℃空气氛围下加热3 h 制备Cr2O3材料。通过透射电子显微镜法(TEM)与XRD分析,认为在430 和500 ℃煅烧后的样品尺寸均匀,结构致密,结晶度高,得到了粒径为纳米级的Cr2O3颗粒。对430 ℃下煅烧生成的Cr2O3材料测试分析得出,该材料在100 mA/g 的电流密度下循环100 次后,比容量稳定在185 mAh/g,其循环性能得到有效改善。但不足的是在倍率测试中达到2 000 mA/g 电流密度时,由于纳米颗粒团聚严重,体积过度膨胀,致使电极粉化,比容量几乎降至零。可见纳米化的过渡金属氧化物负极材料仅能为一些小电流电器设备稳定供电,所以仅仅改变材料颗粒大小与形貌无法综合提高其电化学性能。
Hu等[34]将丙烯酰胺和K2Cr2O7与蒸馏水混合搅拌成均匀溶液,在100 ℃加热12 h,离心分离后又在100 ℃下干燥12 h 得到蓝色粉末,再在600 ℃马弗炉空气中加热12 h,得到具有纳米结构的材料,命名为Cr-1。又以氯化铬(III)作为Cr 前驱体溶于去离子水中,加入氨水沉淀,然后采用与前者相同的水热和煅烧工艺,得到平均粒径50 nm 的Cr2O3纳米材料,命名为Cr-2。这两种材料与原始Cr2O3材料初始放电容量几乎相同,但是Cr-1 的初始充电比容量从771 mA h/g提高到868 mAh/g,充电效率从66%提升至73%,而Cr-2 的初始效率仅为52.3%,此外,Cr-1 的容量保持率优于原始Cr2O3和Cr-2,这表明纳米结构代替纳米颗粒是更好的选择。
Hu 等[34]又将Cr2O3和糖球磨后在氩气气氛下热解得到碳包覆的Cr2O3/C 样品,命名为Cr-C1;Cr2O3、乙炔黑和糖球磨后热解得到碳包覆的Cr2O3/C 样品,命名为Cr-C2;通过在Cr2O3颗粒上生成碳纳米管,合成Cr-C3。电化学性能测试表明Cr-C3 的首次放电比容量为1 600 mAh/g,首次充电比容量为850 mAh/g,首次效率只有53%。首次放电容量超过其理论容量的主要原因是碳纳米管也进行了储锂。Cr-C2 样品的循环性能是最好的,这可以通过TEM 图像进行解释,Cr-C2 样品形成了比较完整的核-壳结构,无序碳层将炭黑颗粒与Cr2O3颗粒融合在一起,形成连续的Cr2O3涂层,增加了导电性,而且SEI 膜在硬碳表面相对稳定,因此循环性能得到很大改善。
Guo 等[35]使用九水合硝酸铬作为前驱体,先通过溶胶凝胶法,最后在750 ℃氩气下烧结制备出介孔碳-三氧化二铬(M-C-Cr2O3)复合材料。在50 mA/g 的电流密度下,Cr2O3电池容量随循环衰减迅速,而M-CCr2O3电池不仅具有较高的可逆容量,而且具有良好的循环稳定性。经过80 次循环后,M-C-Cr2O3电池的可逆比容量仍然高达639 mAh/g。M-C-Cr2O3性能的提高主要是由于碳的协同作用,即在高温处理阶段限制Cr2O3的晶体生长,缓冲Cr2O3在循环阶段的体积变化。经过5 次循环后,容量几乎不再衰减,表现了极佳的循环稳定性。遗憾的是多孔结构的缺陷在于对倍率性能改善效果较差,所以并未给出倍率测试的数据。
Wang 等[36]采用涂层热解策略,以TiO2包覆MIL-101(Cr3+)作为金属有机骨架(MOF)前驱体,合成了核壳八面体结构的Cr2O3@TiO2复合材料。其材料于0.5C充放电倍率下首次放电比容量为1 138 mAh/g,略高于Cr2O3的理论容量。经过500 次循环后,其可逆比容量为510 mAh/g,而无TiO2外壳的纳米Cr2O3可逆比容量不足200 mAh/g。Cr2O3@TiO2表现出更好的循环性能,是性能最好的Cr2O3负极材料之一。
刘豫州[37]为提高锂离子电池的电化学性能,采用水热法制备碳包覆三氧化二铬(Cr2O3@C),XRD 图谱没有检测到元素Cr 或其他Cr 氧化物的特征峰,证明此方法制备了高纯度的Cr2O3晶体。再将制得材料作为负极制成CR2032 型扣式电池。从电化学性能数据看,不含碳的Cr2O3样品在100 mA/g 电流密度下的首次放电比容量为968 mAh/g,而铬酸铵与蔗糖摩尔比为2∶1 和1∶1 的两种复合样品的首次放电比容量分别为1 494 和1 279 mAh/g,皆高于不含碳的Cr2O3。其中碳含量较高的复合材料在100 mA/g 的电流密度下充放电循环300 次后仍保持542 mAh/g的可逆比容量,远高于不含碳的Cr2O3,也优于同等条件下含碳量较少的复合材料。总之两种复合样品的电化学性能全方面超过Cr2O3材料,说明复合材料的结构起到了保护电极的重要作用。
此外,刘豫州还用酚醛树脂为碳源对Cr2O3材料进行包覆,添加量分别为160、240、320 mg。三氧化二铬晶体与酚醛树脂混合,充分反应后,最终在高温下退火来制备碳包覆三氧化二铬复合材料。XRD 光谱上虽也没有检测到对应于元素Cr或其他Cr氧化物的特征峰,但是随着酚醛树脂含量的增加,整体上Cr2O3的峰因为无定形碳的物相结构而变弱。在电化学数据上,三种复合材料在100 mA/g 电流密度下首次放电比容量皆高于Cr2O3的理论比容量(1 058 mAh/g),其中添加320 mg 酚醛树脂的复合材料首次放电比容量最高,达到1 353.8 mAh/g。但在第二次放电/充电循环中,酚醛树脂用量为240 mg 的复合材料容量保持率最好,达到69.54%,此结果证明了碳含量的增加并不能降低电池比容量的衰减,并且经过100 次循环后放电比容量维持在541.7 mAh/g;经过高电流密度的倍率测试后仍达到了690.3 mAh/g 的放电比容量,也表现出了更优的倍率性能和循环性能。添加适量的酚醛树脂可以合成性能优异的复合材料。
赵星等[38]为改善Cr2O3材料的电子、离子电导率,通过高温固相反应法制备得到Cr2O3/TiO2复合材料。SEM 及XRD 分析表明,所制备的复合材料为TiO2掺杂进入Cr2O3中形成均一的固溶体。电化学性能测试表明,掺杂TiO2后Cr2O3的首次放电比容量只有1 012 mAh/g,略低于商品化的Cr2O3,可能是TiO2本身的容量较低导致,但是循环性能得到明显提升,22 次循环后仍然具有454 mAh/g 的比容量,容量保持率为73.6%。实验数据表明掺杂TiO2显著提高了Cr2O3材料的电导率,从而改善了材料的循环性能。
传统的Cr2O3材料在经过充放电循环后,材料体积发生了巨大的变化,材料内部结构遭到破坏,并且随着循环次数的增加,电池性能也会快速下降,即使是纳米化的Cr2O3材料也会对电化学性能产生影响,在大电流工作时,会出现严重的团聚现象。这些都会降低Cr2O3材料的导电性及循环性能。可以通过构建具有特殊形貌的纳米复合材料,如中孔、碳包覆结构,或者进行杂原子、TiO2等掺杂,显著提高其导电性及电化学性能。不同的改性手法也可以综合运用,以获得更好的改性效果和性能。
4 结语
本文综述了Cr8O21、Cr2O5作为锂电池正极材料和Cr2O3作为负极材料的最新研究进展,总结出充放电反应机理,并从结构、制备方法、改性手段及应用等方面进行了重点介绍。虽然铬氧化物具有比容量高、成本低的特点,但由于其首次充放电不可逆比容量损失较大等问题,仍需进行进一步优化。研究表明,Cr8O21首次放电中的不可逆相变是放电比容量损失的主要原因,而颗粒脱落是后续循环中容量衰减的主要原因,锂化氧化铬的结构在此之后趋于稳定。如果能通过某些改性手段降低首次放电中损失的比容量,就能使Cr8O21的循环性能得到很大的提升,这也表明Cr8O21是一种很有前途的可充电锂电池正极材料。Cr2O5材料成本低,能量密度大,合成工艺十分简单,因此在储能领域具有广阔的应用前景。Cr2O3在过渡金属氧化物中具有较高的理论容量和相对较低的Li+插入电位,作为锂离子电池的新型负极材料受到了研究人员的关注。然而,Cr2O3作为负极时还存在体积膨胀、循环性能较低、电导率低等问题,虽对其进行纳米化、多孔结构、表面包覆等改性都有些成效,但仍需进一步提升。后续的研究工作将主要集中在优化合成工艺、对材料进行体相掺杂改性以及表面修饰等方面,以期获得性能更好的铬氧化物材料。

