TFF3依赖TWIST1上调TRIB3促结直肠癌转移的机制
陈佳乐,帕尔哈提·沙依木,舒垠,苏比依努尔·苏拉依曼,艾克热木·玉苏甫
0 引言
结直肠癌已成为世界第三大常见癌症,仅次于肺癌和乳腺癌(女性)/前列腺癌(男性),并且也是导致癌症相关死亡的主要原因[1]。结直肠癌的复发和转移是患者生存率下降的主要原因之一,在结直肠癌患者中,15%~25%的患者在诊断时已经出现了恶性扩散,而这些患者的5年生存率仅有10%左右[2]。因此,深入探究结直肠癌细胞增殖、迁移和侵袭的机制对于阻断该疾病的进展至关重要。
三叶因子3(trefoil factor 3, TFF3)是一种由TFF基因编码的小分子肽类蛋白。它通常存在于多种黏膜表皮细胞中,如胃肠道、呼吸道及泌尿生殖道等部位[3],可通过促进黏膜细胞增殖和迁移、以及调节黏附分子表达等途径参与黏膜屏障的维持和修复[4]。新近研究发现,TFF3在多种恶性肿瘤中显著上调,并都发挥着相似的生物学功能,与肿瘤细胞增殖、浸润、远处转移以及凋亡耐受等过程密切相关,其高表达通常提示着肿瘤的高侵袭性和不良预后[5-8]。故TFF3被认为是癌基因,有望成为潜在的治疗靶点。尽管TFF3在多种肿瘤组织中存在表达增高的现象,但是关于其在结直肠癌中的表达情况报道不一[9-10],而有关TFF3如何促进结直肠癌侵袭和转移的具体机制知之甚少。TWIST1是一种高度保守的碱性螺旋-环-螺旋(bHLH)蛋白和转录因子。已被证明可以调节癌症转移并诱导上皮间质转化(epithelial- mesenchymal transition, EMT)[11]。 我们前期研究发现[12],TFF3和TWIST1基因在不同转移潜能的结直肠癌细胞系中表达逐渐增强,TFF3的过度表达可以上调Twist1的表达水平,故推测TFF3可能调控Twist1表达,并促进结直肠癌细胞的侵袭、转移,且此作用可能与EMT有关。
为了探究TFF3表达调控的下游分子,我们通过分析稳定上调TFF3的HT29细胞的表达谱芯片发现,TFF3过表达可以显著增强假性蛋白激酶3(tribble homolog 3, TRIB3)基因的表达。因此,我们推测TFF3可能与TWIST1转录调控下上调TRIB3的表达有关,并且通过与TWIST1/TRIB3通路协同作用来调节结直肠癌细胞的生物学行为。为了证实这种假设,本研究计划构建TFF3过表达HT29细胞模型,并检测TWIST1和TRIB3的表达情况,以深入研究它们对HT29细胞增殖、侵袭、转移能力的影响及EMT诱导的分子机制,为结直肠癌的治疗和预防提供新的靶向策略。
1 材料与方法
1.1 材料
HT29人结肠癌细胞、McCoy’s 5A培养基购自南京凯基生物技术股份有限公司;胎牛血清、Lipofectamine®3000转染试剂购自美国Life Technologies公司;青霉素-链霉素双抗(10 000 U)购自美国Hyclone公司;TFF3过表达质粒载体购自日本TaKaRa公司;CCK-8试剂盒、qRT-PCR反应试剂盒购自北京全式金生物技术有限公司;FastQuant RT Kit(With gDNase)反转录试剂盒、BCA蛋白浓度测定试剂盒购自北京天根生化科技有限公司;TRIzol试剂购自美国Invitrogen公司;RIPA裂解液、兔抗山羊IgG购自武汉博士德生物工程有限公司;PVDF膜购自美国Millipore公司;ECL发光试剂盒、山羊抗兔IgG购自美国Thermo Fisher Scientific公司;TFF3、TWIST1、TRIB3、E-cadherin、Vimentin、Snail和β-actin抗体均购自英国Abcam生物公司;Transwell小室购自美国CORNING公司;伤口愈合2孔插件购自德国IBIDI公司;CO2细胞培养箱购自上海力康仪器有限公司;qRT-PCR引物由新疆昆泰瑞生物技术有限公司设计并合成。
1.2 方法
1.2.1 细胞培养 HT29细胞在含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的McCoy's 5A完全培养基中培养,并置于37℃、5%CO2培养箱中。当细胞融合率达到90%时,采用PBS缓冲液洗涤两次后加入1 ml的0.25%胰酶溶液进行消化,然后按照1:2的比例进行细胞传代。取对数生长期状态良好的细胞用于后续实验。
1.2.2 TFF3表达质粒构建与细胞转染 利用PCR技术扩增TFF3基因片段,并将其与pIRES2增强的绿色荧光蛋白载体连接构建TFF3表达质粒。将HT29细胞接种于24孔板中,每孔均匀分布5×103个细胞,当细胞融合率达到60%~80%后,使用不同浓度的Lipofectamine®3000试剂将TFF3表达质粒(pIRES2-TFF3组)或空载体质粒(Vector组)转染到HT29细胞中。随后,在37℃、5%CO2的培养箱中培养24 h、48 h后采用荧光倒置显微镜对转染效果进行观察和拍摄。
1.2.3 Western blot法检测蛋白表达 向待测HT29细胞中加入0.5 ml RIPA裂解液(RIPA:PMSF=100:1)于冰上裂解,接着使用12 000 r/min、4℃离心15 min,收集上清液,并使用BCA蛋白质检测试剂盒测量蛋白质浓度。然后将样品与5×SDS-PAGE混合,100℃沸水加热变性5 min,冷却后,12 000 r/min、4℃离心5 min,收集的上清液即为总蛋白样品。制备SDS-PAGE凝胶,每孔上样20 μg蛋白质样品后进行电泳分离,并转移到PVDF膜上,随后用含5%脱脂奶粉的TBST封闭溶液封闭膜1 h,洗膜后用一抗4℃孵育过夜,分别孵育β-actin(1:2 500)、TFF3(1:300)、Twist1(1:500)、TRIB3(1:500)、E-cadherin(1:500)、Vimentin(1:500)、Snail(1:500)。 TBST洗膜三次后将膜与二抗兔抗山羊(1:5 000)或山羊抗兔(1:10 000)在封闭溶液中室温下孵育1 h,ECL发光显色液显影曝光后用化学发光成像仪进行蛋白表达水平的检测,并分析目的蛋白的相对表达量。
1.2.4 qRT-PCR实时荧光定量分析 使用TRIzol试剂提取待测HT29细胞中的总RNA。然后,参照FastQuant RT试剂盒说明书将RNA合成单链cDNA,在实时荧光定量PCR试剂盒的指导下制备PCR反应体系,并以该cDNA为模板,在PCR仪中进行40个循环扩增反应。反应条件:预变性(95℃, 2 min),变性(95℃, 15 s),退火延伸(60℃, 60 s)。β-actin作为管家基因,引物序列见表1。采用公式2-△△Ct计算目的基因的相对表达量。

表1 引物序列Table 1 Primer sequence
1.2.5 CCK-8细胞增殖测定 将待测HT29细胞悬液接种于96孔板中,每孔加入5×103个细胞,37℃、5%CO2培养箱中培养48 h。弃去培养液,加入预先配置好的10%CCK-8溶液,并置于37℃、5%CO2培养箱中培养2 h。在450 nm波长处使用酶标仪检测OD值。
1.2.6 细胞划痕实验 将转染后的待测细胞接种于培养皿中间的2孔插件上,然后让细胞在插件区域生长至覆盖插件表面。随后,使用镊子轻轻地移除插件,从而形成一条宽度为500 μm的细胞划痕。在0、24、48和72 h时使用显微镜观察细胞在划痕处的迁移状态并拍摄图片。
1.2.7 Transwell实验 实验前,使用无血清培养基稀释Matrigel胶至终浓度1 mg/ml,并将其加入到chamber上室底部中央垂直位置,形成基质胶。待测的HT29细胞制备成浓度为每毫升2×105个细胞的悬液,将其以每孔100 μl分别加入到带或不带有基质胶的chamber上室底部,而下室加入含10%胎牛血清的完全培养基。细胞在37℃、5%CO2的培养箱中培养24 h后,取出小室进行固定、透化和染色。最后,擦去上室底部膜表面上的细胞,在显微镜下随机选择5个视野计数并统计结果。
1.2.8 透射电子显微镜观察细胞超微结构 收集转染48 h后的HT29细胞并用PBS洗涤两次后去除上清液,加入2.5%戊二醛进行固定。室温下对固定的细胞进行丙酮脱水并在1%锇酸溶液中处理2 h,环氧树脂包埋。包埋完成后,利用超薄切片技术将样品切成块状,并进行铅、铀染色。最后,通过透射电子显微镜观察已染色样品并拍摄图像。
1.3 统计学方法
采用SPSS22.0软件进行统计学分析,数据均用(±s)表示,两组数据间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TFF3过表达后HT29细胞中TFF3、TWIST1和TRIB3的表达
qRT-PCR结果显示:pIRES2-TFF3组TFF3 mRNA表达水平(2.283±0.405)显著高于对照组(1.000±0.174)(P<0.01),提示TFF3质粒转染后能够稳定提高TFF3的表达并为后续实验提供可靠基础。同时,相较于对照组,过表达TFF3后TWIST1(0.997±0.179vs.1.715±0.090)和TRIB3(0.804±0.215vs.1.802±0.115)的mRNA表达水平均明显上升,差异有统计学意义(均P<0.05),见图1。Western blot结果显示:TFF3蛋白在pIRES2-TFF3组和对照组细胞中均稳定表达,且在pIRES2-TFF3组中表达增加(P<0.01)。TFF3过表达后导致TWIST1,TRIB3蛋白表达水平明显上调,差异有统计学意义(P<0.01),见图2。
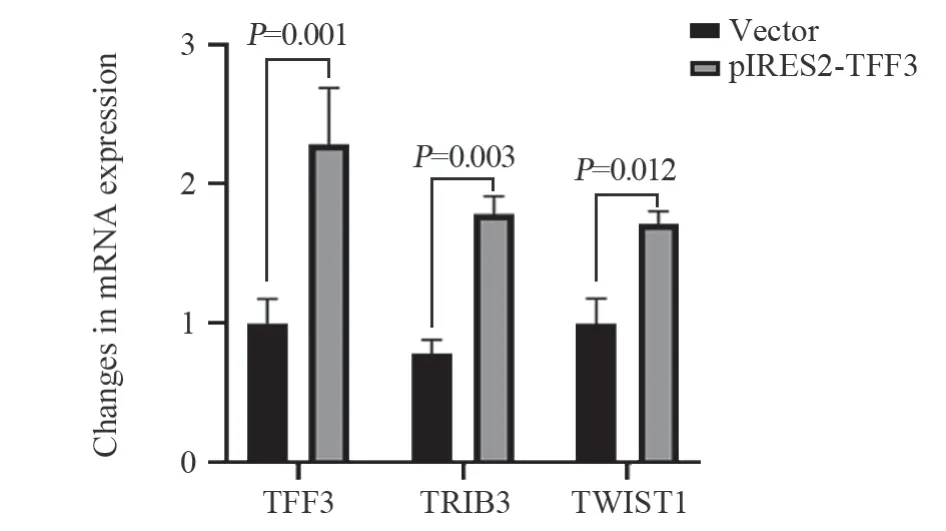
图1 TFF3、TRIB3及TWIST1基因相对表达量Figure 1 Relative expression levels of TFF3, TRIB3, and TWIST1 genes

图2 TFF3、TRIB3及TWIST1蛋白表达情况Figure 2 Protein expression levels of TFF3, TRIB3, and TWIST1
2.2 TFF3过表达后对HT29细胞增殖能力的影响
CCK-8实验结果显示:pIRES2-TFF3组在450 nm波长处OD值(1.618±0.016)显著高于对照组(1.461±0.012)(P<0.01),说明TFF3过表达提高了HT29细胞的增殖能力。
2.3 TFF3过表达后对HT29细胞迁移和侵袭能力的影响
Transwell体外迁移和侵袭实验结果显示:与对照组(78.333±32.097、62.600±28.127)相比,pIRES2-TFF3组的HT29细胞迁移(189.400±17.353)和侵袭(168.733±22.645)能力明显增强(P<0.01);划痕实验结果显示:72 h后,pIRES2-TFF3组细胞划痕几乎消失,而对照组仍有划痕空隙,见图3。该实验进一步证实了上调TFF3基因可以显著提高HT29细胞体外迁移速度。

图3 TFF3过表达后对HT29细胞迁移和侵袭能力的影响F i g u re 3 E f f e c t o f TFF3 overexpression on migration and invasion ability of HT29 cells
2.4 TFF3过表达后通过调控下游分子促进EMT
Western blot和qRT-PCR实验结果显示:相较于对照组,pIRES2-TFF3组中间充质标志物Vimentin、Snail的mRNA和蛋白质的表达量都明显增加(P<0.01),而上皮标志物E-cadherin的表达量降低(P<0.05),见图4。此外,TFF3基因过表达后的HT29细胞出现了形态变化,表现为细胞间连接减少、绒毛脱落、伪足形成、形态上细胞从圆形转变为多角形、梭形等,见图5。
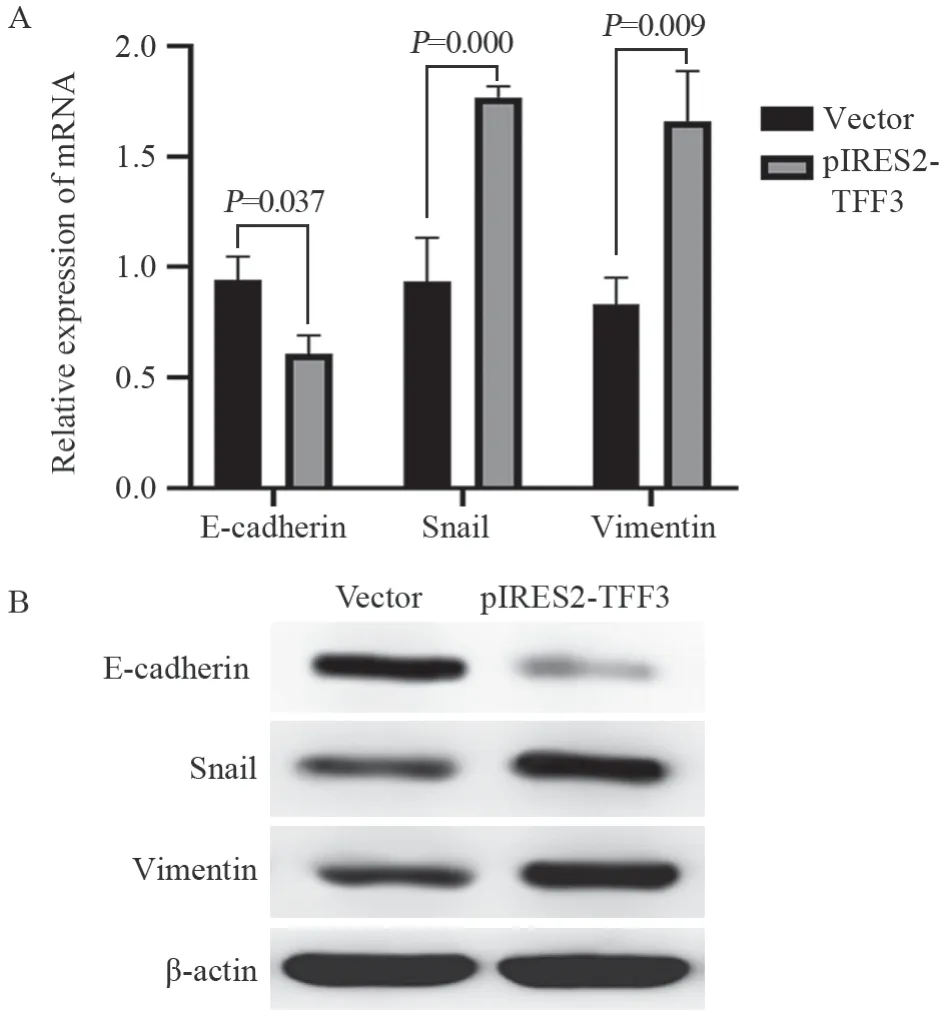
图4 TFF3过表达后EMT相关基因相对表达量(A)和相关蛋白表达(B)情况Figure 4 Relative expression of EMT-related genes(A) and protein expression levels(B) after TFF3 overexpression

图5 TFF3过表达后透射电子显微镜图片Figure 5 Transmission electron microscopy images after TFF3 overexpression
3 讨论
TFF3作为一种分泌性蛋白,在癌症中的作用机制比较复杂。虽然早期研究TFF3被认为具有肿瘤抑制因子的特性[13],但近年来其促癌作用备受关注。研究资料显示,TFF3能够激活HIF-1α/VEGFA信号通路刺激肿瘤细胞增殖、迁移和侵袭,并参与调节细胞新生血管生成而发挥其促癌作用[14]。此外,TFF3的过表达可抑制线粒体介导的细胞凋亡,调控细胞周期,影响肿瘤细胞凋亡程序并参与前列腺癌变[15]。多项研究表明,血清TFF3的含量还可以作为胰腺癌[16]、子宫内膜癌[17]、胃癌[18]等恶性肿瘤的新型标志物来进行检测和筛查。Zheng等[19]研究发现,TFF3可以持续上调TWIST1蛋白表达,并依赖TWIST1的激活来促进胃癌细胞株SGC7901的侵袭和迁移。而沉默TWIST1则削弱TFF3引起的侵袭和迁移效应,从而降低肿瘤的恶性程度。
TRIB3基因为新发现的假性蛋白激酶家族成员,其编码的蛋白作为信号转导介质和支架蛋白,能够与多个信号通路的关键分子相互作用并影响它们的稳定性和活性,在细胞生存、分化和功能中发挥至关重要的作用[20]。研究表明,TRIB3在肝癌[21]、肺癌[22]、结直肠癌[23]等实体肿瘤细胞中高表达,被认为是一种潜在的癌基因;同时,在结直肠癌组织中TRIB3的表达水平与肿瘤转移密切相关。此外,在急性早幼粒细胞白血病(APL)中,TRIB3可通过与TWIST1结合并稳定高水平的TWIST1表达来促进白血病细胞的生存,并导致对全反式视黄酸(ATRA)耐药[24]。因此,基于之前的研究结果,进一步探究TFF3、TWIST1和TRIB3分子之间的相互作用机制,对于阐明结直肠癌发生、发展和转移的分子机制具有重要意义。本研究通过构建pIRES2-TFF3质粒并将其转染到结直肠癌HT29细胞中,采用Western blot和qRTPCR等实验方法分析过表达细胞模型中TRIB3、TWIST1蛋白质和mRNA水平的变化趋势,发现TFF3过表达后,在转录和翻译水平上TRIB3、TWIST1均表达上调。体外实验结果表明,TFF3基因的上调增强了HT29细胞的增殖、迁移和侵袭能力。上述结果共同表明,在HT29结肠癌细胞系中,高表达TFF3基因能够正向调节HT29结肠癌细胞系中TWIST1和TRIB3 mRNA及蛋白质的表达水平。这提示TWIST1和TRIB3可能作为TFF3基因调控的下游分子靶点发挥其生物学功能,进而参与结直肠癌的发生发展。
转录因子TWIST1是调节EMT过程的主要基因之一[11],而EMT的发生与进展被认为是癌症侵袭和转移的主要途径,故推测TFF3基因在EMT过程中具有一定的作用。为了更深入地探究其作用机制,我们研究了TFF3基因表达调控对EMT过程的影响。实验结果表明,在mRNA和蛋白质水平上,TFF3过表达显著促进了间充质标志物Vimentin和Snail的表达水平,并抑制了上皮标志物E-cadherin的表达。同时,我们观察到TFF3过表达的HT29细胞发生了典型的EMT样式形态学改变:细胞逐渐失去其上皮特有的形态和功能,并获得更多间充质细胞特征,如细胞骨架结构的改变、细胞黏附力下降等。这种转化结果使得癌细胞具备了更强的侵袭和迁移能力,从而促进肿瘤的转移和扩散。因此,经实验验证,TFF3基因的高表达促进了EMT过程,并且TWIST1和TRIB3基因的激活可能是TFF3介导的HT29细胞增殖并通过EMT引发肿瘤细胞迁移和侵袭的原因。
综上所述,T F F 3 的过表达可能会启动TWIST1/TRIB3信号转导途径并激活EMT过程,并促使其参与肿瘤的发展和浸润转移,从而增强结直肠癌HT29细胞的不良生物学行为如肿瘤细胞增殖、迁移和侵袭等,提示其可能作为结直肠癌新的治疗靶点。然而,该研究仍需要进行TFF3基因敲减和使用TWIST1转录因子抑制剂等实验来进一步确认其靶向作用,以提供更全面的认识。这些结果将为结直肠癌的初期诊断及有效的靶向治疗提供重要策略和依据。
利益冲突声明:
所有作者均声明不存在利益冲突。

