胰腺癌患者口腔菌群多样性组成谱的系统评价
殷智洪,张郴燕,黄海溶
0 引言
胰腺癌是一种病死率高、预后差的消化系统肿瘤[1]。由于其发病的隐匿性,大多数患者发现时已处于中晚期,五年生存率约为11%[2]。随着全球人口老龄化,胰腺癌的发病率在许多国家和地区都呈现上升趋势,已经成为威胁人类健康的重要公共卫生问题[3]。临床上胰腺癌的治疗方法有手术、化疗、放疗、靶向药物、免疫治疗等等,但治疗效果有限,亟需探索胰腺癌早期检出和治疗的方法。
口腔微生物群在人类口腔中共有700多种细菌,它们不仅维持口腔内环境的稳定,对于维持机体健康也发挥着重要作用[4]。口腔菌群的多样性是指在口腔内定殖的细菌种类数,口腔菌群多样性组成谱是指在口腔内定殖的细菌群落处于动态平衡的状态,这种状态有助于消化吸收、生长发育、能量代谢、免疫调控等,是维持身体健康的重要微环境。随着微生物组学技术的发展,口腔菌群与各种疾病之间的关系成为研究的关注点,其不仅与牙周病、龋齿和口腔癌等口腔疾病密切相关[5],与远处器官的癌变也有关,如大肠癌、食管癌和胰腺癌等[6-8]。有研究发现,胰腺癌患者与健康对照的口腔菌群存在差异,但是多样性组成谱的研究结果并不完全一致[9-15]。为了获得更可靠的胰腺癌患者口腔菌群的特征,本研究系统评价了胰腺癌患者口腔菌群多样性组成谱,以期为进一步开发胰腺癌早诊早治的新方法提供参考。
1 资料与方法
1.1 纳入和排除标准
纳入标准:(1)研究类型:横断面研究;(2)研究对象:经肿瘤标志物、影像学检查或病理检测临床诊断为胰腺癌的新发病例,对照为健康人群;年龄、性别均不限;(3)研究方法:采集研究对象唾液样本立即冻存,通过Illumina MiSeq、HiSeq等平台进行口腔菌群16SrRNA、16SrDNA或宏基因组测序;(4)分析指标:Shannon指数、Simpson指数、Chao1指数、相对丰度。排除标准:(1)重复发表或数据相同的文献;(2)非中、英文文献;(3)数据不详或有误的文献。
1.2 文献检索策略
检索The Cochrane Library、PubMed、Web of Science、Embase、CNKI、CBM、万方和维普数据库,搜集胰腺癌患者口腔菌群多样性组成谱的横断面研究,检索时限均从建库至2023年7月15日。检索采用主题词与自由词相结合的方式进行,并根据各数据库特点进行调整。同时检索纳入研究的参考文献,以补充获取相关资料。英文检索词包括:Pancreatic Neoplasms、Pancreas Neoplasms、Cancer of Pancreas、Oral Microbiome、Oral Microflora、Oral Microbial Community、Oral Microbiota、Salivary Microbiota、Saliva Sample等。中文检索词包括:胰腺肿瘤、胰腺癌、口腔微生物组、口腔菌群、口腔微生物群落、唾液细菌、唾液样本等。
1.3 文献筛选和资料提取
由2名研究者独立筛选文献、提取资料并交叉核对。如有分歧,则通过讨论或与第三方协商解决。文献筛选时首先阅读文题,在排除明显不相关的文献后,进一步阅读摘要和全文以确定是否纳入。如有需要,通过邮件和(或)电话联系原始研究作者获取未确定但对本研究非常重要的信息。资料提取内容包括:(1)纳入研究的基本信息(第一作者、发表年份、样本量等);(2)研究对象的基本特征(年龄、性别等);(3)测序方法、测序平台;(4)研究结果。
1.4 纳入研究的偏倚风险评价
偏倚风险评价采用AHRQ量表,该量表共有11个条目,其中条目11“如果有随访,查明预期的患者不完整数据所占的百分比或随访结果”不适用本研究,各条目分别用“是”、“不清楚”、“否”进行判断,“是”记1分,“不清楚”和“否”记0分,≥7分为高质量,4~7分为中等质量,0~3分为低质量。
1.5 统计学方法
采用RevMan5.4软件对ɑ多样性的Shannon指数和Simpson指数进行Meta分析。计量资料采用均数差(mean difference, MD)或标准化均数差(standardized mean difference, SMD)为效应分析统计量,并计算95%CI。纳入研究结果间的异质性采用χ2检验进行分析(检验水准为α=0.1),同时结合Ι2定量判断异质性大小。若各研究结果间无统计学异质性(Ι2≤50%,P≥0.10),则采用固定效应模型; 若各研究结果间存在统计学异质性(Ι2>50%,P<0.10),则进一步分析异质性来源,在排除明显异质性的影响后,采用随机效应模型进行Meta分析。Meta分析的检验水准设为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选流程及结果
通过文献检索共查找到681篇相关文献,其中PubMed(n=176)、Web of science(n=369)、EMbase(n=77)、The Cochrane Library(n=11)、CNKI(n=20)、CBM(n=4)、万方数据库(n=20)、维普数据库(n=4)。最终纳入7项横断面研究进行系统评价,过程见图1。

图1 文献筛选流程Figure 1 Flowchart of literature screening
2.2 纳入研究的基本特征与偏倚风险评价结果
纳入的7项研究中,3项研究对象是中国人,3项是美国人,1项是日本人。共纳入187例胰腺癌患者,其中男103例,女84例;健康对照共440例,其中男215例,女225例。有6个研究的测序方法是16SrRNA,1项研究采用宏基因组测序;有4项研究的测序平台是Illumina MiSeq,有1项研究的测序平台是Illumina Novaseq6000,有1项研究的测序平台是Illumina HiSeq,有1项研究的测序平台未提供,见表1。
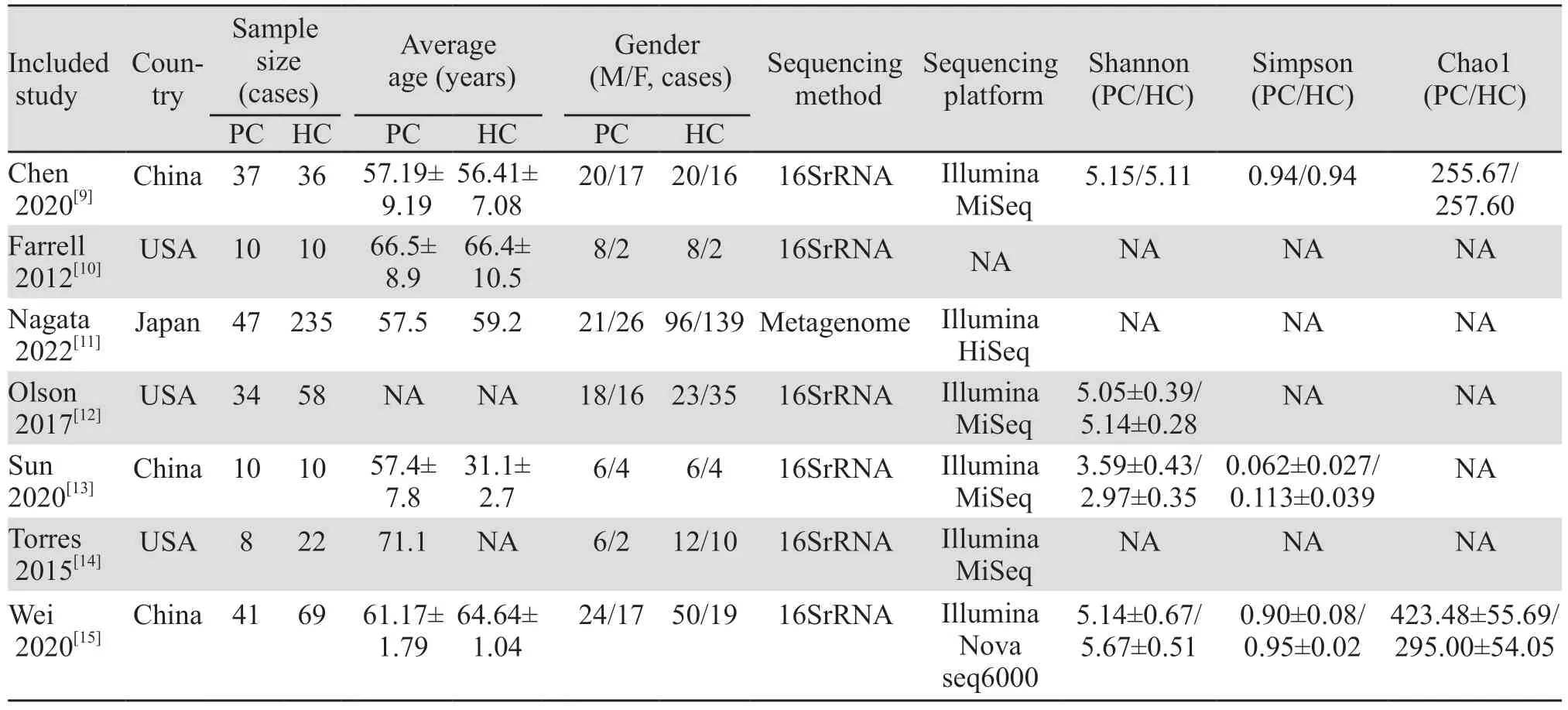
表1 纳入研究的基本特征Table 1 Basic characteristics of articles included
采用AHRQ量表进行偏倚风险评价,结果显示3项为8分,3项研究的总分均为7分,1项为6分。根据评价结果,有6项是高质量的研究,1项是中等质量研究,见表2。

表2 纳入研究的偏倚风险评价结果Table 2 Bias risk assessment of included studies
2.3 口腔菌群ɑ多样性Shannon指数的Meta分析结果
Shannon指数的Meta分析共纳入3项研究[12-13,15],由于Ι2=90%,故采用随机效应模型。结果显示,与健康对照组相比,胰腺癌患者肠道菌群Shannon指数降低(SMD=-0.02, 95%CI: -1.01~0.97,P=0.97),差异无统计学意义。逐一剔除每个研究进行敏感度分析,结果显示每次剔除后结果未发生显著变化,提示结果较稳定,见图2。
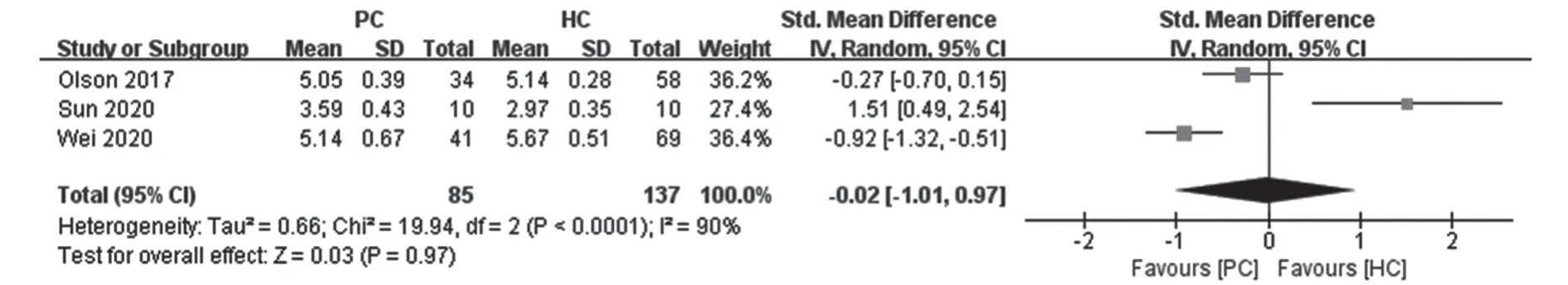
图2 口腔菌群Shannon指数的Meta分析Figure 2 Meta analysis result of Shannon index of oral microbiota
2.4 口腔菌群ɑ多样性Simpson指数的Meta分析结果
Simpson指数的Meta分析共纳入2项研究[13,15]。由于Ι2=0,故采用固定效应模型,结果显示,与健康对照组相比,胰腺癌患者肠道菌群Simpson指数降低(SMD=-1.04, 95%CI: -1.42~-0.66,P<0.001),差异具有统计学意义,见图3。

图3 口腔菌群Simpson指数的Meta分析Figure 3 Meta analysis result of Simpson index of oral microbiota
2.5 口腔菌群相对丰度分析
胰腺癌患者与健康对照比较,在门、属、种水平相对丰度有差异的口腔菌见表3~4,其中有6项研究结果显示,胰腺癌患者口腔菌群中厚壁菌门相对丰度较高,3项研究显示普氏菌属较高,2项研究显示罗斯氏菌属较高,2项研究显示链球菌属较高;有2项研究显示胰腺癌患者口腔菌群中变形菌门相对丰度较低,4项研究显示奈瑟菌属相对丰度较低,2项研究显示嗜血杆菌属较低,2项研究显示卟啉单胞菌属较低,2项研究显示副流感嗜血杆菌相对丰度较低。本研究结果显示厚壁菌门、普氏菌属、奈瑟菌属的变化情况在多项研究中结果一致,见表5。

表3 胰腺癌患者相对丰度上升的口腔菌Table 3 Oral bacteria with increased relative abundance in patients with pancreatic cancer

表4 胰腺癌患者相对丰度下降的口腔菌Table 4 Oral bacteria with decreased relative abundance in patients with pancreatic cancer

表5 胰腺癌患者主要口腔菌相对丰度变化情况Table 5 Changes in relative abundance of major oral bacteria in patients with pancreatic cancer
3 讨论
Shannon指数和Simpson指数均能反映菌群ɑ多样性,Simpson指数主要体现物种的均匀度,Shannon指数对物种丰富度更敏感[16]。本研究发现,胰腺癌患者与健康对照相比,Shannon指数显示口腔菌群丰富度虽有下降,但差异无统计学意义。进一步分析发现Shannon指数Meta分析时研究的异质性较大,其原因可能与纳入的研究地区、研究对象的差异有关,经敏感度分析,提示结果较稳定。本研究发现反映口腔菌群均匀度的Simpson指数在胰腺癌患者中显著降低,与健康对照比较差异有统计学意义,可能是胰腺癌细胞生长增殖对机体的营养需求和各类物质代谢与正常细胞有差异[17],会导致部分口腔菌群的生长受到抑制或促进,而导致口腔菌群的均匀度有差异。
本研究发现厚壁菌门、普氏菌属、链球菌属等口腔菌群在胰腺癌患者中相对丰度升高,而奈瑟菌属相对丰度下降。目前厚壁菌门、普氏菌属、奈瑟菌属等口腔细菌与胰腺癌的研究仍处于丰度层面,具体作用机制仍不明确。厚壁菌门是人类口腔菌群中占比较高的一个门类,门下有许多细菌,研究者更关注各菌属与胰腺癌的关联。一项胰腺癌与肠道菌群系统评价[18]结果表明,普氏菌属在胰腺癌患者中的相对丰度较高,与本研究结果一致。普氏菌属是一类革兰氏阴性菌,目前发现普氏菌在泌尿生殖系统感染、多发性硬化症和类风湿关节炎中都存在致病作用[19],未发现有普氏菌与胰腺癌是否存在因果关联的研究,提示有必要进一步研究普氏菌与胰腺癌的关系。奈瑟菌属是一群革兰染色阴性双球菌,其中只有脑膜炎奈瑟菌和淋病奈瑟菌对人体有致病性[20];在另一项肠道微生物群与胰腺癌的系统评价中[21]也发现胰腺癌患者中奈瑟菌属相对丰度下降,进一步说明奈瑟菌属与胰腺癌存在相关性,值得进一步研究。链球菌属一类革兰阳性球菌,属中的肺炎链球菌和A群链球菌已发现对人类有致病性[22];本研究发现链球菌属在胰腺癌患者中有较高相对丰度,Yang等[23]曾研究发现链球菌属可作为胰腺癌的生物标志物,说明链球菌属也与胰腺癌存在相关性,需进一步探讨。综上研究发现,未来需更多研究进一步验证普氏菌、奈瑟菌、链球菌在胰腺癌发生发展中的作用,并深入探讨其机制,为开发早诊早治胰腺癌的新方法提供科学证据。
本研究的局限性:(1)受限于纳入研究的数量、报告数据的不全,仅对口腔菌群α多样性部分指标进行定量分析,未能全面分析口腔菌群的多样性;(2)研究均为横断面研究,研究结果只能提示口腔菌群多样性组成谱与胰腺癌有关联,不能验证两者间的因果关系。
综上所述,现有证据表明胰腺癌患者口腔菌群多样性组成谱存在一定的特征。与健康对照者相比,定量分析中Simpson指数反映的多样性显著降低;定性分析中厚壁菌门、普氏菌属、罗斯氏菌属、链球菌属的相对丰度较高,而变形菌门、奈瑟菌属、嗜血杆菌属、卟啉单胞菌属、副流感嗜血杆菌的相对丰度较低。受限于纳入研究的数量、质量、报告数据不全等问题,本研究结果尚待更多高质量研究予以验证。
利益冲突声明:
所有作者均声明不存在利益冲突。

