无定形硅铝材料的制备及应用研究进展
鲍 俊,曾双亲,杨清河,聂 红,曾晓飞,桑小义,侯冉冉
(1.中石化石油化工科学研究院有限公司,北京 100083;2.北京化工大学)
随着石油化工和新能源产业的加速发展,中国的汽柴油消费量逐渐饱和,能源结构正逐步调整,“减油增化”成为炼化企业转型升级的重要方向[1]。加氢裂化、催化裂化是燃料型炼厂向炼化一体化过渡的重要技术,通过大分子烃类的裂化可生产乙烯、丙烯等高价值化工品。无定形硅铝(ASA),又称含硅氧化铝,具有较大的孔径、孔体积,其表面同时具有Brønsted酸中心和Lewis酸中心,可产生协同效应,因而在加氢裂化、加氢精制、催化裂化等多个技术领域显示出重要作用[2-3]。ASA材料的孔道结构、表面酸性等对催化剂的性能有重要影响。高性能的ASA材料需要具有较大的比表面积、适宜的孔体积和酸性。目前国内使用的高性能ASA材料主要依赖进口,材料结构和酸性不能根据需求进行必要的调整,且产品供应周期和价格受国际环境影响,不确定因素较多。基于此,综述了有关ASA材料的制备方法、酸性机理和应用效果,对于自主研发可控制备高性能ASA材料具有一定意义。
1 制备方法
ASA材料的研究始于20世纪30年代,其结构可在较大范围内调控,比表面积在200~600 m2/g之间,孔体积在0.6~2.0 cm3/g之间[4]。尽管ASA名称中带有“无定形”,但随着组成的不同,其晶型略有区别[5]。当SiO2含量较低时,ASA中可能存在较弱的γ-Al2O3晶型,而当SiO2含量较高时,则表现为无定形态。常用的制备方法主要有溶胶-凝胶法、醇铝法、中和沉淀法、化学气相沉积法、碳化法、火焰喷雾热解法等[6-9]。不同的制备方法制备的ASA材料孔道结构、酸性强弱及杂质含量等各有特点。ASA材料的制备关键是控制晶粒成核以及生长,精准调控制备过程中ASA前体形貌、粒子堆积方式和相互作用力,得到具有不同比表面积、孔结构和酸性的ASA材料。
1.1 溶胶-凝胶法
溶胶-凝胶法制备ASA材料通常以含铝的醇盐作为铝源,以正硅酸、正硅酸乙酯(TEOS)等为硅源,进行水解、缩合反应,在老化过程中形成三维网络结构凝胶,凝胶经干燥、焙烧后得到纳米结构的材料。溶胶-凝胶法合成温度低,产品纯度高、比表面积大、孔分布集中,常作为贵金属催化剂载体材料。
Yabuki等[10]以TEOS、硝酸铝和多种有机添加物为原料制备了ASA材料,考察了不同的有机物对孔道和酸性位点的影响。当有机物的平均相对分子质量为100 000(如聚环氧乙烷)时,可形成连续的大孔。而当有机物相对分子质量较低(乙二醇低聚物或柠檬酸)时,只能形成介孔。研究还发现,有机物不仅可以改变孔道结构,还能够增加硅与铝阳离子之间的相互作用,从而增加铝的分散度,提高酸性和活性。Li Tao等[11]将适量乙酰丙酮铝和TEOS溶于醋酸中形成前体溶液,通过溶剂的蒸发转变为胶状致密凝胶。将凝胶样品干燥、焙烧后得到不同硅铝摩尔比的ASA产品。所得ASA材料均为无定形态,粒子为不规则球状,直径在50 nm以内,比表面积在374~594 m2/g之间,且随着摩尔比的增加而增大。当摩尔比为1.5时,ASA有最高的Brønsted酸浓度(49.3 μmol/g)。为了降低溶胶-凝胶法的制备成本,他们还对上述方法进行了改进[12],以水为主要溶剂,用Al(NO3)3·9H2O代替昂贵的有机铝前体,不仅有效地提高了酸密度,而且降低了成本。制备的ASA材料具有均匀的中孔分布(约3.8 nm)和大比表面积(455 m2/g),200 ℃下的Brønsted酸密度是商业产品Siral 70的1.5倍。
1.2 醇铝法
醇铝法以醇铝为原料,经水解过程先制备拟薄水铝石前身物,再向前身物中引入硅源制备ASA材料。醇铝法的本质是将SiO2前身物接枝到水合氧化铝或者勃姆石上,其优点是制备的材料纯度高、比表面积大以及结构易控制。德国Sasol公司以高纯铝屑和高级醇为原料制备了不同组成的ASA,其性质如表1所示[13]。当ASA材料中SiO2质量分数从1%增加到40%时,比表面积从280 m2/g增加到480 m2/g,孔体积从0.5 cm3/g增加到1.0 cm3/g。

表1 Siral系列无定形硅铝性质
1.3 中和沉淀法

Xu Benjing等[15]在三口烧瓶中并流加入Al2(SO4)3和NaAlO2,所得沉淀经老化后再加入硅酸钠继续老化,以此制备具有高度热稳定性的介孔ASA材料。研究结果表明,硅酸钠的加入降低了Al2O3的结晶度,提高了材料的孔体积和比表面积。当反应pH为9和SiO2添加量(w)为12%时,可以同时获得最大的孔体积(1.46 cm3/g)和比表面积(427.69 m2/g)。该材料在1 000 ℃下焙烧4 h后,比表面积仍然约为351 m2/g,孔体积约为1.11 cm3/g,表现出较好的热稳定性。
除并流中和外,还有学者采用pH摆动法[16-17]、超重力法[18]等技术制备载体材料,以强化其物化性能。Bao Jun等[19]采用pH摆动法制备ASA材料,即在同一反应器中多次加入酸性原料(硫酸铝)和碱性原料(偏铝酸钠、硅酸钠),反应体系在酸性和碱性之间来回摆动。随着ASA中SiO2的质量分数从20.1%增加到67.0%,比表面积从436 m2/g减小到306 m2/g,孔体积从0.97 cm3/g减小到0.49 cm3/g,形貌从松散的纤维状变成紧密堆积的颗粒状。与并流沉淀相比,pH摆动沉淀可以提高ASA的比表面积。杜君臣等[20]采用分步沉淀法制备了不同Si/Al比的ASA材料。研究表明,以硅酸钠为硅源时,制备的ASA材料比表面积和酸性均较优,且当SiO2质量分数为55%时,ASA材料具有最大总酸量(0.168 mmol/g)和较高的比表面积(340 m2/g)。
1.4 化学气相沉积法
化学气相沉积法(CVD)是将气相物质沉积在基体表面的过程。对于ASA材料,通常是以Al2O3为基体,TEOS、Si(OCH3)4等为硅源。CVD法制备条件易控制,Si可在Al2O3表面均匀分布。但CVD法反应温度较高,且无法大规模制备。
Caillot等[21]考察了不同的制备条件对Si/Al2O3的影响,如预处理温度、合成温度、前身物加入量等。制备的材料的比表面积为200~550 m2/g,孔体积为0.25~0.90 cm3/g,孔径为2~10 nm。随着SiO2负载量的增加,Si/Al2O3的比表面积逐渐降低,平均孔径减小。比表面积的降低不仅与硅这种无孔材料的沉积有关,还因为硅的沉积堵塞部分孔道。Katada等[22]研究了Si(OCH3)4在γ-Al2O3上的化学气相沉积的机制。在320 ℃静态系统下沉积时,单层SiO2几乎完全覆盖了表面。即使在低温下(小于200 ℃),Si(OCH3)4也能快速沉积,但在低硅浓度下,沉积很容易饱和,SiO2层只覆盖了表面的一部分。在220 ℃和320 ℃时(小于150 ℃)沉积的单层硅上观察到丁烯异构反应。而在低温(小于150 ℃)下沉积的样品几乎没有任何活性,表明Si-O-Si网络中的Al-O-Si-OH拥有Brønsted酸性,而分散的SiO2物种没有酸性。400 ℃下随机沉积形成了包括厚层和/或颗粒的SiO2的异质结构,活性较低。为了使单层硅固体酸催化剂实现工业应用,该研究团队继续开发了一种在γ-Al2O3上进行Si(OCH3)4化学气相沉积的连续流动方法[23]。静态方法与动态方法获得的固体酸催化剂催化1-丁烯双键异构化反应的活性和热稳定性相似,表明连续流动法制备SiO2单层催化剂是可行的。
1.5 碳化法
碳化法是生产Al2O3、CaCO3等材料的主要方法之一,通过向碱性前体溶液中通入CO2,降低体系的pH,从而使目标产物发生沉淀。碳化法工艺简单,成本低,对环境的污染较小。
成胶方式、水洗温度、洗涤次数等都会影响材料的结构。邓建科等[24]将偏铝酸钠和水玻璃按比例进行混合,再向体系中通入CO2气体,使Al2O3和SiO2发生共沉淀,考察了不同的沉淀方式对ASA孔结构的影响。通过控制沉淀条件,可以制备孔体积大于0.9 cm3/g和比表面积大于350 m2/g的ASA材料。孙晓艳等[17]发明了一种碳化法制备ASA的方法,向铝酸钠溶液和含硅前体溶液的混合液中通入CO2,成胶过程采用pH值摆动法。通过该方法,可以制备孔体积为0.8~1.5 cm3/g和比表面积为300~550 m2/g的ASA材料。杜艳泽等[25]从加料顺序和方式、成胶温度、老化时间等方面系统考察了碳化法制备ASA孔结构的影响因素。结果表明,对碳化法来说,只有在较低的温度下才能制备出较大孔体积的ASA,延长老化时间可以改善ASA的孔结构。
1.6 火焰喷雾热解法
火焰喷雾热解法(FSP)是制备金属氧化物颗粒的一种方法。金属前体溶液经雾化器后,在火焰产生的高温中发生热分解,转化成金属氧化物,如图1所示。金属前体类型、前体溶液浓度、火焰温度、停留时间等是决定氧化物粒径的重要因素。通过FSP方法可低成本合成ZnO、TiO2,Al2O3,Fe2O3,V2O5等纳米金属氧化物。
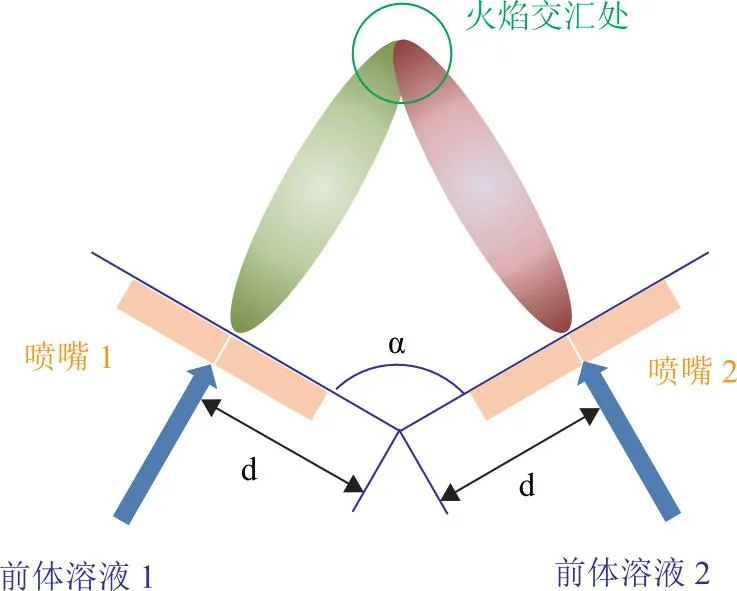
图1 火焰喷雾热解法示意
Huang Jun等[26]将乙酰丙酮铝、TEOS溶解在甲醇/醋酸(1∶1)溶液中,通过FSP法制备得到了ASA。当铝质量分数从10%增加到90%,ASA比表面积从377 m2/g降低到182 m2/g。该方法制备的ASA的Brønsted酸强度与分子筛相当。将前体溶液由甲醇/醋酸换成二甲苯,可以将ASA的比表面积提高至241~391 m2/g,且随着铝含量的增加而降低。ASA颗粒粒径在7~17 nm之间,更换溶液对粒径没有明显的影响[27]。
1.7 浸渍法
浸渍法是将Al2O3或前驱体(拟薄水铝石)浸入含有硅前体的溶液中,经干燥焙烧制得ASA。浸渍法操作简单,成本低,但硅易堵塞部分孔道,且ASA表面酸性较弱。Rankin等[28]将γ-Al2O3在Ar气氛中浸渍于含有TEOS的乙醇溶液中。浸渍后样品在真空、60 ℃下干燥,然后在520 ℃下焙烧2 h。制备得到的ASA比表面积为152 m2/g,孔体积为0.47 cm3/g,平均孔径为12.25 nm。亢丽娜等[29]采用等体积浸渍法,将γ-Al2O3浸渍于TEOS的乙醇溶液中,经干燥焙烧后制得一系列不同硅含量的硅铝材料。引入的硅覆盖了部分γ-Al2O3的表面,改变了Al2O3的表面性质。同时,硅的引入堵塞γ-Al2O3的孔道,使得催化剂的孔体积、孔径减小。从稳定性来看,硅的引入提高了载体的水热稳定性,水热处理后催化剂孔结构变化较小。
除上述几种方法外,龙湘云等[30]提出了一种直接制备ASA载体的方法——混捏法。将拟薄水铝石与有机硅或无机硅混合,在挤条机上挤条成型后焙烧,得到ASA载体。通过该方法制备的载体孔集中度高,4~10 nm的孔体积占总孔体积的75%以上。
在石油化工行业,通常需要简单、低成本大批量可控制备ASA材料的方法,因此,中和沉淀法或碳化法成为首选。如果催化剂对杂质含量要求比较高时,则采用醇铝法或溶胶-凝胶法。
2 无定形硅铝材料的酸性研究
2.1 酸性形成机理
单独的Al2O3或SiO2的Brønsted酸性均较弱,而两者形成的复合硅铝材料却有较强的酸性,因而认识ASA材料的酸性形成机理对调变ASA的性能至关重要。对硅铝材料而言,通常认为其酸性是Al3+对氧化硅晶格中的Si4+同晶取代产生的。正常的铝原子是六配位的,当它被强制进入四配位结构时,就会产生一个净负电荷单元。为了提高其稳定性,需要一个阳离子(如质子)来中和,从而形成Brønsted酸位。在高温下,酸性羟基以水的形式脱去,可形成Lewis酸[31]。该理论对于分子筛具有较高的普适性,按照这种思路,ASA材料应该也有类似于分子筛一样的Brønsted酸,但是实际上ASA材料的Brønsted酸强度和酸量均较低[32]。究其原因,是ASA材料中硅铝的复杂分布及无定形的特性,使其很难建立结构和活性之间的相关性。学者们也试图从吸附热、键能等方面对ASA材料酸性弱于分子筛进行解释[7,33]。
在酸性形成机理方面,硅羟基与临近的铝原子之间也可以形成Brønsted酸位点[34-36],这种Brønsted酸通常较弱,ASA中Brønsted酸位点示意如图2所示,其中虚线并不表示共价键,而是用来说明O和Al原子之间比较接近。

图2 ASA中Brønsted酸位点示意
Valla等[37]利用固态核磁表征和密度泛函理论建立了ASA中Brønsted酸位点的模型,如图3所示。在SiO2的空间网状结构中,硅原子被铝原子取代后,硅烷醇的羟基与四配位铝(AlⅣ)之间形成“桥连”结构,从而形成Brønsted酸位点。

图3 ASA中Brønsted酸活性位点模型
Hensen等[38]采用CO吸附红外光谱、吡啶吸附红外光谱、异丙胺程序升温脱附等方法对ASA材料的表面性质、酸性进行了表征。研究表明,ASA材料中存在一些非常强的Brønsted酸位点(Ⅰ类),其浓度一般低于10 μmol/g,还存在浓度为50~150 μmol/g的弱Brønsted酸位点(Ⅱ类),这些位点可能是硅羟基与强Lewis酸Al3+位点相互作用产生的。此外,ASA材料中还存在浓度为200~400 μmol/g的无酸性硅羟基和铝羟基(Ⅲ类)。
铝原子的配位情况有四配位(AlⅣ)、五配位(AlⅤ)和六配位(AlⅥ)3种,其中,AlⅣ与ASA材料的Brønsted酸位点有关,AlⅥ与Lewis酸位点有关。近年来,关于AlⅤ与酸性的关系研究越来越深入。AlⅤ被认为是Al2O3前体脱水过程中原子重排形成的中间配位态。Xu Benjing等[15]通过核磁共振(NMR)和傅里叶变换红外光谱(FTIR)表征发现,当Al2O3中存在一定量的硅可以产生AlⅤ,并且与强酸位点有关。Wang Zichun等[36]采用喷雾燃烧热分解法制备了ASA材料,采用二维核磁共振试验观察到了基于AlⅤ的Brønsted酸位点,同时发现AlⅣ和AlⅤ表现出相似的酸度,即Brønsted酸位点与AlⅣ和AlⅤ有关,这为如何提高ASA材料的酸性提供了启示。Wang Zichun等[27]继续研究发现,与AlⅣ相比,AlⅤ可以显著增强ASA的Brønsted酸性,随着ASA材料中铝含量的增加,AlⅤ占比增加,Brønsted酸位点浓度增加。对这一现象,他们通过NMR和原子探针断层扫描(APT)表征进行了解释。当铝含量增加时,铝原子间平均距离变短,两个相邻的铝中心使得硅烷羟基的电子密度降低,因而酸性变强,可与脱铝分子筛的酸性相当;而具有少量或中等铝含量的ASA中主要存在的为中等酸性位点,且酸性远低于分子筛。
本文作者所在团队通过NMR表征pH摆动法制备ASA材料发现,随着铝含量的降低,AlⅤ的比例逐渐增加,当铝含量在一定范围内时,AlⅣ和AlⅤ对于Brønsted酸的作用接近。这一发现与Wang Zichun等[27]的研究结论存在一定差别。可见,ASA中铝配位情况及变化规律与制备方法密切相关。
2.2 酸性影响因素
不同的制备方法使得硅铝之间的混合程度及相互作用程度各不相同,因而结构和酸性也不同。对于同样的制备方法,不同的反应条件、硅源及加入时机也会影响ASA材料的酸性。
在ASA材料中,Brønsted酸与Lewis酸之间的转换与水分子有关,因此焙烧温度会影响ASA材料的酸性。当焙烧温度提高时,材料中的水分子脱除,Brønsted酸向Lewis酸转化。ASA材料在较低温度下焙烧时主要以Brønsted酸为主,而在高温(900 ℃以上)下焙烧则以Lewis酸为主,在300~600 ℃范围内焙烧时Lewis酸和Brønsted酸共存[39]。
制备原料的不同对ASA材料的性能也有较大影响,杜君臣等[20]考察了硅源对酸性的影响。以硅溶胶为硅源的ASA材料只存在弱酸性位,总酸量同Al2O3酸量相当;而以硅酸钠为硅源的ASA存在弱酸性和弱中酸性活性位,总酸量约是Al2O3酸量的3倍。
唐博合金等[39]研究了ASA材料的酸性与组成含量的关系。随着SiO2含量的增加,Brønsted酸度先增加后减少,在SiO2质量分数70%附近达到最大。Lewis酸度随SiO2含量的增加一直降低。总酸度随SiO2含量的增加先维持不变,而后迅速下降。
王敏朵等[40]通过在成胶、老化、洗涤和成型4个不同制备阶段引入硅源,发现在体相中引入硅源可得到比表面积大、孔分布集中、硅铝分布均匀的ASA材料,但不利于调变材料表面铝的配位状态。而当硅暴露于材料表面时,有利于制备酸性较强的材料。
3 无定形硅铝材料的应用
3.1 加氢裂化
加氢裂化催化剂主要由酸性组分和加氢组分(金属)构成,其中酸性组分是裂解活性的主要来源,通常由载体提供,如分子筛、ASA材料、基质(如Al2O3)等。与Al2O3相比,ASA材料载体的比表面积较大,裂解活性更高,并且与活性组分的相互作用力较弱,因而可提高加氢脱硫(HDS)活性。与分子筛相比,ASA酸性适中,具有更好的中间馏分油选择性[41]。ASA材料具有的酸性还可以促进C—N键断裂,有利于加氢脱氮(HDN)反应。研究表明,在载体中引入质量分数为10%~20%的SiO2,可提高催化剂的HDN活性[39]。
París等[42]以ASA材料为载体,铂或钯为加氢组分,制备了双功能催化剂,用于石蜡的加氢裂化/加氢异构反应。研究发现,铂基催化剂对C22+化合物的加氢裂化更活跃,对中间馏分油的选择性更高,而钯基催化剂催化的产物异构化程度更高。催化剂性能的不同是铂和钯的氢化/脱氢功能性质不同造成的。
Kim等[43]采用沉淀法制备了不同铝含量的ASA材料,负载铂金属后用于催化石蜡加氢裂化生成中间馏分油。石蜡转化率和中间馏分油收率与载体中的铝含量密切相关。随着铝含量的增加,转化率和中间馏分油产率先增加后减小,在硅铝摩尔比为7∶3时存在最大值。
Pereyma等[44]采用70%的Al2O3和30%的ASA为载体制备了Ni-Mo和Ni-W加氢裂化催化剂。蜡油加氢裂化反应表明,以Ni-Mo为加氢组分的催化剂,产物柴油馏分中硫含量较低,而以Ni-W为加氢组分的催化剂,产物柴油馏分中多环芳烃含量较低。
董松涛[45]公布了一种具有高活性的加氢裂化催化剂,将介孔ASA材料与β分子筛等混合挤捏成型,得到多孔载体。该载体具有较大的孔径和孔体积,还具有较高的孔分布集中度。以该载体制备的催化剂具有高的催化活性和中间馏分油选择性。
Li Tao等[46]在四乙基氢氧化铵存在下水热合成了一系列ASA材料,并负载质量分数为0.5%的铂制备成加氢裂化催化剂,用于费-托合成蜡的加氢裂化反应。研究发现,位于外表面的中等强度Brønsted酸位点对活性起着重要作用,Pt/SA-10 催化剂在接近工业装置的反应条件下转化率约为48.8%,对柴油表现出高选择性(78.7%)。Li Tao等[12]还开发了一种具有强酸性的ASA材料并用于正十六烷加氢异构化反应,多支链异构体产率达到43.1%。
3.2 催化裂化
在分子筛未被开发之前,ASA曾被用作催化裂化的主要催化材料。经过半个多世纪的发展,目前催化裂化催化剂主要由活性组分(分子筛)、担体(基质)等组成。ASA作为基质材料时,可以提高催化剂的抗磨损性能、稳定性、活性。
Zhang Dequan等[47]以ASA为催化剂,从木质素衍生的酚类化合物通过催化裂化生产芳烃。研究发现,当ASA中SiO2质量分数为33%时,催化活性最高。活性高的原因是ASA的Lewis酸含量高(168.47 μmol/g)。Hosseinpour等[48]以HY分子筛和ASA为催化裂化催化剂的主要成分,研究其对1,3,5-三异丙苯裂化活性和结焦的影响。与HY分子筛催化剂相比,HY-ASA催化剂具有更高的1,3,5-三异丙苯转化率和较低的积炭量。HY分子筛和ASA表现出较好的协同效应。
3.3 其 他
除用于加氢裂化、催化裂化反应外,ASA材料及其催化剂还可用于有机聚合、脱水、塑料降解等过程中[49]。Xu Jinghua等[50]在ASA材料上负载Ni,用于催化乙烯齐聚反应。随着 ASA中Al2O3负载量的降低,Ni/ASA催化剂的乙烯齐聚活性呈上升趋势,这可能是由于Ni2+物质与ASA的相互作用较弱,更容易演变成有利于乙烯齐聚反应的Ni+物种活性位点。
Wang Zichun等[51]采用FSP法制备ASA材料,并将其用于环己醇脱水和葡萄糖脱水反应。在环己醇脱水反应中,均匀的Brønsted酸强度为环己烯提供了高选择性,并且酸位密度与环己醇转化率之间几乎呈线性相关。在葡萄糖脱水制备5-羟甲基糠醛反应中,Brønsted酸和Lewis酸协同形成了优异的双功能Brønsted-Lewis酸催化剂,5-羟甲基糠醛的产率和选择性随着Lewis酸/Brønsted酸的增加而降低。
Maity等[52]以乙酰丙酮铝或异丙醇铝为铝源,TEOS为硅源制备了ASA,并将其用于塑料降解、CO2制二甲醚等反应。ASA能在较低的温度下(350~450 ℃)有效地将一系列废塑料转化为碳氢化合物,以ASA为载体制备的Cu-Zn-Al/ASA复合催化剂对二甲醚的选择性为79%,表现出优异的CO2转化性能。
Suganuma等[53]将ASA材料用于吸附减压蜡油中的碱性含氮化合物,发现吸附速率符合拟二级动力学,反应主要受大分子扩散控制。ASA的粒径不影响平衡时的吸附量,粒径越小,吸附速率越高。平衡吸附量受极性影响,但不受分子大小的影响,而吸附速率强烈依赖极性和分子大小。通过煅烧再生ASA材料,可实现吸附剂的重复使用。
4 结束语
随着原油重质化和劣质化趋势加深以及炼油向化工转型发展,ASA材料将在石油化工中发挥越来越重要的作用,成为石化行业亟需的高性能材料。ASA材料需在以下3个方向加强研究:①构效关系研究。探究不同结构、不同酸性的ASA催化剂与目标反应物转化率、产物选择性的关系,为ASA材料的结构和酸性改进方向提供指引。②制备工艺的优化。随着“分子炼油”的兴起,需要精准设计并可控制备出符合不同原料油组分特性的ASA材料,改善其对不同原料油的适用性,从而支撑石油化工行业高效、快速、绿色发展。③ASA材料的应用研究。探究ASA在其他领域的应用前景和市场需求,从而为未来的转型发展提供支撑。

