微波加热下表没食子儿茶素对海鲈鱼肌球蛋白氧化的影响
李颖畅,董高缘,崔 蕾,仪淑敏,吕艳芳
(渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州 121013)
海鲈鱼具有较高的营养价值,不仅蛋白质含量高,还含有多种微量元素和不饱和脂肪酸[1]。然而,在水产品热加工过程中,容易造成过氧化,影响蛋白质的功能特性,同时对人体健康产生一定影响。传统的热处理方法存在加热不均匀和蒸煮损失高等问题,影响食品的品质和风味。为了抑制蛋白质的过度氧化,一些研究者通过改变加热方式和添加食品添加剂等方式抑制蛋白质过度氧化[2]。微波加热是一种非直接加热且快速的烹饪方法。微波可以通过极性分子的快速振动,均匀地转换热能,减少氧化程度和营养元素损失[3]。肌球蛋白是肌肉中的主要蛋白,占鱼肉总蛋白含量的30%~36%,也是横纹肌细胞中表达量最丰富的蛋白,在鱼肉功能、营养和感官特征方面发挥着重要作用[4]。茶多酚具有抗氧化活性,被广泛用于食品加工中。表没食子儿茶素(EGC)是茶多酚的中有效成分之一。关于EGC 在热加工过程中是如何对肌肉中的蛋白质起到保护作用的,目前还没有明确的解释。本文研究微波加热下EGC 与海鲈鱼肌球蛋白间的相互作用,EGC 对海鲈鱼肌球蛋白的影响,并利用分子动力学模拟辅助解释EGC 对蛋白质的抗氧化机制。
1 材料与方法
1.1 材料与试剂
海鲈鱼购于中国辽宁省锦州市林西路水产市场,海鲈鱼的质量为(1.65±0.11)kg。活体运输至实验室,宰杀后去皮取背部肌肉,并于4 ℃下贮存。
苯甲基磺酰氟(PMSF)、E-64,上海碧云天生物技术有限公司;β-巯基乙醇,上海麦克林生物有限公司;EGC(>97%),上海源叶生物科技有限公司;2,5-二甲基苯甲醛(DNPH)、5,5'-二硫代双(2-硝基苯甲酸)(DTNB),上海阿拉丁生化科技股份有限公司;2,4,6-三硝基苯磺酸(TNBS),Sigma-Aldrich 公司。BCA 蛋白质含量测试盒、SDS-PAGE制胶试剂盒,北京索莱宝有限公司。
1.2 仪器与设备
XE-70 原子力显微镜(AFM),韩国帕克股份有限公司;Chirascan V100 圆二色光谱仪,英国应用光物理公司上海代表处;F-7000 荧光分光光度计,日立科学仪器(北京)有限公司。
1.3 试验方法
1.3.1 样品制备和处理 肌球蛋白的提取参考Dai 等[5]的方法。肌球蛋白-EGC 液制备方式如下:肌球蛋白沉淀溶解于20 mmol/L Tris-HCl(0.5 mol/L NaCl,pH 7.0),并与不同质量浓度的EGC溶液按照比例混合均匀,蛋白最终质量浓度10 mg/mL,EGC 的最终质量浓度为20,40,60 μg/mL,总体积为50 mL。对照组为仅添加超纯水的肌球蛋白液。50 mL 的肌球蛋白-EGC 液在微波炉中(400 W)加热90 s,加热完成后立即放入冰浴中冷却,并放入4 ℃冰箱中备用。
1.3.2 蛋白羰基含量的测定 蛋白质羰基含量参照于小番[6]的方法测定。
1.3.3 蛋白总巯基含量的测定 称取2.00 g 碎鱼肉与10 mL,50 mmol/L 磷酸钠缓冲液(pH 6.0)混合、均质,并离心10 min(12 000 r/min,4 ℃),取上清液测定蛋白质质量浓度,控制在5 mg/mL 以内。总巯基含量测定参考Jiang 等[7]的方法。
1.3.4 二聚酪氨酸含量的测定 调整肌球蛋白-EGC 中的蛋白质量浓度为1 mg/mL。测定样品的荧光发射光谱,发射波长为420 nm,激发波长为325 nm,发射和激发狭缝宽度均为2.5 nm。
1.3.5 肌球蛋白内源荧光和同步荧光强度的测定荧光测定参照Zhang 等[8]和Wu 等[9]的方法。将样品蛋白的质量浓度调整为0.5 mg/mL。内源荧光测量条件为λex为295 nm,λem为310~510 nm。同步荧光:λem为260~510 nm,Δλ(Δλ=λem-λex)设置为15 nm 和60 nm,分别代表酪氨酸和色氨酸的微环境。所有激发和发射狭缝宽度设置为2.5 nm。
1.3.6 肌球蛋白二级结构的变化 将样品蛋白的质量浓度调整至0.2 mg/mL,圆二色谱测定参考Xu[10]等的方法。测试条件:1 mm 比色皿,扫描波长为195~260 nm,扫描速度为60 nm/min。
1.3.7 蛋白微观结构的测定 调整样品的蛋白质量浓度为20 μg/mL。样品滴在无菌干净的云母片上,4 ℃烘干。干燥后的样品用超纯水洗涤3 次,去除多余的盐分。扫描范围为10 μm×10 μm。
1.3.8 肌球蛋白与EGC 分子对接及分子动力学模拟 同源建模及模型评估方法参考Zhang 等[11]的方法。模板选自NCBI 数据库(https://www.ncbi.nlm.nih.gov/),NCBI 参考序列为XP_028442143.1。将XP_028442143.1 的目标模板放入SWISSMODEL(https://swissmodel.expasy.org/),选取相似度30%以上的模板建立相应的3D 结构。通过SAVES6.0(https://saves.mbi.ucla.edu/)中WITHCHECK、PROCHECK、ERRAT、PROVE 和VERIFY 3D 内嵌程序对所选模板构建三维结构的适用性和合理性进行评价。选择质量评分最高的肌球蛋白3D 结构(PDB ID:6YSY.1)进行分子模拟。EGC(Pubchem CID:72277)的三维结构由Pub-Chem(https://pubchem.ncbi.nlm.nih.gov/)获取。
肌球蛋白和EGC 之间的相互作用由BIOVIA Discovery studio 2017 R2 客户端模拟。6YSY.1 在对接之前进行能量优化,去除水加氢,EGC 则进行能量最小化,采用CDOCKER 方法对接。肌球蛋白-EGC 复合物的加热稳定性在Gromacs 2019.4程序中进行模拟。分子动力学模拟的参数参考Harish 等[12]和Zhang 等[11]的试验参数。
1.3.9 数据分析 采用Origin 2022 和SPSS 25.0进行统计学分析和数据处理,结果均以平均值±标准差表示。
1.2.4 基因型分析 研究对象均在空腹状态下抽取静脉血,放置抗凝管抗凝,分离血液的白细胞层。用试剂盒提取血白细胞的DNA(试剂盒购自美国NEB公司),DNA提取后置低温冰箱(-80℃)保存备用。全部标本收齐后用PCR-LDR方法进行ALDH2 Glu487Lys基因多态分析,基因型分为野生型纯合子(G/G)、变异型纯合子(A/A)及杂合子基因型(G/A)。采用专门软件进行数据分析。
2 结果与分析
2.1 肌球蛋白羰基含量变化
如图1 所示,微波前,对照组的羰基含量为0.76 nmol/mg pro,EGC 处理组的羰基含量与对照组无显著差别(P>0.05)。微波加热后,不同处理肌球蛋白的羰基含量显著升高,微波加热后对照组的羰基含量达到最高,为5.60 nmol/mg pro,这表明微波加热诱导蛋白发生氧化,蛋白质的氧化保护作用被打破,活性氧(ROS)、酶、游离铁等促氧化成分增加[13-14]。相比对照组,EGC 处理组的羰基含量显著降低(P<0.05),而且随EGC 质量浓度的增加而减少。EGC 延缓羰基含量升高的原因可能是EGC 的羟基与肽链的羰基发生反应,形成氢键,减少羰基化反应。另一方面,EGC 具有抗氧化能力,可保护氨基酸侧链,防止其氧化。EGC 能通过非共价作用和共价作用与肌球蛋白形成更为稳定的化合物,抵抗微波加热带来的氧化攻击。

图1 EGC 对肌球蛋白羰基含量的影响Fig. 1 Effects of EGC on carbonyls content of myosin

图2 EGC 对肌球蛋白的总巯基含量的影响Fig. 2 Effects of EGC on total sulfhydryl content of myosin
2.2 肌球蛋白总巯基变化
总巯基的含量反映了蛋白质的氧化程度,游离巯基在蛋白质的稳定构象中起着重要作用。巯基的氧化可分为2 种类型:可逆氧化主要形成二硫键,不可逆氧化主要形成磺酸和次磺酸等物质[15]。对照组微波处理前总巯基含量显著(P<0.05)高于微波处理后总巯基含量。微波处理前,对照组总巯基含量最高,为279.49 nmol/mg pro。随EGC 质量浓度的增加,总巯基含量减少。微波处理前巯基基团的下降可以解释为EGC 的羟基通过非共价键和共价键与蛋白质巯基基团发生相互作用,降低了总巯基含量。微波处理后,对照组总巯基含量显著下降,可能是因为微波诱导肌球蛋白巯基发生氧化,而EGC 组总巯基含量无显著性变化,是因为EGC 的羟基通过非共价键和共价键与蛋白质巯基基团发生相互作用。
2.3 二聚酪氨酸含量的变化
酪氨酸易受到ROS 的攻击而形成酪氨酸自由基,而酪氨酸自由基会与另一种酪氨酸自由基反应生成二聚酪氨酸,并继续从巯基基团中夺取氢原子,还会促进蛋白质中二硫键的生成。二聚酪氨酸通常代表酪氨酸的损失和蛋白质的氧化聚集程度[16]。由图3 可知,微波后的二聚酪氨酸相对含量整体上显著高于微波前的二聚酪氨酸含量,提示微波加热会促进酪氨酸形成二聚体[17]。微波加热后,与对照组相比,添加EGC 的肌球蛋白的二聚酪氨酸含量显著(P<0.05)低于对照组,且与EGC 的质量浓度呈负相关关系,说明EGC 降低了体系中氧化水平,阻止自由基攻击酪氨酸残基,减少了二聚酪氨酸的生成。同时,EGC 可以有效保护巯基,阻止酪氨酸自由基从巯基基团中夺取氢原子,阻止二聚酪氨酸的生成。

图3 EGC 对肌球蛋白二聚酪氨酸的影响Fig. 3 Effects of EGC on dityrosine content of myosin
2.4 肌球蛋白内源荧光和同步荧光的变化
内源荧光可以反映肌球蛋白的三级结构状态,同步荧光常用于了解酪氨酸和色氨酸周围微环境的变化。由图4a 可知,微波之前,EGC 质量浓度的增加导致内源荧光强度降低,这与Zhao 等[18]报道的结果一致,即胶原蛋白和酪蛋白与单宁酸和没食子酸结合后,蛋白出现荧光猝灭现象。EGC因含有大量的羟基易与蛋白质相互作用,致使荧光基团周围的微环境极性增强,导致荧光衰减和猝灭[10]。由图4b 可知,微波处理后,内源荧光强度显著增强。内源荧光强强度的升高可能是因为微波加热可以使肌球蛋白展开,暴露更多含有荧光基团的氨基酸残基导致其荧光强度升高[19]。随着EGC 质量浓度的升高,荧光强度降低,说明EGC有效保护了肌球蛋白的三级结构稳定性,阻止肽链过度伸展和蛋白质的热解。

图4 不同质量浓度的肌球蛋白-EGC 荧光特性的变化Fig. 4 Changes of different mass concentrations EGC-myosin in fluorescence characteristics
2.5 肌球蛋白二级结构变化
海鲈鱼肌球蛋白中α-螺旋含量为72.50%,β-折叠含量为3.80%,β-转角含量为11.00%,无规则卷曲含量为11.70%(表1)。α-螺旋结构是肌球蛋白中占主导地位的二级结构,维持着肌球蛋白的稳定性。微波加热前,随着EGC 质量浓度增加,α-螺旋结构含量呈先上升后下降趋势,添加60 μg/mL EGC 组肌球蛋白的α-螺旋显著下降。β-折叠、β-转角和无规则卷曲随着EGC 质量浓度增加呈先降低后上升趋势。酚类物质可以通过氢键、疏水相互作用和静电相互作用增强蛋白质α-螺旋含量和稳定性[20-21]。60 μg/mL EGC 降低二级结构中α-螺旋含量,说明高质量浓度的多酚可能会促使蛋白质肽链发生过度伸展并发生了空间的重排,降低了肌球蛋白二级结构的稳定性。微波加热后,对照组和EGC 处理组的α-螺旋降低,而β-折叠、β-转角和无规则卷曲含量增加。随着EGC质量浓度是升高,α-螺旋含量先上升后下降趋势,20 μg/mL EGC 组的α-螺旋含量高于对照组。Al-Shabib 等[22]的研究中也发现10 μmol/L 芦丁相较于5 μmol/L 反而降低了β-乳球蛋白的α-螺旋含量。酚类物质质量浓度对蛋白质二级结构的有序性和稳定性同样有很大的影响。

表1 不同样品肌球蛋白的二级结构含量的变化Table 1 Changes of secondary structure content of myosin in different samples
2.6 蛋白微观结构变化
通过原子力显微镜观察蛋白质的微观形态,可以在不破坏样品的情况下反映蛋白质的表面形态和空间上颗粒大小分布。图5 是肌球蛋白与不同质量浓度的EGC 结合后其微观结构的变化。天然的肌球蛋白一般以无序单体和微聚集体的形式分布在载体表面,其最大峰高不超过40 nm。随着EGC 质量浓度的升高,蛋白层的厚度明显降低,EGC 处理组的肌球蛋白小聚集体变得细密、更分散,且最大峰高降低至12~40 nm,并均匀分布在载体表面。此外,60 μg/mL EGC 处理组的肌球蛋白形成大聚集体,且峰高升至50 nm,说明高质量浓度的EGC 容易引起肌球蛋白的过度聚集和交联,对蛋白质的微观结构有影响。

图5 肌球蛋白-EGC 微观结构变化Fig. 5 Microstructural changes of EGC-myosin
微波处理后,大量的肌球蛋白聚集成更大的肌球蛋白簇,说明微波加热诱导可促进肌球蛋白向高度聚集和无序状态转变。对照组的肌球蛋白形成直径最大,形成峰值最高的蛋白聚集体(300 nm),且蛋白分布在载体表面粗糙且不均匀。与对照组相比,随着EGC 质量浓度的升高,肌球蛋白聚集体直径变小,峰值变低(120~160 nm),表面逐渐变得平滑。然而,60 μg/mL EGC 处理过的肌球蛋白,重新出现不均匀的团块,并且彼此之间距离较近,分布较密集,载体表面的粗糙度上升。先前的研究已经证明茶多酚可以通过释放亚基降低肌原纤维的高度和直径;然而,随着茶多酚含量的增加,它可以附着在肌原纤维上,增强分子间的相互作用,使其再次聚集[23]。EGC 的加入虽然不能完全阻止肌球蛋白的热聚集,但也显著降低了肌球蛋白的氧化聚集程度。
2.7 分子动力学模拟EGC-肌球蛋白稳定性分析
均方根偏差(Root mean square deviation,RMSD)表示某一时刻的构象与目标构象所有原子偏差的加和,是衡量体系是否稳定的重要依据。从图6a 可以看出,在电场和温度的作用下,相对于未微波加热条件下的纯肌球蛋白体系的RMSD值,微波加热条件的纯肌球蛋白、肌球蛋白-EGC复合物体系的RMSD 值在5 ns 之后就出现明显地升高,蛋白结构处于一个不稳定的状态。在0~100 ns 时间未施加微波电场和升温条件的肌球蛋白的RMSD 值为0.319±0.067,而加微波电场和升温条件的肌球蛋白、肌球蛋白-EGC 复合物在0~100 ns 时间段的RMSD 值分别为(0.458±0.114)和(0.389±0.80),从整个模拟时间体系来看,肌球蛋白-EGC 结构稳定性大于肌球蛋白稳定性,这说明肌球蛋白与EGC 的复合物在微波加热下结构更加稳定。
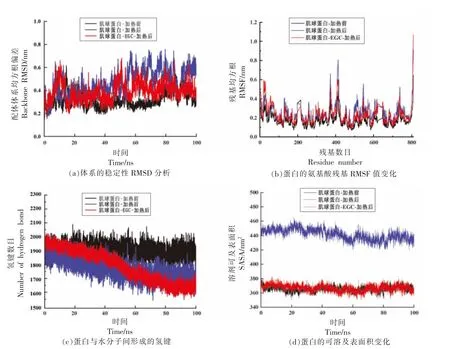
图6 肌球蛋白-EGC 分子动力学模拟Fig. 6 Molecular dynamicssimulation of EGC-myosin
图6b 为蛋白模拟前、后蛋白氨基酸残基均方根(Root mean square fluctuation,RMSF)的涨落变化,该值表示蛋白质氨基酸残基的柔性大小和蛋白质原子的平均迁移率,可以了解到具体的氨基酸残基的灵活性的变化。从图中可以看出,施加升温电场的肌球蛋白、肌球蛋白-EGC 体系的RMSF 值在大部分序列上是增加的,且都高于天然的肌球蛋白。RMSF 值的顺序为:升温电场下的肌球蛋白>肌球蛋白-EGC>天然肌球蛋白,说明肌球蛋白-EGC 在升温电场下稳定性更高,氨基酸残基的迁移率更小。施加升温电场的肌球蛋白在0~50,120~180,260~280,380~420 位和500~580 位残基处出现波动较大;肌球蛋白-EGC 则是在0~50,380~400 位和500~580 位残基出现波动较大。EGC 处理后的肌球蛋白的残基相较于施加升温电场的对照组变化较小,结构稳定。
图6c 为蛋白与模拟体系中溶剂水分子之间形成的氢键数量随时间的变化,氢键是稳定蛋白质二级结构的主要的作用力,对α-螺旋和β-折叠有决定性作用;同样的,氢键还会影响蛋白质之间的非共价相互作用。在整个100 ns 的模拟时间内,未施加电场和温度的肌球蛋白与周围的水分子形成大量的氢键,且在整个过程中氢键数量维持同一个水平上,无减少的趋势。升温电场下,肌球蛋白、肌球蛋白-EGC 复合物体系的氢键数量下降,稳定性也随之下降,说明升温电场会破坏肌球蛋白质分子间的氢键相互作用,从而会迫使蛋白质肽链伸展,暴露出疏水基团,减少与水分子之间的相互作用。在80 ns 后,升温电场下的氢键含量下降变缓,可能是因为此时升温对蛋白质氢键的破坏作用与电场促使蛋白质多肽链之间碰撞产生新的氢键的形成动态平衡,所以氢键含量较为稳定。80 ns 后,与升温电场下的对照组相比,肌球蛋白-EGC 的氢键含量曲线的收敛性要小,表明肌球蛋白与EGC 之间的复合物在升温电场中氢键的断裂和生成的波动较小,结构较为稳定。
图6d 为蛋白的可溶及表面积随时间的变化。可溶及表面积可以反映体系中溶剂所能触及到的面积大小。值越大,疏水性基团暴露出来的越多,结构致密性越差,与水的接触面积越高。加热前对照组与加热后肌球蛋白-EGC 的可溶及表面积变化趋势和值没有太大的差异,都明显低于加热后对照组的值。未加电场和温度时,肌球蛋白的可溶及表面积维持较低水平,是因为此时肌球蛋白结构稳定,多肽链未伸展,与水分子接触面积小。随着温度的升高和电场的作用,肌球蛋白的可溶及表面积增加,是由于微波电场致使稳定蛋白质分子三级结构的相互作用被破坏,蛋白质结构展开暴露出内部疏水腔体,增加与水的接触面积。升温电场下的肌球蛋白-EGC,可溶及表面积更接近于天然结构,可能是由于氨基酸残基侧链与EGC 结合后,维持了结构的稳定性,氨基酸残基灵活性变化较小,蛋白质肽链未舒展完全。此外,因为EGC进入了肌球蛋白的疏水性腔体之间,形成了氢键和疏水相互作用,所以在一定程度上稳定了肌球蛋白的结构,从而使其在升温电场下的变化不如对照组的变化大,即EGC 与肌球蛋白结合之后,提升了其在微波升温的条件下结构的稳定性。总的来说,肌球蛋白会因为振荡电场升温环境失去必要的二级结构从而稳定性降低,而与EGC 结合之后,可以有效地维持蛋白质在振荡电场升温环境下肌球蛋白的稳定性。
2.7.2 分子动力学模拟微波电场下肌球蛋白与EGC 结合能分析从图7 可知,小分子配体与Lys599、Asn600 形成氢键,氢键的距离为1.9 Å 和1.7 Å。此外,小分子配体与Leu270、Ile481、Val650、Leu476 的碳原子形成疏水作用,距离分别为4.2,5.6,3.6,4.1 Å。

图7 肌球蛋白-EGC 分子对接图Fig. 7 Molecular docking of EGC-myosin
图8 为肌球蛋白与EGC 之间结合自由能的分解图,包括范德华力(van der Waal energy)、静电能(Electrostatic energy)、极性溶剂化能(Polar solvation energy)以及疏水作用(SASA energy)。由图8 可知,肌球蛋白与EGC 之间的范德华力为-174.299 kJ/mol,静电能为-65.998 kJ/mol,极性溶剂化能为157.656 kJ/mol,疏水作用为-16.380 kJ/mol,总的结合能为-99.021 kJ/mol。范德华作用力和静电作用力为两者之间的主要作用力,在结合能的贡献上占据主要地位。从表2 可知,对配体结合由重要影响的氨基酸残基包括Leu-270、Leu-476、Val-650 等。

图8 EGC 与蛋白之间的相互作用能量分解Fig. 8 Energy decomposition of interaction between EGC and myosin
3 结论
1)在微波加热场中,肌球蛋白与EGC 结合显著延缓肌球蛋白的羰基和二聚酪氨酸含量升高;延缓了总巯基含量的降低,减少微波热诱导的蛋白质聚集和交联。
2)与EGC 结合后的肌球蛋白荧光强度随EGC 质量浓度升高而降低,产生荧光猝灭。微波加热后,肌球蛋白荧光强度升高,肌球蛋白-EGC 延缓了荧光强度升高,EGC 稳定了肌球蛋白的空间结构。
3)微波加热之前,一定质量浓度的EGC 可以促进肌球蛋白的二级结构有序性和稳定性。微波加热后,仅20 μg/mL EGC 保留较多的α-螺旋,保护了蛋白质二级结构的稳定性。与EGC 结合后肌球蛋白的聚集体明显变小,分散均匀、表面逐渐变光滑。
4)分子对接和分子动力学模拟技术,模拟肌球蛋白-EGC 体系在微波升温电场下的稳定性(RMSD、RMSF、氢键和SASA)以及结合能的分析,发现EGCG 和EGC 都能改善肌球蛋白的在微波升温电场中的稳定性。

