酿酒酵母对浓香型白酒酒醅微生物群落结构及功能的影响
马世源,李子健,2,罗惠波,2,孙跃鹏,李 津,黄 丹,2*
(1 四川轻化工大学生物工程学院 四川自贡643000 2 酿酒生物技术及应用四川省重点实验室 四川自贡643000 3 宜宾今良造制酒有限公司 四川宜宾 644000)
浓香型白酒在中国是最受欢迎的白酒,具有窖香浓郁、口感柔和甘冽、回味悠长等特点[1]。浓香型白酒的酿造包括蒸煮、拌曲、酒醅密封发酵、蒸馏、贮存、勾调等工序[2]。在白酒酿造过程中,酒醅窖内发酵是最重要的过程。由于浓香型白酒酿造过程是开放式发酵,因此不同来源的微生物相互作用、此消彼长,形成具有酿造功能的微生物菌群,并利用底物产生多种代谢物,包括醇类、酯类、酸类、醛酮类等,它们是白酒中风味物质的直接来源[3]。
添加功能菌是提高酒醅中挥发性风味物质的一种常见的方式。黄晓宁等[4]将两株高产淀粉酶和蛋白酶能力的芽孢杆菌用于清香型白酒发酵过程,使得酒醅中4-乙基-2-甲氧基苯酚、辛酸乙酯、3-甲基丁酸乙酯、四甲基吡嗪等风味物质的含量升高。杨阳等[5]通过向浓香型酒醅中添加贝莱斯芽孢杆菌,提高了己酸和己酸乙酯的含量。王晓丹等[6]在酱香酒醅中添加德巴利酵母,增加了酒醅中的多元醇含量。
然而,酒醅在混菌体系下的发酵过程中,代谢物的产生是以微生物组的形式实现的,单个物种的增加会扰动整个微生物群落结构,这导致微生物群落的代谢难以预料[7],甚至导致某些目标代谢物的含量降低[8-9]。之前的酒醅微生物研究中,有关微生物与酒醅微生物群落的互作以及对代谢功能的扰动研究较少。此外,酿酒酵母是浓香型白酒中最重要的功能菌[10],其具有产醇、产酯等多种重要功能[11],然而其对酒醅微生物组的影响鲜有报道。本研究以酿酒酵母为对象,在实验室条件下实现酒醅固态发酵。基于高通量测序、顶空固相微萃取气相色谱-质谱联合用技术(HS-SPME-GC-MS)、随机森立机械学习算法、共现性网络模型、PICRUST2 功能预测、通路富集研究酿酒酵母对酒醅微生物生态网络、挥发性代谢物、群落功能的扰动作用。
1 材料与方法
1.1 材料与方法
1.1.1 样品和主要试剂 由浓香型白酒酒醅中分离筛选的1 株酿酒酵母(Saccharomyces cerevisiae Y2)。本研究用酒醅、黄水、大曲均来自四川省宜宾市某浓香型白酒酒厂。
乙酸正戊酯(色谱纯级),安捷伦科技(中国)有限公司;乙醇、异丙醇(均为分析纯级),成都科隆化学品有限公司;土壤试剂盒,美国Omega 公司。
1.1.2 主要仪器 Illumina MiSeq 高通量测序平台,美国Illumina 公司;5975B-7890A 气相色谱-质谱联用仪,安捷伦科技(中国)有限公司;50/30 μm VB/CAR on PDMS 萃取头,上海安谱实验科技股份有限公司。
1.2 方法
1.2.1 酒醅发酵试验 在实验室条件下,依据浓香型白酒发酵工艺进行发酵试验[2],发酵试验流程如图1 所示。取某酒厂生产线上拌曲后的入窖酒醅,分装至灭菌后的磨口瓶中,每瓶500 g。分别加入酒醅质量2%的黄水,试验组加入酒醅质量1%的浓度为107CFU/mL 的菌液。空白组补足相应水分。密封后放入培养箱中发酵,依据实际生产过程窖内温度变化规律设置培养箱温度,空白组15瓶,试验组15 瓶。取发酵的第0,9,16,23,40 天的样品进行后续分析。空白组标记为K,试验组标记为S。

图1 酒醅发酵试验流程图Fig. 1 Flow chart of fermentation experiment of fermented grains
1.2.2 酒醅总DNA 提取 酒醅DNA 提取使用土壤试剂盒,混合后经核酸浓度仪检测DNA 浓度,采用琼脂糖凝胶电泳检测DNA 条带长度,合格后取100 μL DNA 样品置于-80 ℃保存。
1.2.3 PCR 扩增与测序 细菌16S rRNA 基因的高变区V3-V4 用引物对338F(5'-ACTCCTACGGGAGGCA GCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3'),以及内部转录间隔(ITS)真菌基因区域用引物对ITS1F(5'-CTGGTCATTTAGAGGAAGTAA-3')和2043R(5-GCT GCGTTCTTCATCGATGC-3')进行扩增。
PCR 反应条件:98 ℃2 min;98 ℃15 s,55 ℃30 s,72 ℃30 s,29 个循环;72 ℃5 min。PCR 扩增产物通过1%琼脂糖凝胶电泳检测其浓度及片段完整性。
合并纯化的扩增子,并根据标准方案在Illumina Nova Seq PE300 平台上通过配对末端测序进行分析。
1.2.4 酒醅挥发性代谢物的提取与检测 称取3 g 酒醅样品于顶空瓶中,加入2 g NaCl,20 μL 内标物(乙酸正戊酯),50 ℃平衡5 min,插入50 μm/30 μm VAB/CAR/PDMS 固相微萃取头,萃取45 min,解析3.5 min[12]。
气相色谱条件:DB-WAX 毛细管色谱柱(60 m×0.25 mm×0.25 μm);进样口温度250 ℃,不分流进样;升温程序:起始温度50 ℃,维持2 min,然后以4 ℃/min 升温至230 ℃,维持5 min;氦气以1 mL/min 的恒定流速作柱载气。
质谱条件:电子电离源(Electron ionization,EI),电子能量70 eV,离子源温度230 ℃,四极杆温度100 ℃,恒压10 Pa,全扫描。
1.2.5 数据处理与分析 使用fastp(version 0.20.0)软件对原始测序序列进行质控[13],使用FLASH[14](version 1.2.7)软件进行拼接。使用UPARSE[15]软件(version 7.1),根据97%[16]的相似度对序列进行OTU 聚类并剔除嵌合体。利用RDP classifier[17](version 2.2)对每条序列进行物种分类注释。随机森林模型的构建使用R 软件(v.3.6.1)random-Forest 包。使用igraph R 包(v.1.2.6)构建共现性网络。使用PICRUSt2 软件包,基于16S rRNA序列和京都基因与基因组百科全书(KEGG)数据库对不同样本进行功能预测。PLS-DA 用于建立模型,使用SIMCA-P 13 软件区分样品和挥发性代谢物。使用clusterProfiler 包进行富集分析,使用pathview 包进行代谢途径整合和可视化。
2 结果与分析
2.1 酿酒酵母对微生物群落结构的影响
采用高通量测序技术分析发酵过程中微生物群落结构的变化,发现试验组微生物群落结构较空白组出现较大改变。细菌群落的变化如图2a 所示,发酵第8 天,空白组的优势微生物为乳酸杆菌属(Lactobacillus)和醋酸杆菌属(Acetobacter),而试验组细菌群落几乎完全被乳酸杆菌属占据。随着发酵的进行,试验组与空白组的乳酸杆菌属均呈现不同程度的下降,空白组中的醋酸杆菌属在发酵过程中持续存在并保持一定的相对丰度,而试验组中醋酸杆菌的相对丰度始终很低。此外,在发酵过程中类芽孢杆菌属(Paenibacillus)在试验组的相对丰度也低于空白组。真菌群落的变化如图2b 所示,空白组未分类曲霉菌科(unclassified_f_Aspergillaceae)的相对丰度在第8 天急剧下降,曲霉属(Aspergillus)的相对丰度迅速上升,之后的发酵过程中,其相对丰度在小范围内波动。而试验组中,随着发酵的进行未分类曲霉科仍保持较高的相对丰度。此外,较空白组而言,发酵过程中酵母属(Saccharomyces)、热子囊菌属(Thermoascus)、未分类曲霉科的相对丰度明显增高,而曲霉属、伊萨酵母属(Issatchenkia)的相对丰度明显降低。因此,酿酒酵母的生物扰动改变了较多微生物的相对丰度。这是由于微生物间存在多种互作关系[18],生物扰动改变了群落中微生物间原有的关系,导致部分微生物的生长受到群落中其它微生物的抑制或促进,进而使发酵过程中部分微生物的相对丰度发生较大改变。

图2 属水平上试验组与空白组细菌(a)、真菌(b)群落组成变化Fig. 2 Changes in bacterial(a)and fungal(b)community composition between the experimental group and the blank group at the genus level
为进一步探究试验组与空白组间微生物群落的差异,基于随机森林机械学习算法对其进行分类预测。如图3a,3b 所示,试验组与空白组细菌群落和真菌群落在属水平上具有显著的差异。如图3c,3d 所示该模型预测了对试验组与空白组分类具有重要贡献的微生物,并依据其重要性对其进行排序。为保证预测结果的准确性,基于十折交叉验证对该模型进行检验,其结果如图3e,3f 所示,细菌群落重要性排名前5 和真菌群落重要性排名前31 的微生物预测结果具有较高的准确性。依据其重要性值,筛选细菌群落排名前5,真菌群落排名前15 的微生物作为生物标志物,即:醋酸杆菌属、湖沉积杆菌属(Limnobacte)、类芽孢杆菌属、乳酸杆菌属、不动杆菌属(Acinetobacter)可作为细菌群落的标志微生物。酵母属、梗孢酵母属(Sterigmatomyces)、节担菌属(Wallemia)等15 种真菌可作为真菌群落的生物标志物。这些生物标志物的相对丰度在试验组和空白组中具有较大的差异,其对试验组与空白组的分类具有重要贡献,因此它可反映酿酒酵母对酒醅微生物群落结构的影响。生物标志物中较多属于酵母菌目(Saccharomycetales)和曲霉科(Aspergillaceae),酵母菌目能够参与底物的糖化、酯类物质的合成以及酒精发酵[19-20],而曲霉能够产生广泛的水解酶,用于淀粉糖化、蛋白质水解和类黄酮的形成[21-22],进而产生大量的次生代谢物。酿酒酵母在改变酒醅微生物组成的同时,也可能导致微生物群落代谢的改变。
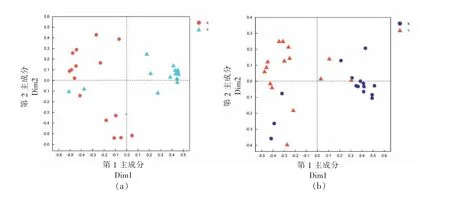
图3 基于随机森林分析的细菌群落(a)和真菌群落(b)的样本分布图、细菌群落(c)和真菌群落(d)的重要性特征图、细菌群落(e)和真菌群落(f)预测结果的十折交叉验Fig. 3 Sample distribution map of bacterial community(a)and fungal community(b)based on random forest analysis,importance map of bacterial community(c)and fungal community(d),10-fold cross-validation of bacterial community(e)and fungal community(f)prediction results
2.2 酿酒酵母对酒醅微生物生态网络的影响
部分物种的变化在一定程度上影响整个微生物群落。为研究酿酒酵母对发酵过程中微生物间互作以及群落稳定性的影响,构建试验组与空白组的共现性网络模型,计算模型的拓扑性质。如图4a,4b 所示,空白组共网络模型中,共有215 个节点,1 868 条边,正相关占比76.71%,负相关占比23.29%。试验组的微生物共现性网络共有201 个节点,2 263 条边,正相关比例占85.64%,负相关占比14.36%。酿酒酵母的扰动导致共现性网络模型中的伽玛变形杆菌纲(Gammaproteobacteria)和酵母菌纲(Saccharomycetes)、杆菌纲(Bacilli)所占的比例增加,而伞菌纲(Agaricomycetes)、座囊菌纲(Dothideomycetes)、粪壳菌纲(Sordariomycetes)的比例下降,这说明共现性网络模型中组成成分发生改变。试验组的边数、正相关性比例,平均度、平均加权度、图密度、平均聚类系数均大于空白组;负相关比例、网络直径、模块化、平均路径长度试验组均小于空白组。这些结果说明试验组微生物群落间的相互关系更加复杂,网络中微生物被共享程度更高,种间相互作用的传递性更强。综上,试验组微生物群落的复杂程度高于空白组,这表明当群落中的菌受到外部影响时,试验组能够更有效、快速地将这些影响传递至其它生物。这些性质导致试验组的微生物群落生长、繁殖、代谢更加旺盛,更有利于底物的转化与利用[23]。然而当酒醅发酵环境发生变化时,这种因环境变化导致的影响会在复杂度更高的试验组中更快地传递,造成更大的影响[24],因此,试验组的微生物群落稳定性相对空白组更低。综上所述,酿酒酵母造成的扰动促进了酒醅微生物在发酵过程中的生长和代谢,而降低了其应对环境变化的能力。

图4 空白组(a)与试验组(b)的共现性网络分析Fig. 4 Co-occurrence network analysis of blank group(a)and experimental group(b)
2.3 酿酒酵母对酒醅中挥发性代谢物的影响
采用HS-SPME-GC-MS 在酒醅中共检出65种挥发性代谢物。如图5 所示,乙酸乙酯、乙酸、正己酸乙酯、己酸、异戊醇、苯乙醇在试验组和空白组中均具有较高的浓度。这些挥发性代谢物,在第0 天的浓度较低,随着发酵的进行,其浓度均逐渐增大,绝大多数挥发性代谢物在第23 天达到最高浓度。此外,乙酸乙酯、乳酸、异戊醇、苯乙醇、辛酸乙酯、十六酸乙酯、2,3-丁二醇等物质在发酵结束时,试验组的浓度均高于空白组。这些挥发性代谢物能够赋予酒体的香气,对浓香型酒体风味的形成具有较大贡献[25]。综上,酿酒酵母的生物扰动在导致酒醅中较多挥发性代谢物的浓度增加的同时,也会影响白酒酒体中部分呈香物质的含量。

图5 发酵过程中挥发性风味物质变化Fig. 5 Changes of volatile flavor compounds during fermentation
为进一步研究酿酒酵母对挥发性代谢物的影响,对试验组和空白组发酵过程中酒醅挥发性代谢物组分进行PLS-DA 分析,如图6a 所示。随着发酵的进行,空白组与试验组样本点的距离逐渐增加,即糟醅中挥发性代谢物的组成差异逐渐增大。这说明试验组与空白组两个不同的微生物群落发生不同的代谢过程,随着发酵的进行两组的挥发性代谢物的差异进一步扩大。此外,基于VIP值计算试验组与空白组挥发性代谢物的差异,结果如图6b 所示,试验组与空白组酒醅中乙醛、异戊醇、对甲苯酚、苯乙醇等18 种挥发性代谢物存在较大差异(VIP>1)。这些差异代谢物绝大多数是酯类和醇类,是浓香型白酒中重要的香气物质[25]。这些酒醅中重要的挥发性风味物质含量及比例是决定酒醅质量的关键,在一定程度上会导致试验组和空白组酒醅的品质差异。

图6 发酵过程酒醅挥发性代谢物差异分析Fig. 6 Differential analysis of volatile metabolites in fermented grains during fermentation
2.4 差异代谢物与生物标志物的关系
酒醅中微生物主导挥发性风味物质的产生。为探究导致试验组与空白组间差异代谢物产生的生物因素,构建差异代谢物与生物标志物的相关性网络,如图7 所示。在相关性网络中,节点越大表示该节点有较高的度,即有更多的节点与之相连。对甲苯酚、乙醛、乙酸、糠醛、乙酸正丁酯具有较高的度,这些物质与较多的微生物存在显著的相关性,这说明代谢物与多种微生物有关。曲霉属与乙酸和糠醇呈现极强的正相关,曲霉属能够产生淀粉水解酶,产生的葡萄糖经糖酵解途径后生成酸类和醇类[26],这一结果可能与曲霉菌属的水解糖化功能有关。醋酸杆菌属和乳酸杆菌属分别与异戊醇、癸酸乙酯、(+)-3-甲基-2-丁醇、乙酸正丁酯呈显著负相关,这两种微生物是浓香白酒酒醅中重要的产酸细菌。乳酸杆菌属和醋酸菌属产生的酸类物质一方面能够作为白酒中重要的风味物质,另一方面也能够作为其它风味物质的前体物[27-28]。然而,这些酸类物质在一定程度上也影响其它微生物的生长和代谢[29]。例如醋酸能够抑制发酵过程中微生物的生长,并改变群落组成[30]。除产生酸类物质外,乳酸杆菌属还能够产生细菌属以拮抗其它微生物[31]。因此,乳杆菌属和醋酸杆菌属不仅能够直接参与风味物质代谢,还能通过产生酸类物质和细菌素间接影响微生物群落对风味物质的代谢。

图7 差异挥发性代谢物与生物标志物的相关性Fig. 7 Correlation of differentially volatile metabolites with biomarkers
2.5 酿酒酵母对酒醅中微生物群落潜在功能的影响
为研究酿酒酵母对糟醅中微生物组代谢及功能的扰动,基于PICRUST2 对试验组和空白组酒醅中微生物群落的功能基因进行预测。此外,对预测得到的试验组与空白组基因进行负二项分布检验,如图8 所示,共出现180 个上调基因和46 个下调基因。结果说明试验组与空白组相比,180 个功能基因的丰度显著增加,46 个功能基因丰度显著降低。为进一步研究上调与下调基因的功能,基于KEGG 数据库对180 个上调基因和46 个下调基因进行通路富集,以明确空白组与试验组间的功能差异,如图9 所示。在上调基因所富集的通路中,甲烷代谢,多环芳香烃降解,不同环境中的微生物代谢,芳香族化合物的降解,乙苯降解,C5-支链二元酸代谢,生物膜形成,氰基氨基酸代谢,吩嗪生物合成,硫代谢,碳代谢,硒化合物代谢,氨基苯甲酸酯降的富集结果显著(P<0.05)。在下调基因富集的结果中,仅有苯丙氨酸、酪氨酸和色氨酸生物合成、新生霉素生物合成、倍半萜和三萜生物合成、乙苯降解的富集结果显著(P<0.05)。这些结果说明酿酒酵母能够导致酒醅微生物群落13 条功能通路增强,而仅4 条功能通路减弱。这些增强的功能多数与物质的代谢有关,这将有利于微生物群落对底物的转化,促进酒醅中代谢物的积累。

图8 试验组和空白组基因差异分析火山图和基因数量柱状图Fig. 8 Volcano plot and histogram of gene number for gene difference analysis between experimental group and blank group

图9 上调基因(a)与下调基因(b)KEGG 功能富集Fig. 9 Functional enrichment of up-regulated(a)genes and down-regulated genes(b)KEGG
3 结论
分别研究了酿酒酵母对酒醅微的生物群落组成、微生物生态网络、挥发性代谢物、功能的影响。结果显示,酿酒酵母导致酒醅发酵过程中微生物群落组成发生改变,其中5 种细菌和15 种真菌是区分试验组与空白组的生物标志物。酿酒酵母的扰动效应增加了微生物生态网络的复杂性,使得其在适宜条件下具有更强的生命活动,而降低了在恶劣条件下的稳定性。试验组与空白组挥发性代谢物的组成差异随发酵的进行逐渐增大,两者间共有18 种差异代谢物。此外,绝大多数生物标志物与差异代谢物显著相关。基于功能预测发现酿酒酵母的扰动导致微生物群落共出现180 个上调基因和46 个下调基因,并且上调基因大多数与物质代谢相关。这些结果为优化酒醅发酵过程,为提高酒醅质量提供理论基础。

