发酵海产品中产蛋白酶菌株多样性及其酶学特性
檀茜倩,王 丹,王晓晴,崔方超,吕欣然,李学鹏,李英美,励建荣*
(1 渤海大学食品科学与工程学院/海洋研究院 辽宁锦州121013 2 达莲食品(锦州)有限公司 辽宁锦州 121019)
蛋白酶是一种水解肽键的酶类[1],其来源广泛,微生物是蛋白酶的一类重要来源。微生物源蛋白酶的利用率高[2]且稳定性好,在较高温度、极端pH 值条件、表面活性剂和有机溶剂存在的情况下仍能够保持较高活力[3-4]。发酵是一种传统的食品加工方式,对于海产品这类营养丰富而容易腐败的食品来说,发酵处理不仅能在一定程度上延长食品货架期,还能获得特殊风味。产蛋白酶菌株在海产品发酵中起到了非常重要的作用。产蛋白酶菌株的存在一方面可加速发酵过程以及改善发酵食品的风味和品质。有研究利用从发酵鱼汤、鱼露厂、盐晶和盐锅中分离的多株产蛋白酶菌株作为发酵剂发酵生产鱼露,相对于未接种发酵剂的自然发酵方式,更能促进鱼露特定香气和风味的形成[5]。Peinado 等[6]利用蛋白酶酶解水产品加工副产物生产鱼粉,发现能显著改善鱼粉风味,尤其是使其腥味降低。然而,产蛋白酶菌株在海产品的发酵中也有不利影响。研究发现部分菌株(例如维氏气单胞菌等)蛋白酶的分泌与发酵食品腐败变质密切相关[7-8]。基于以上2 个出发点考虑,本研究以自制发酵海产品为研究对象,对其中产蛋白酶菌株进行了筛选,并对其中部分产蛋白酶菌株的生长特性以及其产生蛋白酶的酶学性质进行了分析,以期为海产品发酵酶解菌种开发和避免发酵海产品变质提供一定借鉴和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验原料 自制腌制发酵蛤蜊、虾蛄、海参肠等海产品。
1.1.2 试剂与培养基 细菌DNA 提取试剂盒、PCR 扩增试剂预混液、细菌通用引物,生工生物工程(上海)股份有限公司;福林酚试剂、碳酸钠、三氯乙酸、氢氧化钠、无水乙醇、氯化钠、氯化钾、氯化钙、氯化镁、氯化亚铁、三氯化铁、氯化铜、EDTA等均为国产分析纯级,上海帝博思生物科技公司;LB 营养琼脂、LB 液体培养基,北京奥博星生物技术有限公司;改良脱脂乳培养基(10.0 g/L,琼脂20.0 g/L,水1.0 L,pH 7.2~7.4),115 ℃灭菌15 min备用。
1.2 设备与仪器
BagMixer 400 均质器,法国Interscience 公司;SW-CJ-2FD 超净工作台,苏净集团苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅,上海申安医疗器械厂;Thermo Sorvall Legend Micro21R台式微量离心机,美国赛默飞世尔科技公司;LRH-250A 型生化培养箱,上海一恒科技有限公司;MS105DU 电子分析天平,瑞士梅特勒-托利多公司;GelDoc XR+全自动凝胶成像系统,美国Bio-Rad 公司;PCR 仪,德国Eppendorf 公司。
1.3 试验方法
1.3.1 菌株的初筛和分离纯化 在无菌环境下取各样品10.0 g,加入无菌生理盐水90 mL,梯度稀释后,涂布于LB 固体培养基,每个梯度做3 个平行,置于37 ℃恒温培养箱培养24 h 后挑取不同形态菌株进行纯化培养和革兰氏染色,将分离的菌株冻存于-80 ℃冰箱。
1.3.2 产蛋白酶菌株的筛选 将保藏在-80 ℃冰箱的菌株活化后接种于LB 液体培养基,培养24 h 后将菌液以10 000 r/min 离心10 min,留取上清液。参考耿芳等[9]的方法适当修改,采用牛津杯法筛选产蛋白酶菌株,具体方法为将灭菌处理后的牛津杯放入平板后将脱脂乳固体培养基倒入平板,待其凝固后,取出牛津杯,在孔内加入150 μL分离菌株上清液,无菌水做阴性对照,在37 ℃培养箱内培养24 h 后测量透明圈直径,探究其产蛋白酶情况。
1.3.3 产蛋白酶菌株鉴定 对在平板上形成透明圈的产蛋白酶菌株按照细菌DNA 提取试剂盒说明完成菌株DNA 提取。采用细菌通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGACTTAACCCCAATCGC-3’),以所提取各菌株DNA 为模板进行PCR 扩增,对PCR 产物检测合格后送上海生工生物科技有限公司测序,测序结果与NCBI 数据库对比,用MAGE7.0 软件构建系统发育树。
1.3.4 菌株产蛋白酶酶活测定 参照曹慧等[10]的方法并作适当修改以分离粗蛋白酶。将37 ℃培养24 h 后的菌液转移到无菌离心管中,于4 ℃、10 000 r/min 下离心10 min,所得上清液为胞外蛋白酶粗酶液,保存于4 ℃冰箱内并于12 h 内使用。按照国标GB/T 23527-2009《蛋白酶制剂》中的福林酚显色法测定蛋白酶活力[11]。吸取0.5%的酪蛋白溶液2 mL,在40 ℃水浴加热5 min,加入预热的粗酶液1 mL,反应10 min 后加入10%三氯乙酸溶液3 mL,孵育15 min 终止反应,以无菌水代替粗酶液作为阴性对照。将反应液在12 000 r/min离心10 min,取上清液1 mL 加入5 mL 碳酸钠溶液(0.55 mol/L)和1 mL 福林酚试剂,处理15 min后在波长680 nm 处测定样品及对照组样品的吸光度值(A)。根据公式(1)计算粗酶液酶活力。
式中,A样——样品吸光度值;A对——对照组样品吸光度值;K——标准曲线为1 时对应酪氨酸的含量,μg;t——酶促反应时间,10 min;V——酶促反应总体积,6 mL。
1.3.5 产蛋白酶菌株生物学特性分析
1.3.5.1 温度对菌株生长的影响 参照Shu 等[12]的方法作适当修改。按照3%的接种量将菌株接种于LB 液体培养基并置于不同温度(20,25,28,30,37,40 ℃)培养24 h,在波长600 nm 处根据测得各温度菌株随时间生长的吸光度值变化判断温度对菌株生长的影响。
1.3.5.2 pH 值对菌株生长的影响 参照Sun 等[13]的方法作适当修改。按照3%接种量将活化后的菌株接种于pH 值分别为1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5 的LB 液体培养基中,置于37℃摇床培养24 h 后测定波长600 nm 处菌株生长的吸光度值变化判断pH 值对菌株生长的影响。
1.3.5.3 盐质量浓度对菌株生长的影响 参考宋梦思等[14]的方法,按照3%接种量将活化后的菌株接种于盐质量浓度为10,20,30,40,50,60,70 g/L的LB 液体培养基中,置于37 ℃摇床培养24 h 后测定波长600 nm 处菌株生长的吸光度值变化判断盐质量浓度对菌株生长的影响。
1.3.6 蛋白酶酶学性质分析 选取产蛋白酶活力较高的不同种菌株进行蛋白酶酶学特性分析。
1.3.6.1 温度对酶活力的影响 分别在10,20,30,40,50,60 ℃条件下测定粗酶液酶活力,判断温度对酶活力的影响。
1.3.6.2 pH 值对酶活力的影响 参考Sun 等[15]的方法,将粗酶液与pH 值为5.0,6.0,7.0,8.0,9.0 的酪蛋白底物在上述最适温度下反应,测得相应酶活力,判断pH 值对酶活力的影响。
1.3.6.3 金属离子和抑制剂对蛋白酶活力的影响参照李丹阳等[16]的方法并作适当修改。分别将粗酶液与添加1 mmol/L 和10 mmol/L 的不同金属离子(Na+、K+、Mg2+、Zn2+、Cu2+、Fe2+、Fe3+)氯化物盐溶液和抑制剂EDTA 共孵育30 min,将没有添加金属离子和抑制剂的蛋白酶活性定义为100%,测定在金属离子和抑制剂的作用下粗酶液相对酶活的变化。
1.4 数据处理
2 结果与分析
2.1 产蛋白酶菌株的分离培养与鉴定
产蛋白酶微生物种类很多,分布于类杆菌门、变形杆菌门、放线杆菌门、热变形球菌门等多个门中[17]。本研究从发酵海产品中分离得到多株菌株,经改良脱脂乳平板筛选后发现10 株菌株具有产蛋白酶能力。以菌株DNA 为模板利用细菌通用引物对菌株16S rRNA 基因序列进行扩增,在1 000 bp 附近均出现明显条带(图1)。

图1 菌株的16S rRNA 基因PCR 扩增电泳图Fig. 1 Electrophoretic of PCR amplification products of 16S rRNA gene of the isolated strains
将PCR 产物测序结果在NCBI 数据库对比并经过系统发育树分析后得到的菌株鉴定结果如表1 所示,分离培养得到表型不同的菌株分别为革兰氏阳性菌的贝莱斯芽孢杆菌(Bacillus velezensis)S1YBB、S1YB,藤黄色微球菌(Micrococcus luteus)C1Y1,海氏肠球菌(Enterococcus hirae)M1R;革兰氏阴性菌的黏质沙雷氏菌(Serratia marcescens)S2DD、S2DB、C2Y3、M1B、C2J2,海 藻希瓦氏菌(Shewanella alga)C2J1。

表1 菌株鉴定结果分析Table 1 Analysis of strain identification results
菌株在LB 平板上的生长形态如图2a 所示。贝莱斯芽孢杆菌S1YBB、S1YB 生长状态呈现中间凸起,有孢子形成;黏质沙雷氏菌S2DD、S2DB、C2Y3、M1B、C2J2 菌落边缘清晰,有黏性;藤黄色微球菌C1Y1 呈现油状金黄色;海藻希瓦氏菌C2J1 菌落表面光滑、边缘清晰;海氏肠球菌M1R为球状菌落。菌株粗酶提取液在改良脱脂乳平板上水解圈的形成情况如图2b 所示,10 株菌在改良脱脂乳平板上形成大小不一的水解圈。
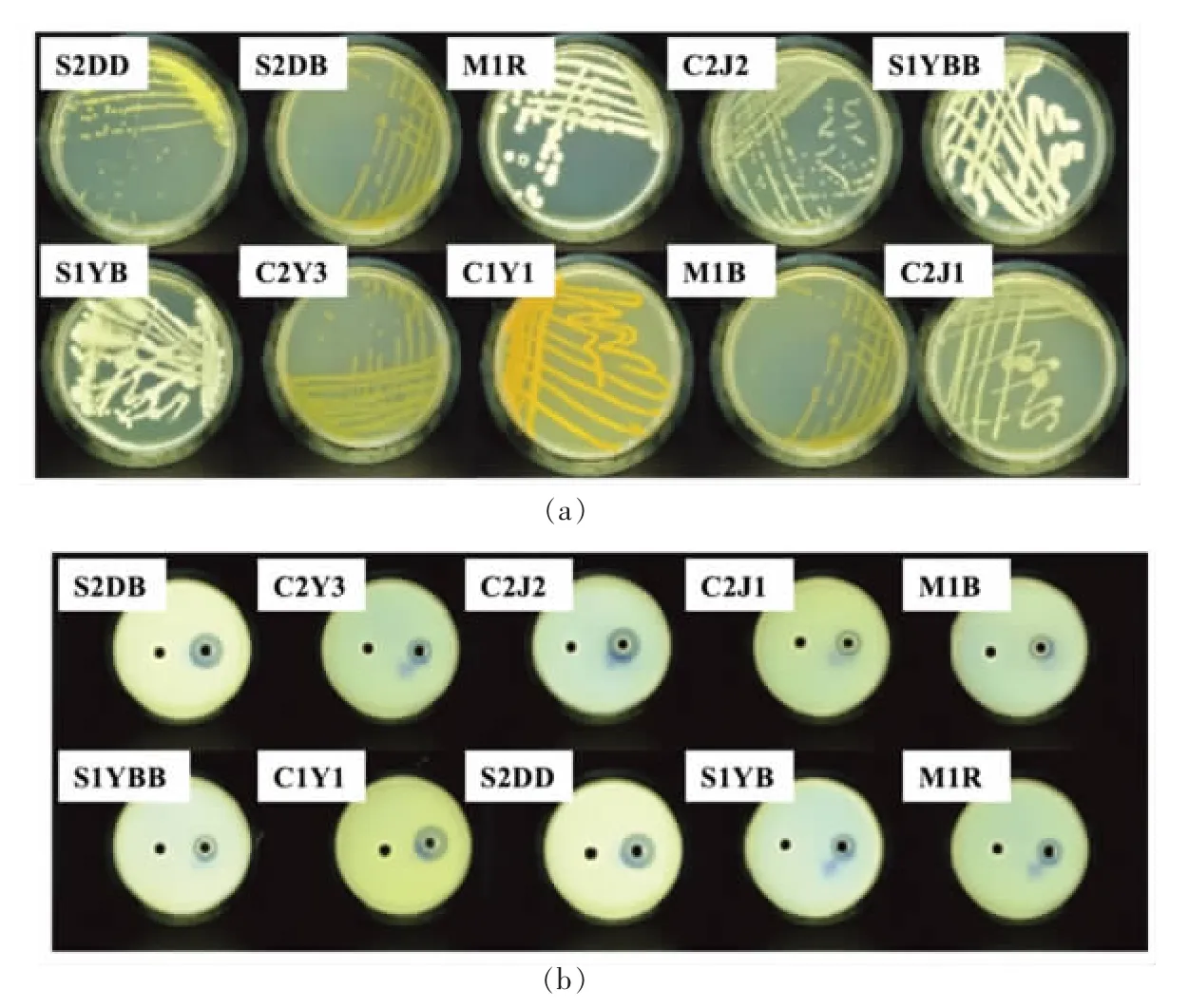
图2 菌落形态(a)以及菌株粗酶提取物的蛋白水解能力(b)Fig. 2 Colony morphology of the strains(a)and the hydrolytic abilities of their crude enzyme extract(b)
2.2 菌株产蛋白酶酶活分析
参照国标GB/T 23527-2009《蛋白酶制剂》制作酪氨酸标准曲线,得标准曲线线性回归方程式为:y=0.0097x+0.0994,其中R2=0.9992,表明线性回归方程线性关系良好。根据福林酚试剂法对10 株菌株产蛋白酶活性进行测定(表2),其中黏质沙雷氏菌产蛋白酶酶活相对较高,均在20 U/mL以上,最高的是黏质沙雷氏菌S2DB 为(32.44±0.67)U/mL,藤黄色微球菌C1Y1、海藻希瓦氏菌C2J1、海氏肠球菌M1R 产蛋白酶酶活也可以达到20 U/mL 以上,而贝莱斯芽孢杆菌S1YBB 所产蛋白酶活性最低为(8.65±0.14)U/mL,相对于已报道[18]芽孢杆菌产蛋白酶的酶活较低,在后续研究中可考虑对其培养条件进行优化以提高产酶活性。本研究选取5 株产蛋白酶活力相对较高的不同种菌株(贝莱斯芽孢杆菌S1YB、黏质沙雷氏菌S2DB、藤黄色微球菌C1Y1、海藻希瓦氏菌C2J1、海氏肠球菌M1R)进行后续菌株生物学和产蛋白酶的酶学特性分析。

表2 菌株产蛋白酶活力Table 2 Activities of protease produced by the strains
2.3 菌株的生物学特性分析
2.3.1 菌株的最适生长温度 菌株的生长受温度影响,5 株菌株在不同温度条件下培养24 h 的生长情况如图3 所示,37 ℃左右时5 株菌在LB 液体培养基中OD600nm普遍达到0.6~0.7,吸光度值较高,说明各菌株在此温度下生长情况良好。在25 ℃时,菌株藤黄色微球菌C1Y1、贝莱斯芽孢杆菌S1YB 的OD600nm出现一定程度升高,具体原因有待于进一步分析,可能与其对温度适应性有关。相关研究表明藤黄色微球菌[19]、芽孢杆菌[20]以及黏质沙雷氏菌[21]生长比较适合的温度为37 ℃,不同株之间可能由于受到分离环境影响而有所差异。

图3 温度对菌株生长的影响Fig. 3 Effects of temperature on bacterial growth
2.3.2 pH 值对菌株生长的影响 pH 值是影响菌株生长的另一个重要因素,也会在一定程度上影响其所分泌的蛋白酶活性[22]。不同pH 值条件对菌株生长影响如图4 所示,5 株菌在pH 1.5~4.5 范围内OD600nm值较低,说明在此pH 值下菌株生长受到抑制;随着pH 值升至4.5 左右时,菌株OD600nm值有明显上升,pH 5.5 左右时达到最高为0.7,pH 5.5~6.5 之间菌株生长趋于平缓。其中贝莱斯芽孢杆菌S1YB 相对于其它菌株生长能力较弱,其原因可能与菌株本身特性或菌株对营养的不同需求有关;黏质沙雷氏菌S2DB 在趋近于中性偏碱性条件下生长能力较好,与其它研究发现的黏质沙雷氏菌在pH 为8.0 偏碱性条件下菌株生长能力更好的相关结果具有一致性[23]。

图4 不同pH 值对菌株生长的影响Fig. 4 Effects of different pH values on bacterial growth
2.3.3 菌株的耐盐能力分析 盐质量浓度的变化会通过改变细胞渗透压影响菌株生长。不同菌株耐盐能力分析结果如图5 所示。在10~20 g/L 范围,随盐质量浓度升高,菌株能够生长,OD600nm值升高,在20 g/L 时达到最大值,随后各菌株OD600nm值随盐质量浓度增加呈现下降趋势,说明菌株生长受到抑制(P<0.05)。

图5 不同盐质量浓度对菌株生长的影响Fig. 5 Effects of different salt mass concentrations on bacterial growth
2.4 菌株蛋白酶的酶学性质
2.4.1 温度对酶活力的影响 温度会影响蛋白酶活力发挥,温度对粗酶活性影响如图6 所示。研究发现,不同菌株提取的粗酶液在不同温度下酶活力大小不同,在10~60 ℃内,酶活力随温度升高整体呈现上上的趋势,在40~50 ℃左右酶活性相对较高。相对于其它菌株来说,芽孢杆菌所产蛋白酶活力在一定温度范围内都可以保持稳定[24]。这与本研究所分离所分离贝莱斯芽孢杆菌S1YB 酶活力变化抑制,S1YB 在试验温度范围内整体酶活相对其它菌株所产酶活较高,且呈现上升趋势,未出现酶活下降的情况。

图6 温度对蛋白酶活性的影响Fig. 6 Effects of temperature on protease activity
2.4.2 pH 值对酶活力的影响 pH 值对酶活力影响如图7 所示。贝莱斯芽孢杆菌SIYB 所分泌的蛋白酶在一定pH 值范围内呈现出较高酶活力,且在pH 值为7.0 时最为稳定;黏质沙雷氏菌S2DB和海藻希瓦氏菌C2J1 分泌的蛋白酶也在pH 7时最为稳定;藤黄色微球菌C1Y1 和海氏肠球菌M1R 分别在pH 值为6.0(偏酸性)和8.0(偏碱性)下较为稳定。其中,芽孢杆菌产蛋白酶对热和pH值的稳定性相对较高[25-26],与本研究所分离贝莱斯芽孢杆菌S1YB 产蛋白酶酶活力在pH 值变化下酶活力的变化情况一致,S1YB 所产蛋白酶活力在相同pH 值下均高于其它菌株所产蛋白酶酶活力。

图7 pH 值对蛋白酶活力的影响Fig. 7 Effects of pH value on protease activity
2.4.3 金属离子和抑制剂对酶活力的影响 在食品的加工过程中添加的Na+、K+、Ca2+、Fe2+、Fe3+、Zn2+、Cu2+等金属离子也会在一定程度上影响蛋白酶活力[27-28]。本研究以不添加金属离子的粗酶液作为对照,研究了1 mmol/L 和10 mmol/L 上述金属离子添加对5 株菌株所分泌蛋白酶相对酶活力影响,结果如表3 和表4 所示。研究发现添加金属离子后5 株菌株所分泌的蛋白酶相对活力产生了不同程度的下降,下降程度与金属离子的类型和金属离子的添加量有关。

表4 10 mmol/L 金属离子和抑制剂对5 株菌产蛋白酶相对酶活力的影响Table 4 Effects of 10 mmol/L metal ions and inhibitors on the relative protease activity produced by five stains
金属离子能提高或者降低蛋白酶的稳定性[29]。Na+的添加可能改变蛋白酶的结构,在10 mmol/L 的Na+作用下,虽然菌株整体蛋白酶活力有所降低,但贝莱斯芽孢杆菌S1YB、藤黄色微球菌C1Y1、海藻希瓦氏菌C2J1 相对于1 mmol/L 的Na+作用相对增强;在上述两个浓度的Ca2+作用下也发现类似趋势,Ca2+在一定温度条件内可稳定蛋白酶结构,提高蛋白酶活力,有研究发现一株从海洋环境中分离出的葡萄球菌BUU1,在添加Ca2+共孵育培养48 h 后其产蛋白酶活力提升了44%,很多研究表明Ca2+在提高蛋白酶活力和热稳定性中起到了非常重要的作用[30]。Fe2+和Fe3+的加入对菌株蛋白酶活性抑制作用明显,可能与铁离子与酶活性中心基团结合从而造成蛋白酶活性降低或失活有关[31]。Cu2+的添加也使得包括贝莱斯芽孢杆菌S1YB、藤黄色微球菌C1Y1、海藻希瓦氏菌C2J1菌株在内的菌株蛋白酶活力大幅降低,可能与Cu2+造成蛋白酶活力失效有关。抑制剂EDTA 在上述浓度下对蛋白酶活性的降低也十分显著,推测本研究分离菌株所产蛋白酶为半胱氨酸类酶或金属蛋白酶,因为这类酶活性容易受到EDTA 的影响。
3 结论
本研究从发酵海产品中分离出10 株产蛋白酶菌株,并对其中5 株产蛋白酶活力相对较高的菌株贝莱斯芽孢杆菌S1YB、黏质沙雷氏菌S2DD、藤黄色微球菌C1Y1、海藻希瓦氏菌C2J1、海氏肠球菌M1R 进行后续生物学和酶学特性分析。研究发现菌株最适生长温度在37 ℃左右,在低pH 值(<4.5)时几乎不生长,最适pH 值为6.0~8.0,在盐质量浓度范围10~70 g/L 菌株均呈现一定耐受性,最适盐质量浓度为20 g/L,相比于其它菌株,贝莱斯芽孢杆菌S1YB 耐盐性较弱。酶学特性研究结果表明菌株蛋白酶活性稳定性为50 ℃,pH 7.0,不同浓度(1 mmol/L 和10 mmol/L)金属离子和抑制剂会造成菌株产生的蛋白酶活性降低。
后续可考虑对菌株蛋白酶类型和底物作用的特异性等方面进行深入研究,并在海产品的发酵过程中考虑提高有益微生物例如贝莱斯芽孢杆菌和海氏肠球菌等的比例,控制腐败微生物黏质沙雷氏菌的数量及控制其蛋白酶的产生,并讨论以有益微生物作为发酵剂发酵海产品对其风味的影响。

