异紫草酸纯化提取工艺及抗氧化活性研究
李瑞洁,何巧玉,张双,4,田介峰,罗学军,旷文静,孙会睿,5,李瑞明,郝士海
(1.天士力医药集团股份有限公司创新中药关键技术国家重点实验室,天津 300410;2.现代中药创制全国重点实验室,天津 300410;3.中国药科大学,江苏 南京 211198;4.沈阳药科大学,辽宁 沈阳 110016;5.天津中医药大学,天津 301617)
中药丹参Salviae Miltiorrhizae Radix et Rhizoma是唇形科植物丹参Salvia miltiorrhizaBge.的干燥根和根茎,具有活血祛瘀,通经止痛,清心除烦,凉血消痈的功效[1]。注射用丹参多酚酸是天津天士力之骄药业有限公司的独家中药保护品种,以丹参中水溶性酚酸类成分为有效成分,对缺血性脑损伤、心肌缺血损伤和糖尿病肾损伤等具有保护作用[2]。目前对于酚酸类化合物的分离,常采用大孔吸附树脂柱[3-4]、超临界流体萃取[5]、高速逆流色谱[6]、硅胶柱层析[7]、ODS 反向色谱[8]、制备型HPLC 等方法进行。而笔者团队在此前对丹参多酚酸化学成分的研究中[9]建立了一套联用反相色谱柱、凝胶柱以及制备液相的酚酸类化合物分离方法,并从中分离得到了异紫草酸,即4-(2-羧基乙烯基)-2-(3,4-二羟基苯基)-2,3-2H-7-羟基-3-苯骈呋喃羧酸-3-[1-羧基-2-(3,4-二羟基)乙基]酯,确定了其立体结构[10]。本实验通过对比MCI-Gel/ LH-20 凝胶/ C18 键合填料柱层析法以及硅胶/ C18 键合硅胶柱层析法两条异紫草酸分离路线的分离效果,意在得到一种操作简便、分离纯度高的异紫草酸分离方法,并进一步研究异紫草酸的药理活性。
目前普遍认为异紫草酸是丹酚酸B 的降解或转化产物[11-12],而丹酚酸B 作为丹参中含量较高、抗氧化活性较强的已知成分,被称为天然的抗氧化剂,现广泛用于治疗心脑血管疾病类药物的研究中[13-14]。异紫草酸具有5 个游离酚羟基,具有提供氢质子的能力,从而可以阻断自由基链式反应,即推测其具有清除自由基及抗氧化等作用。本实验通过测定异紫草酸的·OH 和DPPH 清除能力以及还原能力,探究异紫草酸的体外抗氧化活性,为活性丹酚酸类天然抗氧化剂的深入研发提供科学依据。
1 实验材料
Buchi 旋转蒸发仪(瑞士 Buchi 公司);梅特勒 XS205DU 电子天平(托利多仪器有限公司);Waters UPLC 超高效液相色谱仪(美国 Waters 公司);Agilent 1100 高效液相色谱仪(美国 Agilent 公司);LC-80 轴向加压制备色谱(法国 Novasep 公司);Waters Acquity HSS T3(2.1×150 mm,1.8 µm)色谱柱(美国 Waters 公司);Agilent ZORBAX SB-C18(4.6 × 250 mm,5 µm)色谱柱(美国 Agilent 公司);MCI-Gel 树脂(日本三菱公司);Sephadex LH20 凝胶(美国 GE 公司);ODS 填料(日本 YMC 公司);丹参多酚酸提取物(20131-101,天津天士力之骄药业有限公司);异紫草酸对照品(20150620,自制);紫外分光光度计(美国 Agilent 公司);乙腈(色谱纯,德国Merck 公司);甲酸、邻二氮菲、邻苯三酚、HCL(上海阿拉丁试剂公司);DPPH、磷酸亚铁、H2O2、磷酸二氢钠、磷酸氢二钠、Tris 缓冲盐、三氯乙酸、三氯化铁、铁氰化钾(分析纯,上海麦克林生化科技有限公司);无水乙醇(分析纯,天津市康科德科技有限公司)。

图1 异紫草酸结构Fig.1 Structure of isolithospermic acid
2 实验方法
2.1 两种异紫草酸分离方法对比
两种异紫草酸分离方法对比见图2。
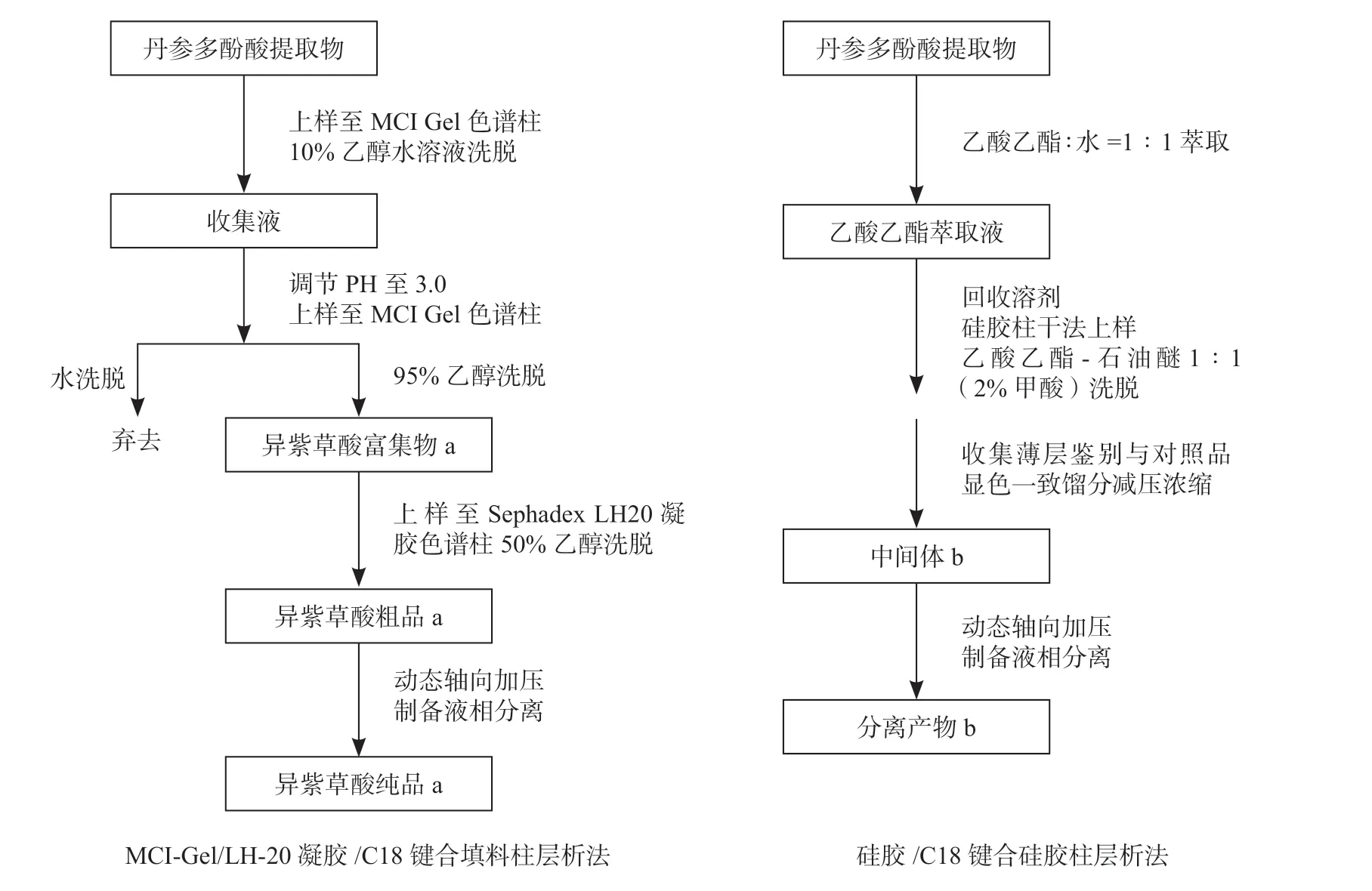
图2 异紫草酸分离方法流程图Fig.2 Flow chart of of Isolation of isolithospermic acid
2.1.1丹参多酚酸提取物指纹图谱的测定
采用超高效液相色谱法(UPLC)测定丹参酚酸提取物指纹图谱。色谱柱:Waters Acquity HSS T3(2.1 × 150 mm,1.8 µm);流 速:0.4 mL·min-1;检测波长:280 nm;柱温:40 ℃;流动相A:0.1%甲酸水;流动相B:乙腈;梯度洗脱条件:0~ 6.4 min,93%~ 86% A;6.4~ 16.0 min,86%~ 84% A;16.0~ 22.0 min,84%~ 83% A;22.0~ 28.0 min,83%~ 82% A ;28.0~ 32.0 min,82%~ 78% A ;32.0~ 35.0 min,78%~ 20% A ;35.0~ 35.5 min,20%~ 93% A;35.5~ 40 min,93% A。
2.1.2MCI-Gel/ LH-20 凝胶/ C18 键合填料柱层析法用于高纯度异紫草酸的分离
取丹参多酚酸提取物500 g,用1 000 mL 水溶解,上样至MCI Gel 色谱柱中(10 cm×51 cm)。用10%乙醇水溶液洗脱,流速为100 mL·min-1。依照2.1.1项下色谱条件检测收集液,与丹参多酚酸提取物指纹图谱对照,合并含有异紫草酸的洗脱液。调节洗脱液pH 值至3.0,再次上样至MCI Gel 色谱柱中。依次用水、95%乙醇洗脱,流速为100 mL·min-1,收集95%乙醇洗脱液,回收溶剂至干,得到异紫草酸富集物a。
将异紫草酸富集物a 用2 倍质量体积50%乙醇水溶液溶解,上样至Sephadex LH-20 凝胶色谱柱中(3 cm×50 cm),用50% 乙醇洗脱,流速为10 mL·min-1。依照2.1.1 项下色谱条件检测收集液,与丹参多酚酸提取物指纹图谱对照,合并含有异紫草酸的洗脱液,回收溶剂至干得到异紫草酸粗品a。
将异紫草酸粗品a 用2 倍质量体积23%乙腈水溶液完全溶解,采用动态轴向加压制备液相分离,以C18 键合硅胶为固定相,流动相为乙腈-水23∶77(0.01%甲酸),流速200 mL·min-1。依照2.1.1 项下色谱条件检测收集液,与丹参多酚酸提取物指纹图谱对照,合并含有异紫草酸的洗脱液。减压浓缩后于60 ℃减压干燥12 小时得到异紫草酸纯品a。
2.1.3硅胶/ C18 键合硅胶柱层析法用于异紫草酸分 离
取丹参多酚酸提取物50 g,溶于200 mL 水中,用等体积的乙酸乙酯萃取3 次,收集乙酸乙酯萃取液,减压回收溶剂,将样品与80 g 100~ 200 目硅胶进行拌样。干法上样至装好的硅胶柱中,用乙酸乙酯-石油醚1∶1(2%甲酸)洗脱,每0.2 倍柱体积为单位收集一个馏分。将各个馏分与异紫草酸对照品点于同一薄层板上,用5%硫酸乙醇为显色剂进行显色。将与异紫草酸对照品斑点Rf 值一致的馏分合并,减压浓缩至干,得到中间体b。
将中间体b 用2 倍质量体积23%乙腈水溶液完全溶解,采用动态轴向加压制备液相分离,以C18键合硅胶为固定相,流动相为乙腈-水23∶77(0.01%甲酸),流速200 mL·min-1,收集合并含有异紫草酸的洗脱液,减压浓缩后于60 ℃减压干燥12 小时得到分离产物b。
2.1.4MCI-Gel/ LH-20 凝胶/ C18 键合填料柱层析法分离样品含量测定
2.1.4.1色谱条件
采用超高效液相色谱法(UPLC)进行测定。色谱柱:Waters Acquity HSS T3(2.1×150 mm,1.8 µm);流 速:0.4 mL·min-1;检测长:280 nm;柱温:40 ℃;流动相A:0.02%磷酸水;流动相B:80% 乙腈-20% 0.02% 磷酸水;梯度洗脱条件:0~ 1.6 min,91%~ 78% A;1.6~ 1.8 min,78%~ 74% A;1.8~ 8.0 min,74%~ 61%A;8.0~ 8.4 min,61%~ 91% A;8.4~ 10.0 min,91% A。
2.1.4.2供试品溶液的制备
称取异紫草酸富集物a 30 mg,异紫草酸粗品a 20 mg,异紫草酸纯品a 10 mg,分别置于25 mL 容量瓶中,用甲醇溶解,并定容至刻度。
2.1.4.3测定
精密吸取上述供试品溶液各2 μL,按2.1.4.1 方法进行测定,记录异紫草酸归一化法百分含量。
2.1.5硅胶/ C18 键合硅胶柱层析法分离样品液相检 测
2.1.5.1色谱条件
采用高效液相色谱法(HPLC)进行测定。色谱 柱:Agilent ZORBAX SB-C18(4.6×250 mm,5 µm);流速:1 mL·min-1;检测波长:280 nm;柱温:30 ℃;流动相A:0.02%磷酸水;流动相B:80%乙腈-20% 0.02%磷酸水;梯度洗脱条件:0~ 8 min,90%~ 78% A;8~ 15 min,78%~ 74% A;15~ 35 min,74%~ 61% A;61~ 40 min,61%~ 90% A;40~ 50 min,90% A。
2.1.5.2供试品溶液的制备
称取分离产物b 10 mg,置于25 mL 容量瓶中,用甲醇溶解,并定容至刻度。
2.1.5.3测定
吸取上述供试品10 μL,按照2.1.5.1 项下条件进行测定。
2.2 异紫草酸体外抗氧化实验
2.2.1异紫草酸对·OH 的清除能力
采用Fenton 法,参照文献 [15]方法,分别配制质量浓度为0.15、0.20、0.25、0.30、0.35、0.40、0.45 mg·mL-1的异紫草酸样品进行实验,测定吸光度A。样品对·OH清除率I的计算公式为I%=[(A加样-A损伤)/(A未损伤-A损伤)]×100%
2.2.2异紫草酸清除DPPH 能力的测定
采用比色法测定异紫草酸清除DPPH 能力,参照文献 [15]方法,分别配制质量浓度为0.005、0.01、0.02、0.03、0.04、0.05、0.06 mg·mL-1的样品溶液。样品对DPPH 的清除率I%=[1-(A样品-A对照)/A空白]×100%
2.2.3异紫草酸还原能力的测定
采用铁氰化钾还原试验,参照文献 [15]方法,分别配制质量浓度为0.01、0.03、0.05、0.07、0.09 mg·mL-1的样品溶液。每份样品平行3 份,参照为蒸馏水,在700 nm 波长处测定吸光度A。
3 实验结果
3.1 丹参多酚酸指纹图谱
丹参多酚酸指纹图谱检测结果见图3,如图所示,异紫草酸含量较低,常规分离方法很难得到高纯度单 体。

图3 丹参酚酸指纹图谱Fig.3 Fingerprint of salvia polyphenolic acids
3.2 MCI-Gel/ LH-20 凝胶/ C18 键合填料柱层析法样品含量测定
异紫草酸富集物a、异紫草酸粗品a 和异紫草酸纯品a 归一化法百分含量分别为42.3%、92.6%和98.7%,详见图4,该方法分离得到的异紫草酸单体纯度高。

图4 异紫草酸富集物a(A)、粗品a(B)、纯品a(C)UPLC 检测图Fig.4 UPLC detection diagram of isolithospermic acid enrichment a(A),isolithospermic acid crude product a(B)and isolithospermic acid a(C)
3.3 硅胶/ C18 键合填料柱层析法样品的检测
根据图5 结果,采用硅胶/ C18 键合填料柱层析法无法将异紫草酸与丹酚酸D 分离,未能得到异紫草酸纯品,并且在分离后浓缩过程中很容易出现一个未知的化合物。
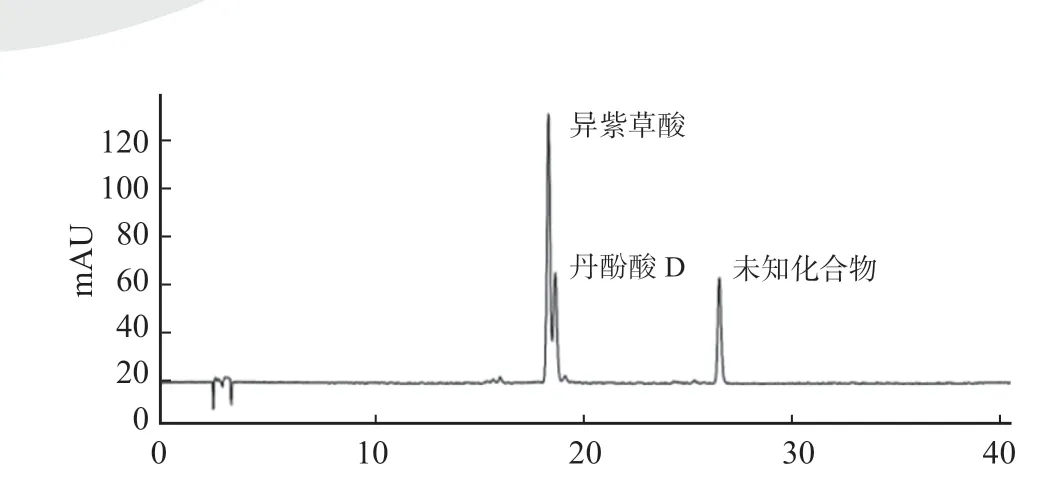
图5 硅胶/ C18 键合填料柱层析法分离产物b 液相检测图Fig.5 HPLC detection diagram of product b which separated by silica gel/C18 bonded packing column chromatography
3.4 异紫草酸体外抗氧化实验
在实验测定范围内,异紫草酸对·OH 及DPPH均具有清除作用,半数清除率浓度(IC50)分别为0.277 mg·mL-1和17.43 µg·mL-1。异紫草酸的还原能力呈现出良好的量-效关系,即随着浓度的增加,还原能力也逐渐增加,详见图6。
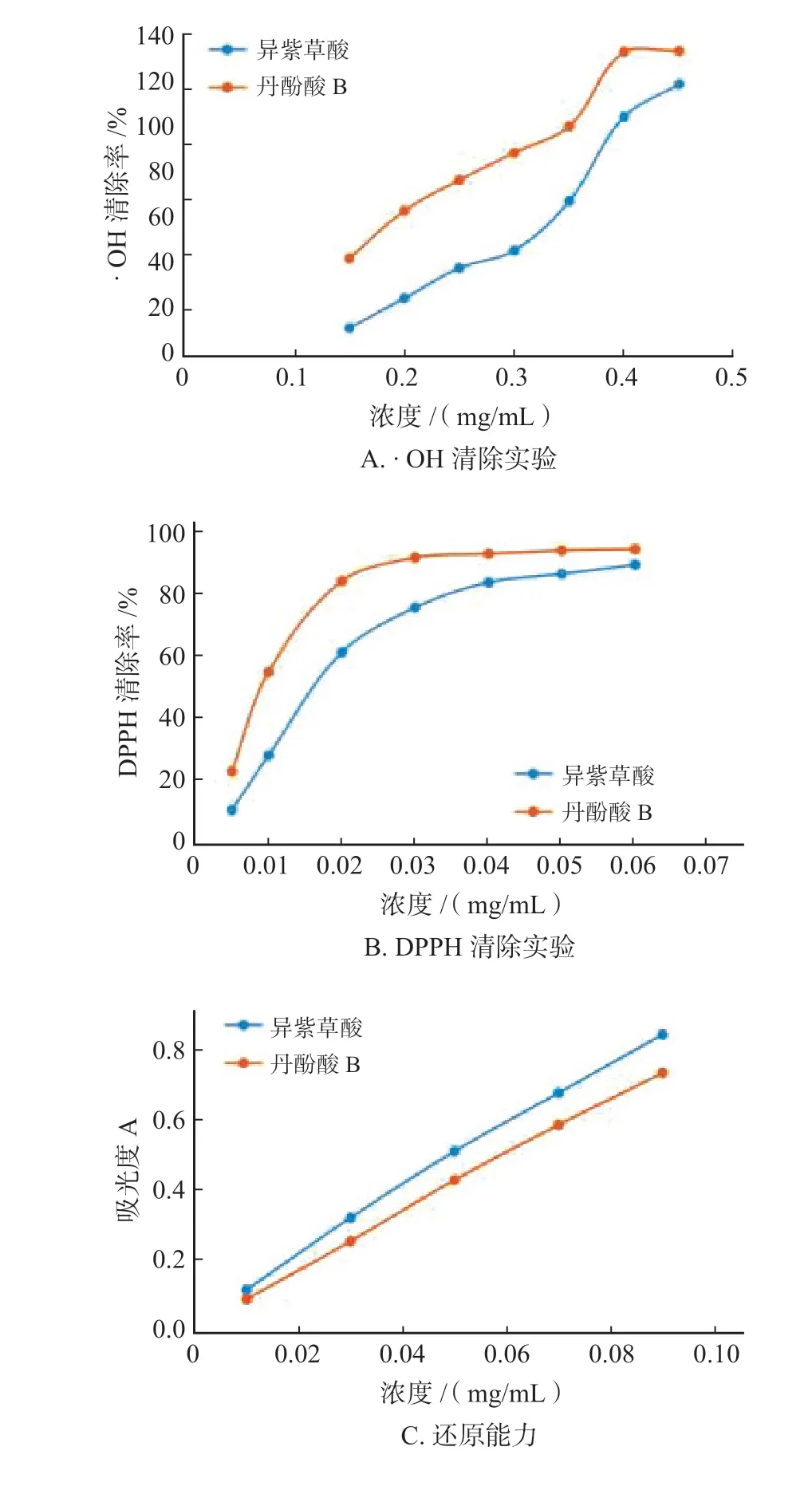
图6 异紫草酸·OH(A)清除率、DPPH(B)清除率及总还原能力(C)Fig.6 The ·OH clearance curve(A),DPPH clearance curve(B)and reducing power(C)of Isolithospermic acid
4 讨论
异紫草酸在丹参多酚酸提取物中的含量很低,且极性与丹酚酸D 非常接近,该化合物含有多个酚羟基,呈弱酸性,易被氧化分解,从丹参酚酸提取物中分离得到纯度较高的异紫草酸难度很大。现有异紫草酸分离方法[16]工艺复杂、用到多种有机试剂,并且对高压分离设备的依赖性高,制备周期长,成本高。而借鉴常规硅胶柱层析分离方法从丹参酚酸提取物中分离异紫草酸时,丹酚酸D 极易转化成另一种未知化合物,混入异紫草酸的馏分中,无法达到良好的分离效果,且该方法分离周期长,使用的有机溶剂多,对操作人员的安全带来隐患。本研究中的高纯度异紫草酸分离方法,利用丹酚酸D 和异紫草酸分子量差异,先采用凝胶柱将丹酚酸D 去除,再用C18 键合硅胶柱分离得到高纯度异紫草酸,其含量大于98.5%。该方法操作简便、安全性较强,解决了丹参多酚酸中低含量成分异紫草酸分离困难的问题,是一种快速安全高效的异紫草酸分离方法,也为其余丹参多酚酸提取物分离纯化提供借鉴参考。
体外抗氧化活性实验结果表明,异紫草酸具有清除自由基及抗氧化活性。大量研究表明[17-18],氧自由基与心血管疾病的发生、发展有着密切关系,丹参的抗氧化作用可能是其在治疗心血管疾病效果显著的原因之一。因此异紫草酸可用于治疗心脑血管疾病药物的开发中,为活性丹酚酸类天然抗氧化剂的深入研发提供科学依据。

