circ_0000515靶向miR-924调控卵巢癌SKOV3细胞增殖、迁移及侵袭的机制研究
张瑛琦
(佳木斯市妇幼保健院,黑龙江 佳木斯 154003)
卵巢癌是威胁女性生命安全的恶性肿瘤之一,由于早期临床症状较为隐匿,70%患者确诊时已处于晚期,中晚期卵巢癌5年生存率大于为40%,但大多数患者预后差且总体生存率低,为寻找早期诊断的潜在生物学标志物或治疗靶点,探究卵巢癌发展的机制是必须的[1-2]。作为一个由3’端与5’端连接形成的闭合环状RNA,环状RNA(circular RNA,circRNA)可以参与卵巢癌进展通过靶向微小RNA(miRNA)[3-4]。circ_0000515参与调控肿瘤发生过程。如,其在肝癌组织和细胞中高表达,它的高表达可预示淋巴转移的高发,并且体外研究指出其低表达能抑制肝癌细胞增殖和迁移,体内研究表明其能加重肝癌恶性进展[5]。生物信息学分析预测miR-924是circ_0000515的候选靶基因之一。证据已指出增加这个miRNA含量能够减弱肺癌细胞生长和运动能力[6],提示miR-924介导肿瘤细胞特性。本研究运用SKOV3细胞分析circ_0000515是否通过靶向miR-924介导卵巢癌恶性表型。
1 材料与方法
1.1 材料与试剂
选取2020年3月—7月于佳木斯市妇幼保健院经病理学确诊的43例卵巢癌患者肿瘤和癌旁组织标本,并及时储存在-80℃,病人或其近亲属知情同意。
SKOV3细胞、青霉素(100 μg·mL-1),链霉素(100 μg·mL-1)购自上海奥陆生物;E-cadherin、N-cadherin抗体购自美国Santa Cruz;DMEM培养液购自上海碧云天生物;荧光定量PCR试剂盒、胎牛血清、荧光素酶检测盒、胰蛋白酶、Transwell小室购自北京索莱宝;Trizol与Lipofectamine™ 3000购自美国Invitrogen;Matrigel基质胶购自北京索莱宝科技;GAPDH抗体与 IgG二抗购自美国CST;反转录试剂购自北京天根生化;CCK-8试剂购自上海酶研生物。
1.2 实验方法
1.2.1 实验分组 SKOV3细胞按照说明书培养在5% CO2培养箱内,用显微镜观察细胞生长密度,待其汇合度达到95%左右时,用胰酶消化(用显微镜观察细胞状态)并铺在6孔板(1×104个/孔),铺板后大约16 h(此时细胞密度应当在75%~90%左右)采用脂质体转染法(转染siRNAs或miRNA模拟物及抑制剂时不加P3000TM试剂)将si-NC、si-circ_0000515、miR-NC、miR-924 mimics制备成RNA-脂质体复合物,并加入到6孔板中,在培养板上标记si-NC组、si-circ_0000515组、miR-NC组、miR-924组。用减血清培养基稀释Lipofectamine™3 000,随后将si-circ_0000515分别与anti-miR-NC或anti-miR-924进行共转染(密度应当在75%~90%左右),在培养板上标记si-circ_0000515+antimiR-NC组、si-circ_0000515+anti-miR-924组。
1.2.2 qRT-PCR 取80 mg卵巢癌组织和80 mg癌旁组织和1 mL Trizol试剂混合均匀、取1×106细胞样品和0.4 mL Trizol试剂混合均匀。将各样品在常温下裂解15 min完全解离核蛋白复合体。用紫外分光光度计测RNA浓度。取适量RNA样品根据FastKing RT Kit说明准备反转录体系以合成cDNA(加样过程应在冰上操作,防止RNA降解)。以cDNA为模板进行qRT-PCR扩增以定量circ_0000515、miR-924表达。
1.2.3 CCK-8实验 将si-circ_0000515组、miR-924组、si-circ_0000515+anti-miR-924组以及对照组细胞收集并接种于96孔板,随后添加CCK-8溶液,根据说明书要求在37℃、5% CO2培养箱中培养2 h。最后,各孔样品经酶标仪评估。
1.2.4 平板克隆形成实验 在6孔板中,收集的sicirc_0000515组、miR-924、si-circ_0000515+antimiR-924组以及对照组细胞培养2周后,进行固定和结晶紫染色。最后,克隆形成数经显微镜分析。
1.2.5 划痕实验 在6孔板中,收集的sicirc_0000515组、miR-924、si-circ_0000515+antimiR-924组以及对照组细胞培养至细胞密度达到95%。随后,细胞单层经移液枪枪头划线,继续培养24 h。最后,迁移距离被分析使用显微镜。
1.2.6 Transwell实验 将si-circ_0000515组、miR-924、si-circ_0000515+anti-miR-924组以及对照组细胞收集并接种于小室的上室,培养48 h,下室加含20%胎牛血清的DMEM,多聚甲醛固定、结晶紫染色后,在显微镜下分析细胞侵袭能力。小室的上室加有Matrigel基质胶。
1.2.7 双荧光素酶报告实验 SKOV3细胞铺板后大约16 h(此时细胞密度应当在75%~90%左右),将WT-circ_0000515和MUT-circ_0000515采用脂质体转染法(转染miRNA模拟物不加P3000TM试剂)与miR-NC或miR-924 mimics共转染至细胞,48 h后收集并裂解以上转染细胞,根据荧光素酶检测盒说明将LAR I加到光度计管中,对光度计进行编程以分析酶活性。
1.2.8 Western blot 将各组SKOV3细胞用温的PBS冲洗3遍,加入RIPA裂解液,将细胞收集到EP管中,离心取上清,于沸水中孵育10 min,蛋白变性。将所有蛋白样品调至等浓度后,取40 μg蛋白进行SDS-PAGE(上样前将胶板下的气泡赶走),蛋白泳动至距胶下缘1 cm左右结束。将分离的蛋白凝胶转移至PVDF膜,将膜从电转槽中取出并稍加漂洗,牛血清白蛋白封闭PVDF膜(浸没于封闭液中摇荡1 h),加入E-cadherin、N-cadherin和GAPDH一抗,TBST洗涤,暗室内曝光显影。
1.3 统计学方法
这项研究的数据经SPSS 21.0统计学软件分析,以均数±标准差(±s)表示。2组间和多组间分别做独立样本t检验和单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 circ_0000515、miR-924在癌旁组织和卵巢癌组织中的表达
见表1。
表1 circ_0000515和miR-924的表达(±s ,n= 43)

表1 circ_0000515和miR-924的表达(±s ,n= 43)
注:与癌旁组织比较,# P<0.05
组织circ_0000515miR-924癌旁组织1.00±0.141.00±0.09卵巢癌组织4.77±0.32#0.33±0.04#
2.2 circ_0000515对SKOV3细胞增殖的影响
见表2。
表2 circ_0000515对SKOV3细胞增殖的影响(±s ,n= 9)

表2 circ_0000515对SKOV3细胞增殖的影响(±s ,n= 9)
注:与si-NC组比较,# P<0.05
?
2.3 下调circ_0000515表达对SKOV3细胞迁移、侵袭的影响
见图1、表3。
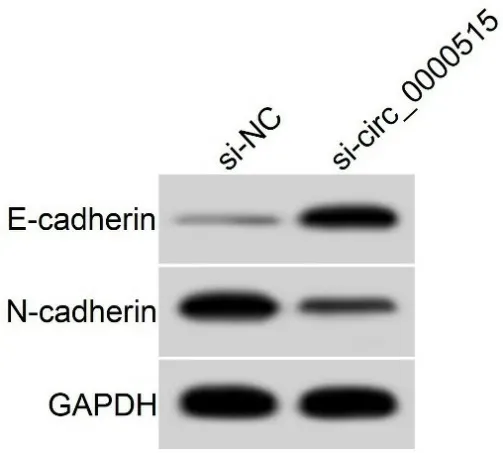
图1 下调circ_0000515表达对卵巢癌SKOV3细胞迁移、侵袭相关蛋白表达的影响
表3 下调circ_0000515表达对卵巢癌SKOV3细胞迁移、侵袭的影响(±s ,n= 9)

表3 下调circ_0000515表达对卵巢癌SKOV3细胞迁移、侵袭的影响(±s ,n= 9)
注:与si-NC组比较,# P<0.05
组别划痕愈合率/%侵袭细胞数/个E-cadherin蛋白N-cadherin蛋白si-NC组64.11±5.66116.93±11.050.17±0.020.68±0.05 si-circ_0000515组24.23±2.21# 50.91±4.96#0.57±0.04#0.24±0.03#
2.4 circ_0000515靶向miR-924
circ_0000515含有miR-924互补序列,见图2。荧光素酶活性值,见表4。circ_0000515调控miR-924的表达,见表5。
表4 荧光素酶活性值(±s,n= 9)

表4 荧光素酶活性值(±s,n= 9)
注:与miR-NC组比较,# P<0.05
组别WT-circ_0000515MUT-circ_0000515 miR-NC组0.96±0.060.99±0.07 miR-924组0.34±0.03#0.97±0.04
表5 circ_0000515调控miR-924的表达(±s ,n= 9)

表5 circ_0000515调控miR-924的表达(±s ,n= 9)
注:与pcDNA组比较,# P<0.05;与si-NC组比较,△P<0.05
组别miR-924 pcDNA组1.00±0.00 pcDNA-circ_0000515组0.45±0.05#si-NC组1.02±0.07 si-circ_0000515组3.09±0.30△
2.5 miR-924对SKOV3细胞增殖、迁移、侵袭的影响
见图3、表6。

图3 miR-924对SKOV3细胞迁移、侵袭相关蛋白表达的影响
表6 miR-924对SKOV3细胞增殖、迁移、侵袭的影响(±s ,n= 9)

表6 miR-924对SKOV3细胞增殖、迁移、侵袭的影响(±s ,n= 9)
注:与miR-NC组比较,# P<0.05;与si-circ_0000515+anti-miR-NC组比较,△P<0.05
N-cadherin蛋白miR-NC组1.00±0.000.86±0.0689.21±7.9367.08±5.08118.73±12.420.15±0.020.69±0.05 miR-924组3.28±0.31#0.44±0.05#52.37±5.10#32.58±3.17# 57.38±5.18#0.49±0.04#0.31±0.03#si-circ_0000515+anti-miR-NC组1.00±0.000.36±0.0339.29±3.6622.86±2.53 48.72±4.060.58±0.040.23±0.02 si-circ_0000515+anti-miR-924组0.41±0.04△0.73±0.06△79.22±6.43△55.34±4.67△ 99.45±7.35△0.28±0.03△0.59±0.04△组别miR-924OD值(450 nm)细胞克隆形成数/个划痕愈合率/%侵袭细胞数/个E-cadherin蛋白
3 讨论
circRNA不易被核酸外切酶降解,且具有序列保守性、表达稳定性等特点,表明circRNA可能作为疾病诊断标志物或治疗靶点,circRNA主要是由外显子组成,其可在卵巢癌发生及发展过程中发挥重要调控作用[7-8]。先前的研究已近证实了大多数的circRNAs可以调控卵巢癌细胞进展通过靶向miRNA/mRNA轴[9-10]。
circ_0000515在宫颈癌组织和细胞中高表达,circ_0000515沉默限制宫颈癌细胞侵袭,增加细胞凋亡率[11]。circ_0000515是一种新型环状RNA,其在乳腺癌组织中上调表达,沉默circ_0000515可减弱乳腺癌细胞的增殖和侵袭[12]。然而circ_0000515对卵巢癌细胞生物学行为的影响尚未可知。此工作证实circ_0000515在卵巢癌组织中低表达,circ_0000515沉默抑制卵巢癌细胞增殖。N-cadherin在卵巢癌中表达上调,而E-cadherin表达下调,进而促进上皮-间质转化(epithelial-mesenchymal transition, EMT)最终促使细胞转移[13-14]。本研究证实circ_0000515沉默减少N-cadherin蛋白水平,增加E-cadherin表达。此外卵巢癌细胞划痕愈合率和侵袭细胞数在circ_0000515敲低后被抑制。本研究进一步证实circ_0000515与miR-924存在靶向调控关系。研究表明,miR-924抑制肝细胞癌细胞迁移及侵袭[15]、抑制胃癌和肝癌细胞的增殖[16-17]。此工作证实了miR-924可以削弱卵巢癌细胞的增殖、迁移及侵袭。而且circ_0000515对卵巢癌细胞生长及运动的促进作用涉及其对miR-924靶向调节。
综上所述,circ_0000515/miR-924分子轴在卵巢癌细胞生长及转移过程中可发挥重要调控作用。但仍需进行体内实验验证circ_0000515/miR-924分子轴对卵巢癌移植瘤生长的影响。

