G6P[1]型牛轮状病毒的分离培养及鉴定
王铭月,张锦华,章 青,孔翔羽,王 宏,孙晓曼,李丹地,庞立丽,段招军
轮状病毒(rotavirus, RV)属于光滑呼肠病毒科(Sedoreoviridae),轮状病毒属[1]。轮状病毒是一种双链RNA病毒(double-stranded RNA, dsRNA),是引起婴幼儿和多种幼龄动物腹泻的重要病原体。其基因组包含了11个双链RNA,VP1-VP4、VP6和VP7为RV的6个结构蛋白,NSP1-NSP6为RV的6个非结构蛋白[2]。根据VP6可分为9组RV(A组~D组,F 组~ J组),其中A、B、C及H组能感染人和动物[3-5]。根据VP7和VP4可分为不同的G型和P型[6]。迄今为止,已经鉴定出42种G型和58种P型。
据报道,牛轮状病毒(Bovine Rotavirus,BRV)是引起新生小牛腹泻的重要原因,特别是30日龄以下的犊牛。在全世界,A组牛轮状病毒感染牛群发病率和病死率很高[2-4,6-7]。2006年,栾婧婧等[8]报道从山东腹泻牛群中分离到G6型RV。在2012年,我国黑龙江齐齐哈尔就有在牛的粪便中检测到G6P[1]型RV的报道[9]。而在2013年Doan研究发现G6P[1]型BRV直接感染人类儿童并引起腹泻疾病[10]。2021年,在我国河北某牛场的粪便中也发现了G6P[1]型RV[11]。这些说明G6P[1]型BRV在我国也存在流行,且有可能对儿童也有致病性,在我国对于G6P[1]型的研究报道较少,对该型的BRV研究受到极大的限制,因此掌握BRV基因型是非常有必要的,这有利于疫苗研究以及对BRV的防控。
本研究将河北卢龙某牛场的犊牛的腹泻粪便标本在MA104细胞上进行分离培养,成功分离到一株BRV。对该分离株的VP7、VP4片段进行扩增,通过测序和序列分析,确定该毒株为G6P[1]型BRV;通过噬斑纯化法、聚丙烯酰胺凝胶电泳法(PolyacrylamineGel Electrophoresis,PAGE)、Real-time PCR和电镜(Transmission Electron Microscope,TEM)等技术进行鉴定;观察其细胞病变(cytopathic effect,CPE)和生长曲线,为研究G6P[1]型轮状病毒及其他基因型轮状病毒的病原学特征提供实验基础和技术参考。
1 材料及方法
1.1 样本及细胞 河北省卢龙县某牛场2009-2013年的犊牛粪便样本。MA104细胞由中国疾病预防控制中心病毒病预防控制所腹泻室培养并保存。
1.2 主要试剂 DMEM培养基,Gibco,美国; Trypsin(不含EDTA),Gibco,美国;FBS,Gibco,美国;2×MEM,ABI,美国;SeaPlaque,Lonza,瑞士;中性红溶液(0.33%),SIGMA-ALDRCH,美国;Real-time PCR Kit,Thermofisher,德国;One-Step RT-PCR Kit,QIAGEN,德国。
1.3 样本处理 将MA104细胞以6×105个细胞接种于转管,于37 ℃,5% CO2培养箱孵育3 d。用无菌PBS制备10%的便悬液,转速8 000 g离心10 min,用0.45 μm滤器过滤上清液除菌。取过滤液,加入胰酶(终浓度15 μg/mL),37 ℃孵育1 h。去除转管中的细胞维持液,添加0.2 mL胰酶消化过的粪便标本液,37 ℃孵育2 h,用2 mL维持培养液清洗细胞,每个转管添加2 mL含有20 μg/mL胰酶的维持培养液,之后将旋转管重新安置在仪器固定架上,37 ℃旋转培养。每日观察CPE,第4 d收获(命名为BLL)。
1.4 病毒核酸提取和G/P分型检测 取200 μL病毒放入自动化提取仪器中,提取RNA。用One-Step RT-PCR Kit 对VP4、VP7基因序列进行PCR扩增,PCR程序:50 ℃,30 min; 95 ℃,15 min;94 ℃,30 s;42 ℃,30 s;72 ℃,1 min;72 ℃,7 min;第3步到第5步25个循环。引物合成由北京擎科生物科技有限公司完成,RT-PCR 轮状病毒 G/P分型引物序列:VP4F:TAT GCT CCA GTN AAT TGG;VP4R:ATT GCA TTT CTT TCC ATA ATG;VP7F:ATG TAT GGT ATT GAA TAT ACC AC;VP7R:AAC TTG CCA CCA TTT TTT CC。经1.5%琼脂糖凝胶电泳验证后,将RT-PCR产物送北京擎科生物有限公司测序,再使用在线工具Rota CV2.0进行基因分型。
1.5 BLL毒株在MA104细胞中的培养及传代 感染前1 d将MA104细胞以1×107个细胞密度接种于T75培养皿,细胞生长液为10%胎牛血清(FBS)的DMEM培养基。将BLL毒株常温下融化,加入10 μg/mL胰酶活化病毒,37 ℃孵育1 h。用DMEM培养基清洗3遍细胞,加入活化好病毒,并用含5 μg/mL胰酶的DMEM维持液补液到5 mL;阴性对照组加入同样剂量10 μg/mL胰酶的DMEM,并用含5 μg/mL胰酶的DMEM维持液补液到5 mL,放入CO2培养箱吸附1 h。1 h后,向培养皿中补充含5 μg/mL胰酶的DMEM维持液到15 mL。放入温箱,观察CPE,90%CPE时细胞脱落,即可收取病毒并用0.22 μm滤膜过滤,-80 ℃冻存。
1.6 病毒的噬斑纯化 感染前3 d将MA104细胞以3×105个细胞密度接种于6孔板上,取BLL毒株收获液加入胰酶(终浓度10 μg/mL),37 ℃孵育1 h。进行10倍倍比稀释至108倍,将稀释度为103~108的病毒液接种至长有MA104细胞的6孔板上。病毒孵育2 h后,弃液,浸洗细胞3遍。加热2×MEM到37 ℃。微波融化灭菌的1.2%琼脂糖,让琼脂糖在55 ℃的水浴中冷却。将预热2×MEM和1.2%的琼脂糖同等体积混合,然后加入胰蛋白酶终浓度为0.5 μg/mL。混匀后加入至各孔中。凝固后,将6孔板倒置,放入37 ℃,5% CO2培养箱孵育,24 h后观察病毒生长情况。第4 d,用中性红染色,将斑块抠出,放至EP管中并加入200 μL PBS溶液。将分出的病毒样本液震荡混匀,-80 ℃冻融3遍,放入离心机离心,4 ℃,14 000 r/min,10 min。收集上清液,将该上清液做为继续纯化的样本,纯化3代。将其放大培养,并连续传代。
1.7 BLL毒株VP4、VP7序列进行系统进化分析 BLL毒株提取核酸后,将RT-PCR产物送北京擎科生物有限公司测序。测序结果使用Seqman软件进行序列拼接,利用Blast在线工具进行同源性分析,用MEGA11进行序列分析并绘制进化树,参考毒株序列均来自GenBank,采用邻接法(NJ)建树,1 000个重复自抽样法(BS)分析评估NJ树的节点可靠性。
1.8 BLL毒株鉴定及生长曲线测定 通过透射电镜观察病毒颗粒,将病毒培养物离心,8 000× g,30 min。再将上清液离心,100 000× g,2 h以浓缩病毒。然后用磷钨酸阴性染色,在透射电镜下观察病毒。利用聚丙烯酰胺凝胶电泳对分离得到的BLL毒株进行鉴定,取200 μL BLL病毒液放入自动化提取仪器中,提取RNA。并进行10%聚丙烯酰胺凝胶电泳,90 V,6 h条件下分离。经银染色液染色后观察结果。绘制生长动力曲线观察BLL毒株扩增特性,用BLL毒株感染MA104细胞单层,感染复数(Multiplicity of Infection,MOI)为0.2。分别在0 h,6 h,12 h,24 h,36 h,48 h,72 h收取孔板,反复冻融3次,取200 μL冻融液放入自动化提取仪器中,提取RNA。配制反应体系,正向引物为Rota NVP3-F,反向引物为Rota NVP3-R,探针为TagMen probe[12]。进行Real-time PCR,程序为:45 ℃,10 min;95 ℃,10 min;95 ℃,15 s;60 ℃,45 s;第3步到第4步40个循环。制作标准曲线,生成生长动力学曲线。
2 结 果
2.1 病毒核酸提取和G/P分型检测结果 经北京擎科生物有限公司测序后,使用Seqman软件进行序列拼接,使用在线工具Rota CV2.0和Blast分析后,BLL毒株属于G6P[1]型牛轮状病毒。
2.2 BLL毒株在MA104细胞中的培养及传代结果 MA104细胞在接种了BLL毒株24 h后出现了明显的病变,主要表现为细胞变细长,聚堆并且出现拉网现象,随着时间的延长细胞出现脱落见图1A,在48 h时细胞完全脱落。而对照组MA104细胞呈单层致密状,饱满透亮,形状细小呈米粒状见图1B。

图1 MA104 病变图(A)和对照(B)(×200)Fig.1 Cytopathic effect CPE of MA104(A)and control (B)(×200)
2.3 轮状病毒噬斑纯化结果 噬斑试验结果显示,BLL毒株在MA104细胞上形成典型噬斑,形态为圆形或类圆形,边缘整齐,清晰透明;且随着病毒稀释度的增加,噬斑的数量逐渐减少,见图2。挑取最高稀释度形成的单个噬斑,扩培养后,如此重复克隆3次,挑选第3次克隆病毒滴度最高的克隆毒株放大培养,获得高滴度单克隆毒株。

图2 BLL毒株在MA104细胞上形成对照(A)和噬斑(B)Fig.2 Plaque formation by the strain BLL on control(A)and MA104 cells (B)
2.4 BLL病毒VP7核苷酸同源性及系统进化分析结果 本次VP7的PCR产物长822 bp,经核苷酸同源性分析,BLL-VP7核苷酸编码区与其他G6型毒株核苷酸同源性均在95%以上,其中与RVA/Bovine-tc/JPN/Shimane/xxxx/G6P1 、RVA/Cow-wt/HB01/China/2021/G6P1以及RVA/Cow-tc/JPN/BRV101/1985-1986/G6P1同源性最高均为99.88%,其次与RVA/Horse-wt/IND/ERV2/2015/G6P1同源性为99.76%。从进化树(图3)中可以看出BLL与RVA/Cow-tc/JPN/BRV101/1985-1986/G6P1、RVA/Human-tc/ISR/Ro8059/1995/G6P1、RVA/Cow-wt/HB01/China/2021/G6P1以及RVA/Bovine-tc/JPN/Shimane/xxxx/G6P1在同一分支上,其中与RVA/Bovine-tc/JPN/Shimane/xxxx/G6P1 和RVA/Bovine-tc/CHN/HLJ3409/2017/G6P1毒株在进化树上最为接近,表明他们亲缘关系最近。

图3 BLL病毒VP7基因进化树分析Fig.3 Phylogenetic tree of BLL based on partial VP7 sequences
2.5 BLL病毒VP4核苷酸同源性及系统进化分析结果 本次VP4的PCR产物长644 bp,将BLL-VP4核苷酸序列与不同基因型的RV毒株VP4核苷酸编码区进行同源性分析,BLL处于P[1]的分支,与其他P[1]型毒株核苷酸同源性在93%以上,其中与RVA/Human-tc/ISR/Ro8059/1995/G6P[1]毒株核苷酸同源性最高为99.84%,其次与RVA/Bovine-tc/JPN/Shimane/xxxx/G6P[1]和RVA/Cow-tc/JPN/BRV101/1985-1986/G6P [1]同源性均为99.53%。从进化树(图4)中也可以看出BLL与RVA/Bovine-tc/JPN/Shimane/xxxx/G6P[1]毒株最为接近,且与RVA/Human-tc/ISR/Ro8059/1995/G6P[1]和RVA/Cow-tc/JPN/BRV101/1985-1986/G6P[1]处于同一分支,表明他们亲缘关系近。

图4 BLL病毒VP4基因进化树分析Fig.4 Phylogenetic tree of BLL based on partial VP4 sequences
2.6 电镜检测结果 通过电镜可以观察到完整的轮状病毒颗粒,具备典型的车轮样,轮廓清晰,直径大小在75 nm左右,符合RV大小,见图5。

图5 BLL毒株的电镜观察Fig.5 Morphology of the BLL strain, determined by transmission electron microscopy
2.7 PAGE银染法鉴定结果 BLL毒株的电泳图型为独特的A组轮状病毒11条带排列方式4∶2∶3∶2。4个高分子量的dsRNA节段(基因片段1-4);5个中等大小的节段(基因片段5-9),其中7-9片段在一起形成一个特征性的三体,不容易分辨;2个小节段(基因片段10-11),见图6。
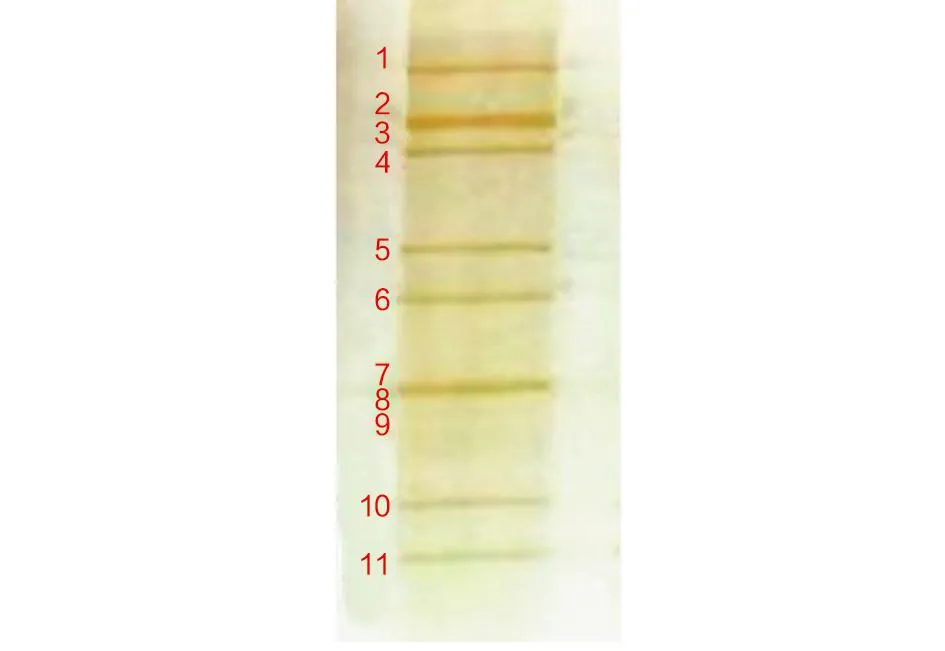
图6 BLL毒株RNA-PAGE基因组的核酸带型Fig.6 PAGE map of viral dsRNA extracted from the strain BLL
2.8 BLL毒株生长动力学曲线 Real-time PCR 标准曲线,斜率为-3.794,R2为0.996,符合标准曲线要求。在感染后0 h、6 h、12 h、24 h、36 h、48 h和72 h冻融细胞进行Real-time PCR检测,检测结果表明,BLL毒株在6 h就出现了扩增,病毒复制在前36 h时处于增长阶段,前24 h增长速率明显较高,24~36 h时增长速率趋于缓和,在36 h时病毒RNA量达到高峰,最高载量为1.54×108拷贝/mL,(见图7)。

图7 BLL毒株一步生长曲线Fig.7 One-step growth curve of BLL
3 讨 论
RV包含外层、内层和核心衣壳3层衣壳蛋白,核心衣壳内包含了病毒基因组11个dsRNA片段。RV外层衣壳蛋白即VP7和VP4,VP7蛋白与RV病毒组装有关,在内质网中存量较多,VP4在蛋白酶的催化下会裂解,从而提高病毒对宿主细胞的吸附力[13-15]。在本研究中,从BLL毒株的VP7、VP4测序结果来看,属于A组轮状病毒中的G6P[1]牛轮状病毒,PAGE胶结果也验证了BLL毒株属于A组轮状病毒。经噬斑纯化后,从G6P[1]病变结果来看,G6P[1]病毒致细胞出现病变时间较早。从生长曲线来看,G6P[1]在36 h病毒RNA含量最高。电镜结果也显示G6P[1]具有典型的车轮样外形,大小在75 nm左右,符合RV大小。BRV具有变异快,基因型复杂的特点。我国已报道了G6P[1]、G10P[11]、G6P[5]型BRV的分离鉴定[7-8,16-20]。也有文献表明并非所有牛轮状病毒总是对人类宿主自然减毒[10]。我国G6P[1]型轮状病毒中2012年的HQ09毒株[9]和2021年的HB01毒株[11]与本研究的BLL毒株感染MA104细胞病变情况大致相同,但BLL毒株出现病变的时间较快,在24 h后就会出现;其他两个毒株一般在48 h后出现。因此我们认为BLL毒株的致细胞病变效应速度较其他两株G6P[1]型毒株快。而从VP4和VP7进化树结果来看,HQ09毒株与同为G6P[1]型的标准株NCDV、山东株CHLY的亲缘关系较近;HB01毒株与NCDV亲缘关系较近,而本实验室的BLL毒株与日本的Shimane毒株和以色列的Ro8059毒株亲缘关系较近,推测BLL毒株与我国这两株G6P[1]型毒株的来源可能不同,由于BLL毒株与以色列的Ro8059毒株亲缘关系较近,而Ro8059毒株又有感染人的记录,本毒株虽为BRV但也有潜在的感染婴幼儿的风险。
综上所述,本研究成功对G6P[1]牛轮状病毒进行分离鉴定和序列分析研究,对防控该型BRV的传播提供参考,对相应的疫苗研究具有重要意义,为研究G6P[1]型轮状病毒及其他基因型轮状病毒的病原学特征和分子流行病学提供实验基础和技术参考。
利益冲突:无
引用本文格式:王铭月,张锦华,章青,等.G6P[1]型牛轮状病毒的分离培养及鉴定[J].中国人兽共患病学报,2024,40(2):134-139. DOI:10.3969/j.issn.1002-2694.2024.00.019

