低酸泡菜发酵乳酸菌与酵母菌筛选及其共发酵研究
陈骏飞,唐 蓉,王 晖,刘毕琴,汤回花,李 宏,史 巧*
(1.云南省农业科学研究院 农产品加工研究所,云南 昆明 650223;2.云南农业大学 食品科学技术学院,云南 昆明 650201)
泡菜是中国传统的发酵食品之一,是将蔬菜浸泡在盐溶液中,然后经过乳酸发酵而成[1]。芥菜发酵后有一种特殊鲜味和香味,且含有天然的乳酸菌及其代谢产物,能促进胃、肠消化功能,帮助消化,增进食欲,深受广大消费者喜爱[2-3]。我国发酵芥菜的工艺较复杂,大多工业化生产仍然是采用高盐自然发酵,成品品质参差不齐,风味质量不稳定[4-5]。
芥菜发酵过程中微生物的种类和数量不断变化,主要为乳酸菌、醋酸菌和酵母菌等[6]。发酵前期以肠膜明串珠菌(Leuconostoc mesenteroides)、魏斯氏菌(Weissellasp.)等异型发酵乳酸菌为主,与同型乳酸菌相比,它们发酵产酸能力相对较弱,适用于低酸泡菜发酵[7],且能将大量有机物分解产生CO2、甘露醇和乙醇等含酸较少的代谢产物,赋予泡菜清爽的味道,提升泡菜风味[8-9]。为了提高泡菜的感官品质,选择合适的异型发酵乳酸菌启动发酵是必要的。除此之外,酵母菌也是泡菜中常见的微生物类群,广泛存在于蔬菜发酵阶段,能产生醇类、酯类等风味物质,赋予泡菜独特的醇香和酯香等香气成分[6,10]。特定酵母菌在较酸的环境下可更大程度的利用可发酵糖,并能代谢利用乳酸,有效防止泡菜过酸[11-14]。已有研究用植物乳杆菌(Lactobacillus plantarum)和酿酒酵母(Saccharomyces cerevisiae)共发酵白菜缩短了发酵周期,提高了食用安全性[15],但对泡菜发酵菌剂的筛选主要还是集中在乳酸菌上,利用酵母菌或乳酸菌与酵母菌共发酵的研究仍较少。
本研究以分离自不同发酵蔬菜中的乳酸菌及酵母菌为研究对象,通过比较产酸、耐酸、耐盐等耐受性指标及发酵特性筛选出性能较好的异型发酵乳酸菌和酵母菌组合发酵芥菜,并对发酵过程的理化指标进行检测,得到较优的共发酵菌株组合,以期能够应用于泡菜工业化接种强化发酵,提高产品风味及品质,为高品质泡菜的工业化生产菌剂提供更多的选择。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
新鲜芥菜:云南昆明菜市场。本研究所用乳酸菌(L1~L6)及酵母(M1~M6)菌株均从云南不同发酵蔬菜样品中分离纯化所得,于-80 ℃保存,具体信息见表1。

表1 乳酸菌和酵母菌的来源及鉴定结果Table 1 Sources and identification results of lactic acid bacteria and yeasts
1.1.2 试剂
盐酸、乳酸、氢氧化钠、氯化钠、乙酸锌、酚酞、亚铁氰化钾、硫酸锌、亚硝酸钠(均为分析纯):天津市致远化学试剂有限公司。
1.1.3 培养基
MRS培养基、孟加拉红固体培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
HR/T20MM冷冻离心机:湖南赫西仪器装备有限公司;CJ-2S超净工作台:天津市泰斯特仪器有限公司产品;WPL-125BE电热恒温培养箱:天津泰斯特设备有限公司;ZQZY-88AV全温振荡培养箱:上海知楚仪器有限公司;Multiskan GO酶标仪:美国Thermo公司;Sartorius PB-10型pH计:上海珂淮仪器有限公司。
1.3 方法
1.3.1 耐受性分析
耐酸性测试:吸取活化后的乳酸菌和酵母菌菌液(OD600nm值=1.0)以1%(V/V)的接种量分别接种于pH为3.0、3.5、4.0、4.5、5.0和5.5的MRS液体培养基和YPD液体培养基中,乳酸菌于37 ℃静置培养,酵母菌于30 ℃、225 r/min条件下培养24 h,测定菌液的OD600nm值。
耐盐性测试:吸取活化后的乳酸菌和酵母菌菌液(OD600nm值=1.0)以1%(V/V)的接种量分别接种于NaCl含量为2%、4%、6%、8%、10%和12%的MRS液体培养基和YPD液体培养基中,乳酸菌于37 ℃静置培养,酵母菌于30 ℃、225 r/min条件下培养24 h,测定菌液的OD600nm值。
1.3.2 乳酸菌产酸性能测试
吸取活化后的乳酸菌菌液(OD600nm值=1.0)以1%(V/V)的接种量接种于MRS液体培养基中,于37 ℃静置培养,每4 h取样测定总酸含量。
1.3.3 酵母菌产气、产璞测试
产气:采用杜氏小管发酵法[13]。吸取酵母菌菌液(OD600nm值=1.0)以1%(V/V)的接种量接种于YPD液体培养基中,30 ℃静置培养24 h后,观察杜氏小管中有无气泡产生。
产璞:吸取活化后的酵母菌菌液(OD600nm值=1.0)以1%(V/V)的接种量接种于YPD液体培养基中,30 ℃静置培养24 h后,观察试管中的培养基表面是否产生白膜。
1.3.4 芥菜发酵
发酵剂制备:从-80 ℃冰箱中取出菌株,乳酸菌于MRS液体培养基37 ℃静置培养;酵母菌于YPD液体培养基30 ℃、225 r/min摇床培养,均活化2代后生长到对数生长期,备用。将活化好的菌液于6 000 r/min离心10 min,弃去上清液,用无菌生理盐水重复洗菌体3次,收集菌体。最后悬浮于同体积的无菌生理盐水中,制成菌悬液作为母发酵剂。
芥菜发酵:将新鲜芥菜用清水洗干净、切分后,用体积分数为75%的食品级酒精浸泡10 min,用无菌水冲洗去除酒精,按芥菜与水质量体积比2∶3(g∶L)加入泡菜水(含2%白砂糖和3%食盐的矿泉水),接种2%的乳酸菌和2%的酵母菌,使乳酸菌终浓度>106CFU/g泡菜,酵母菌终浓度>105CFU/g泡菜,混合1 min后置于30 ℃恒温发酵,以不接菌的自然发酵组(ZR)为对照,每个试验作3个平行。
1.3.5 测定方法
pH的测定:采用pH计;总酸含量的测定:参照国标GB 12456—2021《食品安全国家标准食品中总酸的测定》第一法酸碱指示剂滴定法;亚硝酸盐含量的测定:参照国标GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐与硝酸盐的测定》第二法分光光度法。活菌数的测定[16]:取泡菜汁液稀释涂布于MRS固体培养基,37 ℃恒温培养2 d后进行乳酸菌计数;取泡菜汁液稀释涂布于孟加拉红固体培养基,30 ℃恒温培养2 d后进行酵母菌计数。
感官评定:选择12名经过专业培训的人员,采取盲评模式分别对泡菜的色泽、质地、香气和滋味进行评分,满分为100分,去除最高分和最低分后,取平均分为发酵芥菜最后的得分。具体感官评分标准见表2[17]。
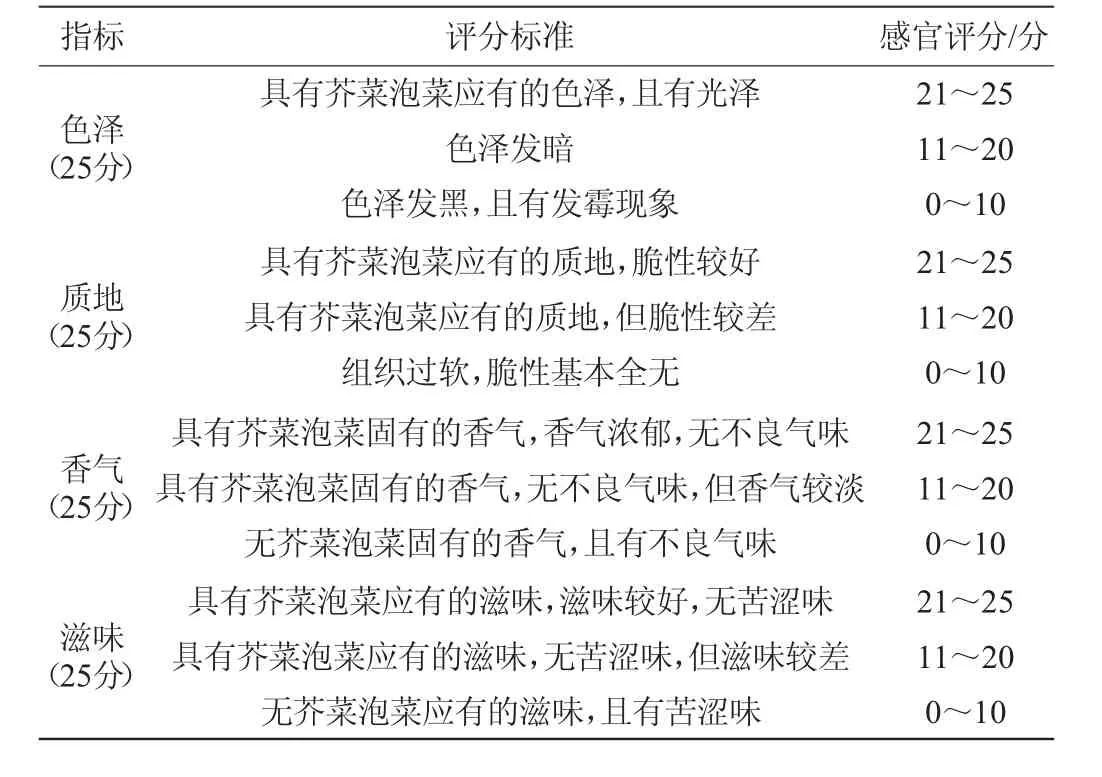
表2 泡菜的感官评价标准Table 2 Sensory evaluation criteria of paocai
1.3.6 数据处理
通过Graphpad Prism8.4.3软件绘图;每个试验设三个平行,使用IBM SPSS Statistics26进行显著性检验,结果以“平均值±标准差”表示。
2 结果与分析
2.1 乳酸菌的耐受性及产酸性能分析
2.1.1 耐酸性分析
乳酸含量对乳酸菌生长活性具有较大影响,异型发酵乳酸菌可以产生甘露醇等风味物质,增加异型发酵乳酸菌的存活时间有利于提高泡菜的感官品质[18]。6株乳酸菌的耐酸能力见图1。
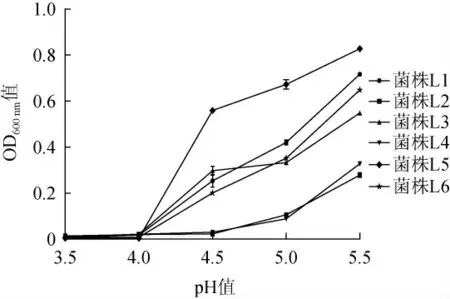
图1 不同pH条件下乳酸菌的生长情况Fig.1 Growth of lactic acid bacteria at different pH
由图1可知,随着培养基pH值的降低,6株乳酸菌的生长均受到不同程度的抑制,耐酸性差异较为明显。所有菌株在pH值为5.5时OD600nm值最大,pH≤4时几乎没有菌株生长。其中,菌株L2和L4在不同pH条件下的生长情况趋于一致,耐酸性均较弱;菌株L5在pH值为4.5~5.5之间的OD600nm值均高于其他菌株,说明耐酸性较好。与赵山山等[19]从贵州泡菜中分离的乳酸菌耐酸性相比,本研究所用乳酸菌均为异型发酵乳酸菌,所以整体耐酸性较差。
2.1.2 耐盐性分析
盐含量对泡菜发酵过程中微生物数量的影响较大[20]。6株乳酸菌的耐盐能力见图2。由图2可知,随着NaCl含量的增加,6株乳酸菌的生长不同程度地受到抑制,当NaCl含量达到10%及以上时,没有菌株能够生长;当NaCl含量在2%~4%之间时,菌株L2和L4的OD600nm值随NaCl含量变化较大,抑制较为明显;菌株L1和L5的OD600nm值随NaCl含量变化较小,生长能力保持了比较稳定的趋势,耐盐性能较好。黄道梅等[21]研究也证明乳酸菌受盐度影响较大,提高食盐含量抑制了乳酸菌的生长。
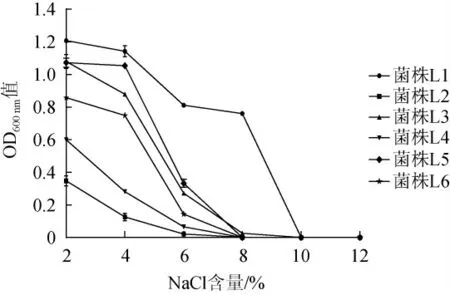
图2 不同NaCl含量下乳酸菌的生长情况Fig.2 Growth of lactic acid bacteria at different NaCl concentrations
2.1.3 产酸性能研究
泡菜发酵前期的乳酸菌产酸速度过快、产生的酸性物质过多会抑制乳酸菌自身及共发酵酵母菌的生长、繁殖[22]。因此,考察6株乳酸菌的产酸性能,结果见图3。
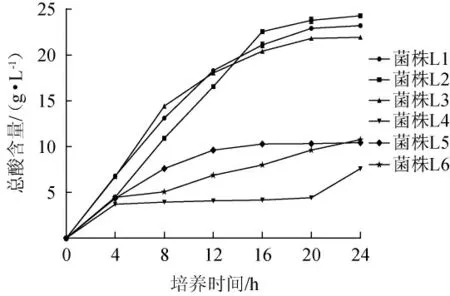
图3 不同乳酸菌的产酸情况Fig.3 Acid production of different lactic acid bacteria
由图3可知,6株乳酸菌在生长代谢期间的总酸含量均处于增长趋势,菌株L1、L2和L3的总酸含量增加较快,菌株L4、L5和L6的总酸含量增加较慢。其中,菌株L2的产酸能力最强,培养24 h时的总酸含量达到(24.58±0.08)g/L;菌株L4的产酸能力最弱,培养24 h的总酸含量仅为(7.60±0.05)g/L。
综上,菌株L5在pH 4.5和4%NaCl含量下耐受性较好且24 h产酸量较少,所以选择菌株L5进行后续实验。
2.2 酵母菌的耐受性及发酵性能分析
2.2.1 耐酸性分析
真菌群落受酸度影响较大,大多数真菌的耐酸性较差[20],为得到适合作为蔬菜发酵剂的优良酵母菌,以耐酸作为酵母菌的初步筛选指标之一。6株酵母菌株的耐酸性见图4。由图4可知,当pH为5.5时,所有菌株生长良好,随着pH值降低,菌株的生长均受到抑制;当pH为4.0时,菌株M1、M2、M3和M4生长良好,菌株M5、M6受抑制较明显;当pH为3.5时,菌株M5、M6则不能生长,菌株M1耐酸性最好。
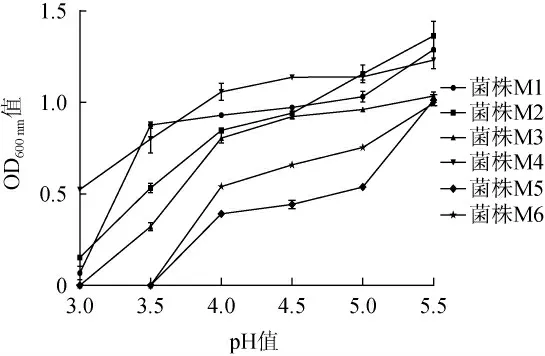
图4 不同pH下酵母菌的生长情况Fig.4 Growth of yeasts at different pH
2.2.2 耐盐性分析
6株酵母菌的耐盐性测定结果见图5。由图5可知,菌株M3、M5和M6在NaCl含量为6%时生长能力明显下降,当NaCl含量增大到10%时不能生长;菌株M1、M2和M4在NaCl含量在2%~6%时生长较好,NaCl含量增大到8%时生长能力下降明显,当NaCl含量增大到12%时不能生长。结果表明,菌株M1、M2和M4的耐盐性相对较好。
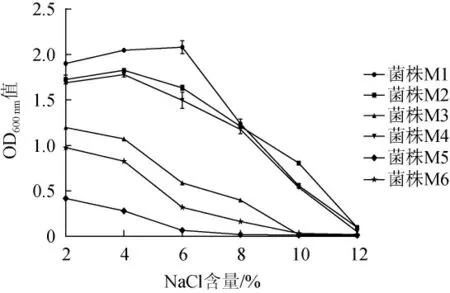
图5 不同NaCl含量下酵母菌的生长情况Fig.5 Growth of yeasts at different NaCl concentrations
2.2.3 发酵性能分析
一些酵母菌在发酵过程中产气、产璞不仅会影响产品的外观,也会破坏发酵蔬菜质地,从而影响发酵产品口感[13]。因此,对6株酵母菌的产气、产璞情况进行测定,结果见表3。由表3可知,菌株M5产气严重且少量产璞,菌株M3少量产气不产璞,菌株M1、M2、M4和M6既不产气也不产璞。

表3 酵母菌的产气/产璞能力Table 3 Gas producing and film producing capacity of yeast
综上,菌株M1、M2和M4在pH 4.0和4%NaCl含量下耐受性较好且不产气、不产璞,所以选择菌株M1、M2、M4分别与菌株L5进行组合发酵芥菜。
2.3 乳酸菌与酵母菌共发酵芥菜组合筛选
2.3.1 pH和总酸含量的变化
pH值和总酸含量是泡菜发酵程度的两个重要指标,对微生物生长和代谢产物形成具有重要影响[23]。一般认为低酸发酵蔬菜总酸含量(以乳酸计)低于0.3 g/100 g,味道微酸、脆嫩、清香,且含有丰富的活性乳酸菌[7]。芥菜发酵过程中pH和总酸含量的变化见图6。
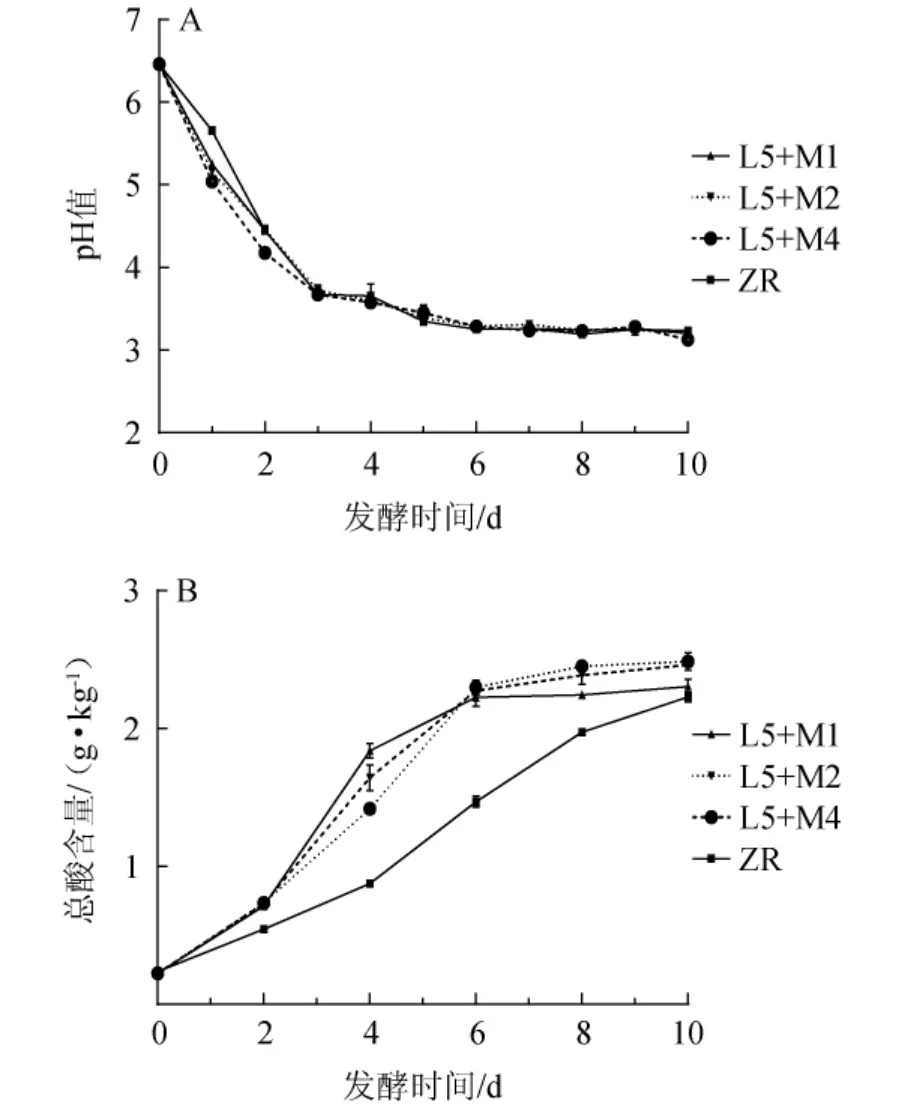
图6 芥菜发酵过程中pH(A)及总酸含量(B)的变化Fig.6 Changes in pH(A)and total acid(B)during mustard fermentation
由图6可知,在发酵0~3 d,各组pH均急速下降,发酵第5天开始趋于稳定,发酵结束时没有显著差异(P>0.05)。整个发酵过程中各组的总酸含量均逐渐增加,自然发酵组总酸含量最低,但一直处于上升趋势,发酵并未完成。菌株L5和M1共发酵芥菜第4天时总酸含量最高[(1.84±0.03)g/kg],发酵6~10 d增加较为缓慢,发酵结束时总酸含量低于其他接菌发酵组,仅为(2.30±0.03)g/kg。与李文青等[24]用肠膜明串珠菌单独发酵的泡菜(发酵9 d总酸含量超6 g/kg)相比,本研究添加酵母菌发酵所得的泡菜总酸含量较低,均达到低酸泡菜标准[7]。
2.3.2 活菌数的变化
乳酸菌数量的增加会使pH值降低和总酸含量增加,同时乳酸菌的生长随着产酸量的增加而受到抑制[25]。各组芥菜发酵过程中乳酸菌及酵母菌活菌数的变化见图7。

图7 芥菜发酵过程中乳酸菌(A)及酵母菌(B)活菌数的变化Fig.7 Changes in viable count of lactic acid bacteria(A)and yeast(B)during mustard fermentation
由图7A可知,整个发酵过程中,乳酸菌活菌数均呈先增加后减少的趋势,接菌发酵组均在发酵第4天时达到最高,其中菌株L5和M2共发酵组的乳酸菌活菌数最高,为(7.59±0.08)lg(CFU/mL),自然发酵组在第6天时乳酸菌活菌数最高达(7.86±0.03)lg(CFU/mL);发酵结束时菌株L5和M1共发酵组的乳酸菌活菌数[(5.71±0.02)lg(CFU/mL)]显著低于其他三组(P<0.05),可能是因为酵母菌在泡菜中生长代谢与乳酸菌竞争营养成分,一定程度上抑制了乳酸菌的生长。
由图7B可知,菌株L5和M1共发酵组的酵母菌活菌数呈先增加后减少的趋势,发酵第2天时酵母活菌数最多,为(5.33±0.01)lg(CFU/mL),随后开始下降,发酵结束时酵母活菌数为(2.41±0.06)lg(CFU/mL);其他两个接菌发酵组的酵母菌活菌数变化趋于一致,随着发酵时间急剧下降,发酵4~10 d均未检测到酵母活菌;自然发酵组整个发酵过程均未检测到酵母活菌。发酵过程中微生物的多样性、生长和存活取决于对食物生化和物理条件的耐受和反应,以及在食物微环境中适应和生存的能力[26-27]。酵母菌M2和M4在培养基中耐酸性较好,但在泡菜中耐酸性较差可能是因为泡菜水中的营养成分没有培养基丰富,且乳酸菌生长代谢产生的物质对其也会有一定的抑制作用。
2.3.3 亚硝酸盐含量的变化
由图8可知,各组“亚硝峰”都出现在发酵第2天,其中自然发酵组最高为(6.30±0.04)mg/kg,菌株L5和M1共发酵组含量最低为(2.26±0.04)mg/kg,整个发酵过程的亚硝酸盐含量均远低于GB 2762—2017《中国食品安全国家标准食品中污染物限量》中规定的腌渍蔬菜亚硝酸盐标准(不超过20 mg/kg);菌株L5和M1共发酵组发酵结束时的亚硝酸盐含量仅为(1.35±0.02)mg/kg,显著低于自然发酵和菌株L5和M2共发酵组(P<0.05),但与菌株L5和M4共发酵组无显著差异(P>0.05),安全性较高。本研究发酵过程中亚硝酸盐含量均很低,可能是因为对芥菜进行了减菌处理,且乳酸菌发酵快速酸化,抑制了有害菌的生长代谢和亚硝酸盐的产生[28-29]。
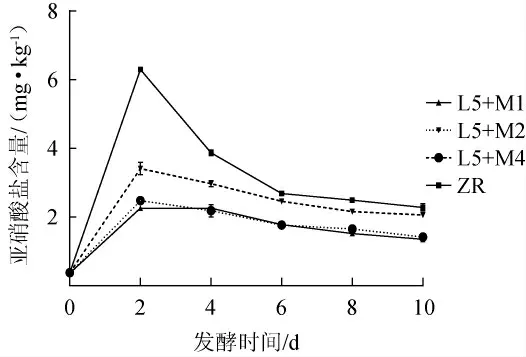
图8 芥菜发酵过程中亚硝酸盐含量的变化Fig.8 Changes in nitrite content during mustard fermentation
2.3.4 感官评分的变化
酵母菌发酵蔬菜可以产生有机酸、醇类、酯类、氨基酸类等物质,而且生成的醇类还可以与有机酸形成酯类,共同增加泡菜的风味[30]。泡菜发酵10 d后进行感官评定,结果见表4。由表4可知,自然发酵组芥菜未发酵成熟,色泽偏绿,无泡菜香味且有生涩味,总体评分较低,感官评分为(61.17±2.34)分;菌株L5和M1共发酵芥菜的颜色透亮、有光泽,有独特的坛香味,香气浓郁且纯正,脆度高,品质均一;色泽(22.08±0.86)分、质地(21.75±0.83)分、香味(20.08±0.76)分、滋味评分(21.08±1.11)分和总评分(85.00±2.12)分均显著高于其他3组(P<0.05),可能是因为菌株M1在泡菜水中存活的时间较长,所以产生的风味物质更多。
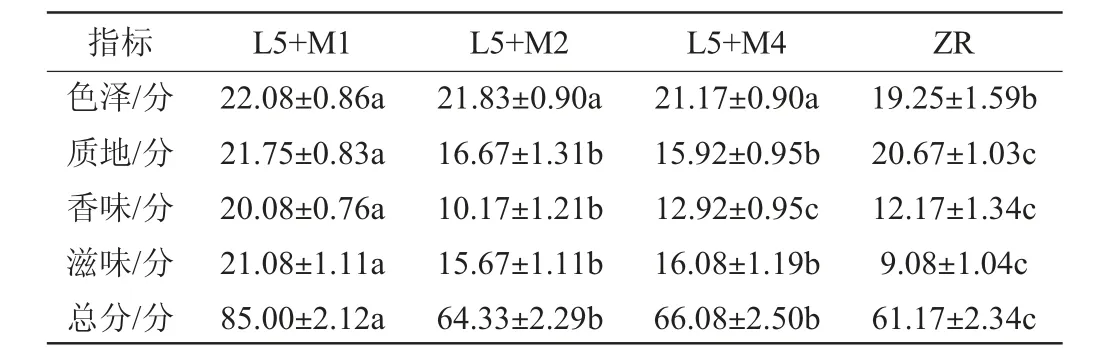
表4 自然发酵及不同菌株组合发酵芥菜的感官评分Table 4 Sensory scores of natural fermentation and different strains combination fermentation of mustard
3 结论
本研究运用不同泡菜来源的6株异型发酵乳酸菌(L1~L6)和6株酵母菌(M1~M6),通过耐盐、耐酸、产酸等性能筛选出在pH 4.5和4%盐浓度耐受性较好且24 h产酸量较少[(10.44±0.01)g/L]的肠膜明串珠菌(Leuconostoc mesenteroides)L5;以及在pH 4.0和4%盐浓度耐受性较好且不产气、不产璞的少孢哈萨克斯坦酵母(Kazachstania exigua)M1、库德里阿兹威毕赤酵母(Pichia kudriavzevii)M2和二孢接合酵母(Zygosaccharomyces bisporus)M4。将菌株L5与M1共发酵芥菜的总酸[(2.30±0.03)g/kg]和亚硝酸盐含量[(1.35±0.02)mg/kg]更低,乳酸菌活菌数[(5.71±0.02)lg(CFU/mL)]更少,也存在一定的酵母活菌;感官评分[(85.00±2.12)分]最高。本研究初步证明了不同酵母菌菌株对发酵过程产生影响,提示选用适合的乳酸菌和酵母菌组合对生产低酸泡菜具有重要意义,为人工接种发酵低盐低酸泡菜菌剂的选择提供了参考依据。

