超高效液相色谱-串联质谱法同时测定复杂基质保健食品中7种脂溶性维生素营养补充剂的含量
吴 琴, 余家胜, 李 瑞, 沈珊珊, 杨佳雯, 赵志红
(杭州娃哈哈集团有限公司 浙江省食品生物工程重点实验室, 杭州 310018)
维生素是维持人和动物正常生理功能必不可缺的低相对分子质量有机化合物,根据其物理特性可以分为水溶性维生素和脂溶性维生素。其中,脂溶性维生素主要包括维生素A(VA)、维生素D(VD)、维生素E(VE)、维生素K(VK)[1]。维生素A存在于动物性食品中,主要来源为视黄醇酯[2-3]。维生素E极易被氧化,是良好的脂溶性抗氧化剂[4-6]。缺乏维生素D会引起骨软化等疾病[7-8]。维生素K有K1(VK1)、K2(VK2)两种,维生素K1主要存在于绿叶蔬菜和一些食用油中[9],维生素K2主要由发酵食品中的细菌产生[10]。
不同脂溶性维生素的化学性质存在一定差异,同时测定面临许多问题和挑战。提取维生素A、维生素D、维生素E的方法通常为皂化法[11],但是该方法不能用于皂化维生素K1和K2,因为这两种物质易在碱性条件下降解。国际公认的提取婴幼儿配方乳粉和成人/儿童营养食品中维生素A、维生素E的方法是先酶解,再用甲醇沉淀蛋白,最后用溶剂提取[12-13],且这种方法可用于提取维生素K1[14];提取食品和补充剂中的维生素D的方法仍为皂化法[15-16]。
随着消费者对保健食品风味要求的提高,其基质也越来越复杂,因此建立一种准确、快捷、经济的检测复杂基质保健食品中脂溶性维生素的方法很有必要。本工作采用酶解法降解复杂基质保健食品中的脂肪、蛋白质,利用弱碱性乙醇溶液除去降解杂质,正己烷提取7种脂溶性维生素营养补充剂[维生素A乙酸酯、维生素A棕榈酸酯、维生素D2(VD2)、维生素D3(VD3)、DL-α-维生素E乙酸酯、维生素K1和维生素K2],并参考文献[17-18]采用超高效液相色谱-串联质谱法同时测定这7种脂溶性维生素营养补充剂的含量,该方法前处理简单,不需要复杂的皂化反应和固相萃取小柱净化,即可实现7种脂溶性维生素营养补充剂的同时测定。
1 试验部分
1.1 仪器与试剂
ACQUITY UPLC-Xevo TQ MS型超高效液相色谱-三重四极杆质谱仪,附Masslynx质谱软件;R-210型旋转蒸发仪;XS205DU型电子天平;AS-MTV100-114型多管涡旋振荡器;S470-K型pH计;WB 22型恒温水浴振荡器;XMTD-608型氮气吹扫仪。
单标准储备溶液:100 mg·L-1,取适量各脂溶性维生素营养补充剂标准品或标准溶液,用甲醇溶解并定容至10 mL棕色容量瓶中,摇匀备用。
基质匹配单标准中间液:10 mg·L-1,取适量单标准储备溶液,用空白样品溶液稀释,摇匀备用。
基质匹配混合标准溶液系列:取适量基质匹配单标准中间液,用空白样品溶液稀释,配制成维生素A乙酸酯、维生素A棕榈酸酯、DL-α-维生素E乙酸酯的质量浓度为50,100,200,500,1 000 μg·L-1,维生素D2、维生素D3、维生素K1和维生素K2的质量浓度为10,20,40,100,200 μg·L-1的基质匹配混合标准溶液系列。
维生素K1(CAS号84-80-0)标准品的纯度为99.6%;维生素K2(CAS号2124-57-4)标准溶液的质量浓度为100 mg·L-1;DL-α-维生素E乙酸酯(CAS号7695-91-2)标准品的纯度为98.8%;维生素A乙酸酯(CAS号127-47-9,)标准品的纯度为99.8%;维生素A棕榈酸酯(CAS号79-81-2)标准品的纯度为98.7%;维生素D3(CAS号67-97-0)标准品的纯度为99.7%;维生素D2(CAS号50-14-6)标准品的纯度为99.4%;脂肪酶的酶活力不小于30 U·mg-1;木瓜蛋白酶的酶活力不小于10 U·mg-1。
无水乙醇、碳酸钾、正己烷、石油醚、乙醚均为分析纯;甲醇、甲酸均为色谱纯;试验用水为实验室一级用水。
1.2 仪器工作条件
1.2.1 色谱条件
Waters Acquity UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm);柱温35 ℃;流动相A为0.1%(体积分数,下同)甲酸溶液,B为含0.1%甲酸的甲醇溶液;流量0.3 μL·min-1;进样量5 μL。梯度洗脱程序:0~3.0 min时,B由85%升至100%,保持5.5 min;8.5~9.0 min时,B由100%降至85%,保持1.0 min。
1.2.2 质谱条件
电喷雾离子(ESI)源,正离子(ESI+)模式;离子源温度150 ℃;毛细管电压4.00 kV;脱溶剂气温度200 ℃;脱溶剂气流量800 L·h-1,锥孔气流量50 L·h-1;多反应监测(MRM)模式。其他质谱参数见表1,其中“*”代表定量离子。
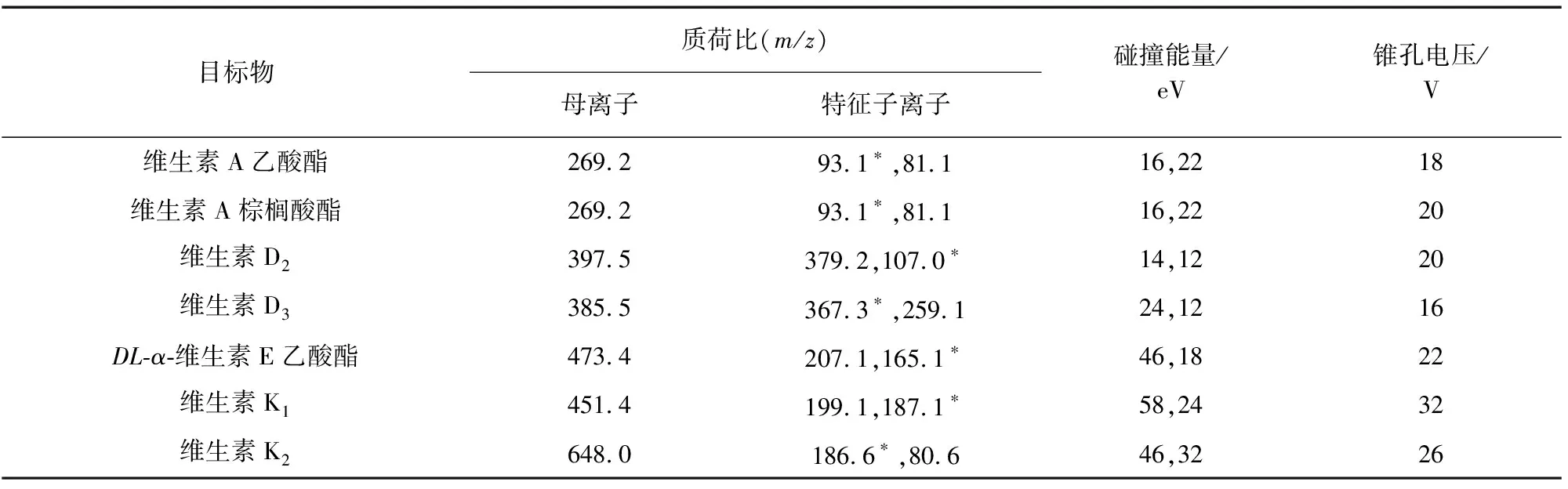
表1 质谱参数Tab. 1 MS parameters
1.3 试验方法
将样品混匀,分取约1 g置于50 mL离心管中,加入约50 ℃温水5 mL和磷酸盐缓冲液(pH 7.0) 5 mL,混匀后加入0.3 g脂肪酶、0.5 g木瓜蛋白酶,加盖涡旋2~3 min,置于37 ℃恒温水浴振荡器中振荡120 min。取出酶解好的样品溶液,加入10 mL无水乙醇和1 g碳酸钾,混匀后加入10 mL正己烷和10 mL水,涡旋或振荡提取10 min,以6 000 r·min-1转速离心5min,上层相转移至100 mL旋蒸瓶中。在下层相中加入10 mL正己烷,重复上述提取和离心操作一次。合并上层相至旋蒸瓶中,于40 ℃旋蒸至近干,残液用氮气吹干,用甲醇溶解残渣并定容至5 mL容量瓶中,摇匀后过0.22 μm滤膜,滤液上机检测。对于目标物检出量超出线性范围的样品,需要先稀释再测定。
2 结果与讨论
2.1 基质的影响及消除
复杂基质保健食品,如本工作研究的颗粒型保健食品,其中除了有维生素等营养补充剂外,还添加了大量的可可粉、全脂乳粉等进行调味,脂类和蛋白类化合物含量较高。若采用有机溶剂直接提取,共存脂肪、蛋白质也会被提取到提取液中,不仅影响维生素的测定,还会降低质谱响应值和缩短仪器使用寿命。本工作参考国家标准GB 5009.158-2016《食品安全国家标准 食品中维生素K1的测定》[19],先采用酶解法降解脂肪和蛋白质,酶解完成后加入无水乙醇、碳酸钾、正己烷,使酶解产生的脂肪酸和甘油等降解杂质溶于弱碱性的乙醇溶液中,而目标物则留在了正己烷相,从而完成杂质的分离和目标物的提取。
2.2 酶解反应条件的选择
由相关文献可知,脂肪酶酶活性可在pH 6.5~9.0、温度25~40 ℃的条件下维持在较高的水平[20];木瓜蛋白酶酶活性在pH 6.8~7.6内较高,在70 ℃以上才降低[21]。因此,试验选择在pH 7.0,温度37 ℃条件下进行酶解反应。
参考本课题组前期研究[22],以空白加标样品(维生素A乙酸酯、维生素A棕榈酸酯和DL-α-维生素E乙酸酯的加标量为2.5 μg·g-1,维生素D2、维生素D3、维生素K1和维生素K2的加标量为0.5 μg·g-1)为待测对象,固定脂肪酶用量为0.3 g,考察了木瓜蛋白酶用量分别为0.1,0.3,0.5,0.8,1.0 g时各目标物的回收率,结果见图1。
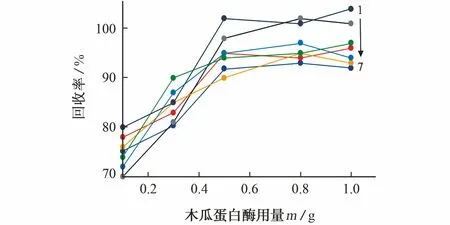
1-DL-α-VE乙酸酯;2-VK1;3-VA棕榈酸酯;4-VD3;5-VA乙酸酯;6-VK2;7-VD2
由图1可知,木瓜蛋白酶的用量不小于0.5 g时,各目标物的回收率较高且基本保持不变,因此试验选择的木瓜蛋白酶的用量为0.5 g。
2.3 提取溶剂的选择
脂溶性维生素可被多种有机溶剂提取,相关国家标准采用体积比1∶1的石油醚-乙醚混合溶液提取皂化溶液中的维生素A、维生素D、维生素E[23],采用正己烷提取维生素K1[19];国家卫生和计划生育委员会相关公告采用异丙醇提取维生素K2[24]。本工作涉及的脂溶性维生素种类较多,因此比较了上述3种提取溶剂对7种目标物回收率的影响,结果见图2。
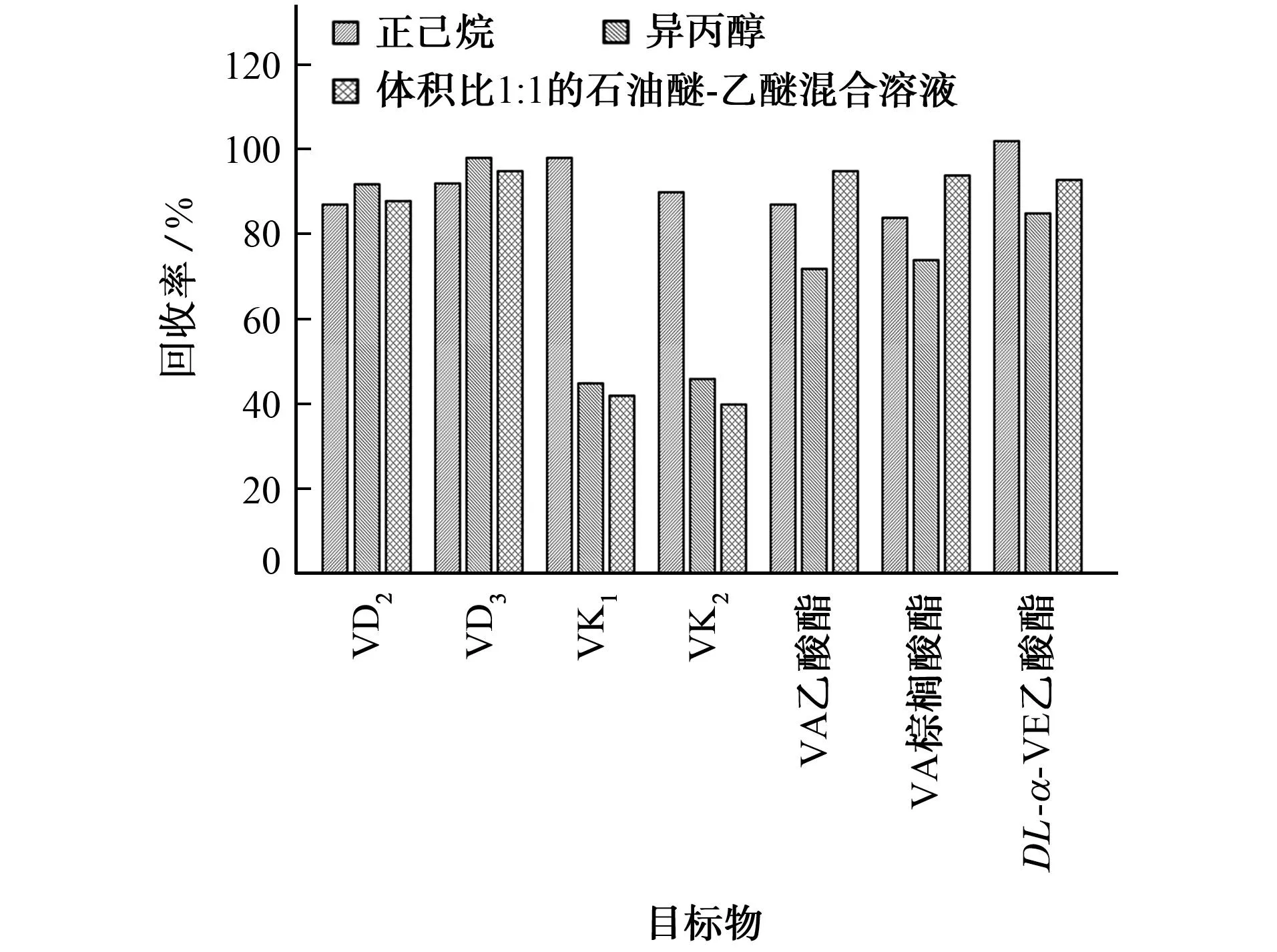
图2 提取溶剂对目标物回收率的影响Fig. 2 Effect of extraction solvent on the recovery of targets
由图2可知:以体积比1∶1的石油醚-乙醚混合溶液提取时,维生素A乙酸酯和维生素A棕榈酸酯的回收率较大,但是维生素K1和维生素K2的回收率较小;以异丙醇提取时,维生素D2和维生素D3的回收率较大,但是维生素K1和维生素K2的回收率仍旧较小;以正己烷提取时,各目标物均获得较高的回收率,其中维生素K1和维生素K2的回收率显著增大。综合考虑回收率以及石油醚、乙醚、异丙醇在使用过程中对试验人员健康影响较大等因素,试验选择的提取溶剂为正己烷。
2.4 电离模式的选择
ESI+和大气压化学电离正离子(APCI+)模式都可用来电离脂溶性维生素[25]。为确定最优电离模式,在20 μL·min-1流量下用蠕动泵进样10 ng各目标物,分别用ESI+和APCI+模式电离。结果显示,两种电离模式下维生素A乙酸酯、维生素A棕榈酸酯、维生素D2、维生素D3、DL-α-维生素E乙酸酯、维生素K1和维生素K2母离子质谱响应值比值分别为4.7,6.3,1.1,1.0,5.4,21.4,22.2,说明:对于维生素K1和维生素K2,ESI+模式比APCI+模式更灵敏;对于维生素D2和维生素D3,两种模式电离效果基本一致;对于维生素A和维生素E,ESI+模式略优。在实际检测时,相关样品中维生素A和维生素E含量较高,且APCI+模式电离后基线噪声更低,两种电离模式都可选用;但是维生素K1和K2含量相对较低,应选择灵敏度更高的ESI+模式。综合考虑,试验选择的电离模式为ESI+。
2.5 色谱柱的选择
试验比较了HSS T3色谱柱(100 mm×2.1 mm,1.8 μm)、BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)、HSS C18色谱柱(100 mm×1.7 mm,1.8 μm)等3种色谱柱对7种目标物的分离效果。结果显示,HSS T3色谱柱(100 mm×2.1 mm,1.8 μm)所得各目标物响应值更高,分离度更好,峰形更尖锐,因此试验选择的色谱柱为HSS T3色谱柱(100 mm×2.1 mm,1.8 μm)。
在优化的仪器工作条件下,各目标物的定量离子色谱图见图3。
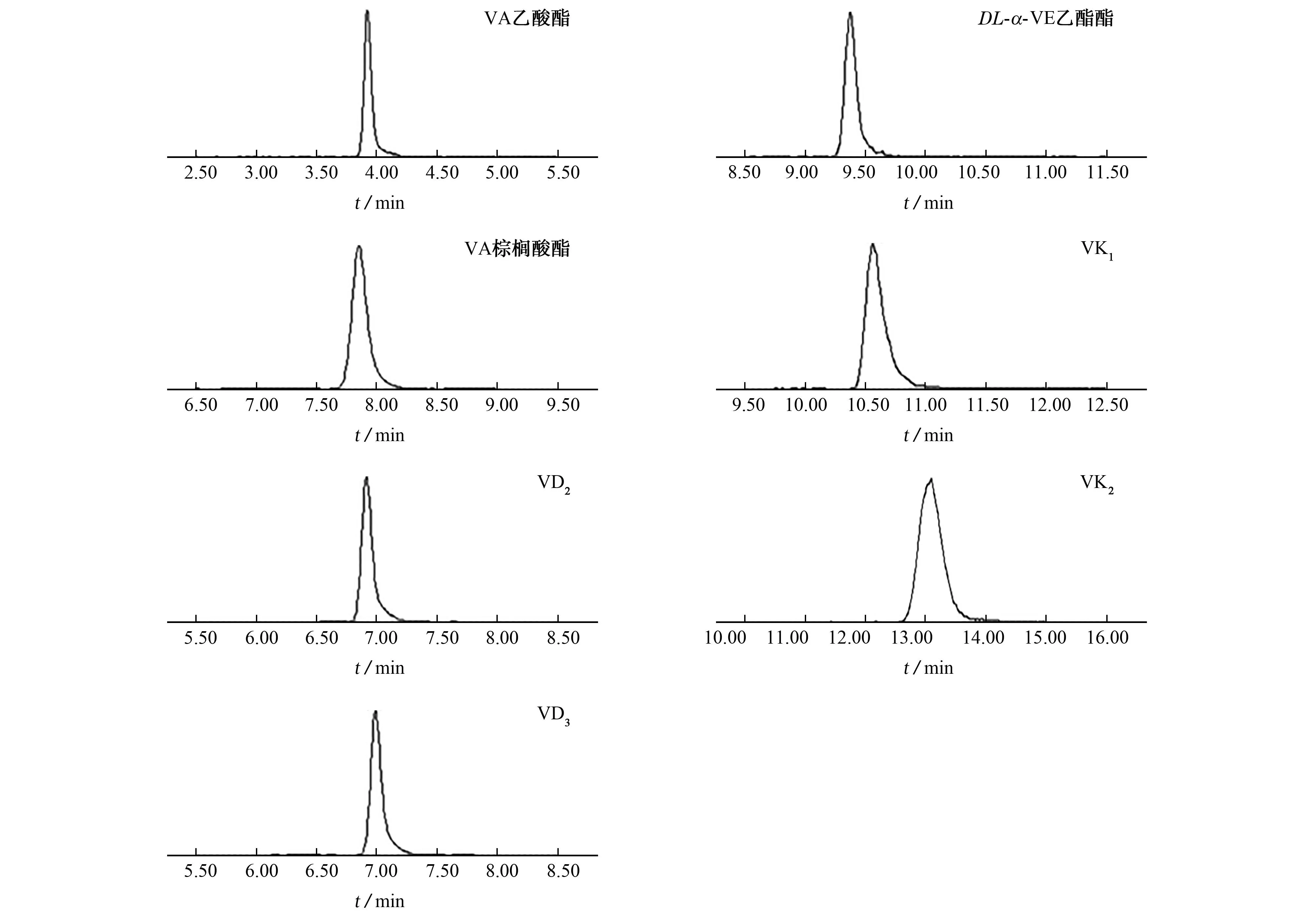
图3 目标物定量离子的色谱图Fig. 3 Chromatograms of quantitative ions of targets
2.6 工作曲线、检出限和测定下限
按照仪器工作条件测定基质匹配混合标准溶液系列,以各目标物的质量浓度为横坐标,其对应的峰面积为纵坐标绘制工作曲线。结果显示,维生素A乙酸酯、维生素A棕榈酸酯、DL-α-维生素E乙酸酯的质量浓度均在50~1 000 μg·L-1内,维生素D2、维生素D3、维生素K1和维生素K2的质量浓度均在10~200 μg·L-1内与各自对应的峰面积呈线性关系,其他线性参数见表2。
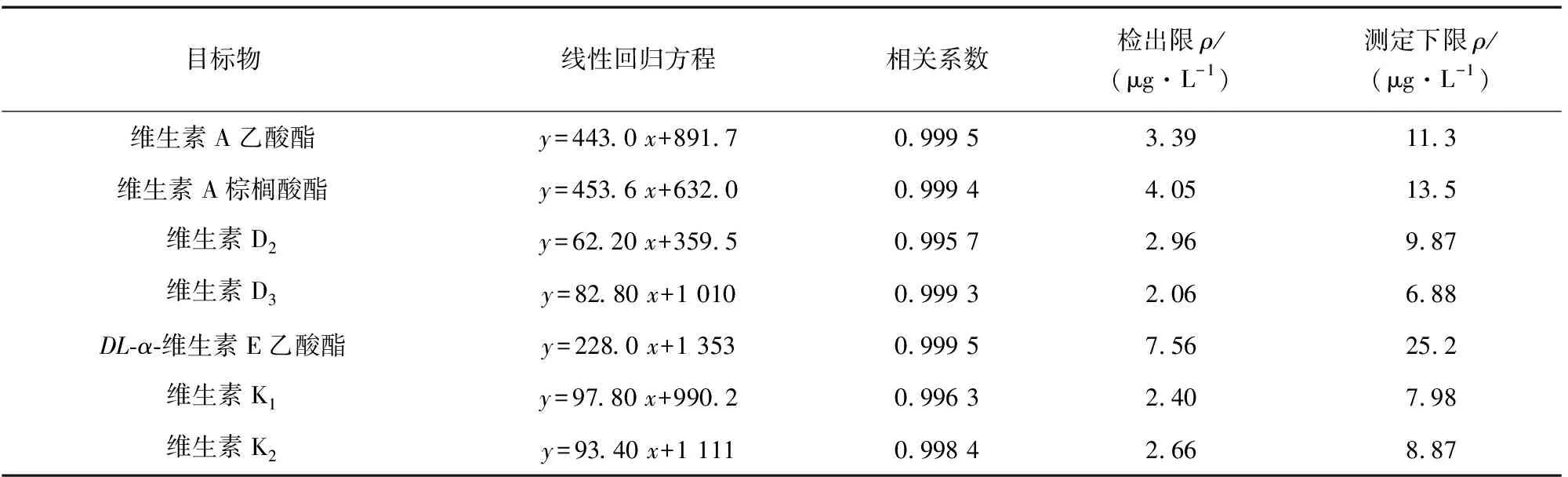
表2 线性参数、检出限和测定下限Tab. 2 Linearity parameters, detection limits and lower limits of determination
以3倍信噪比(S/N)计算检出限(3S/N),以10倍信噪比计算测定下限(10S/N),结果见表2。
2.7 精密度与回收试验
按照试验方法对空白样品进行低、中、高等3个浓度水平的加标回收试验,每个浓度水平平行测定6次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。
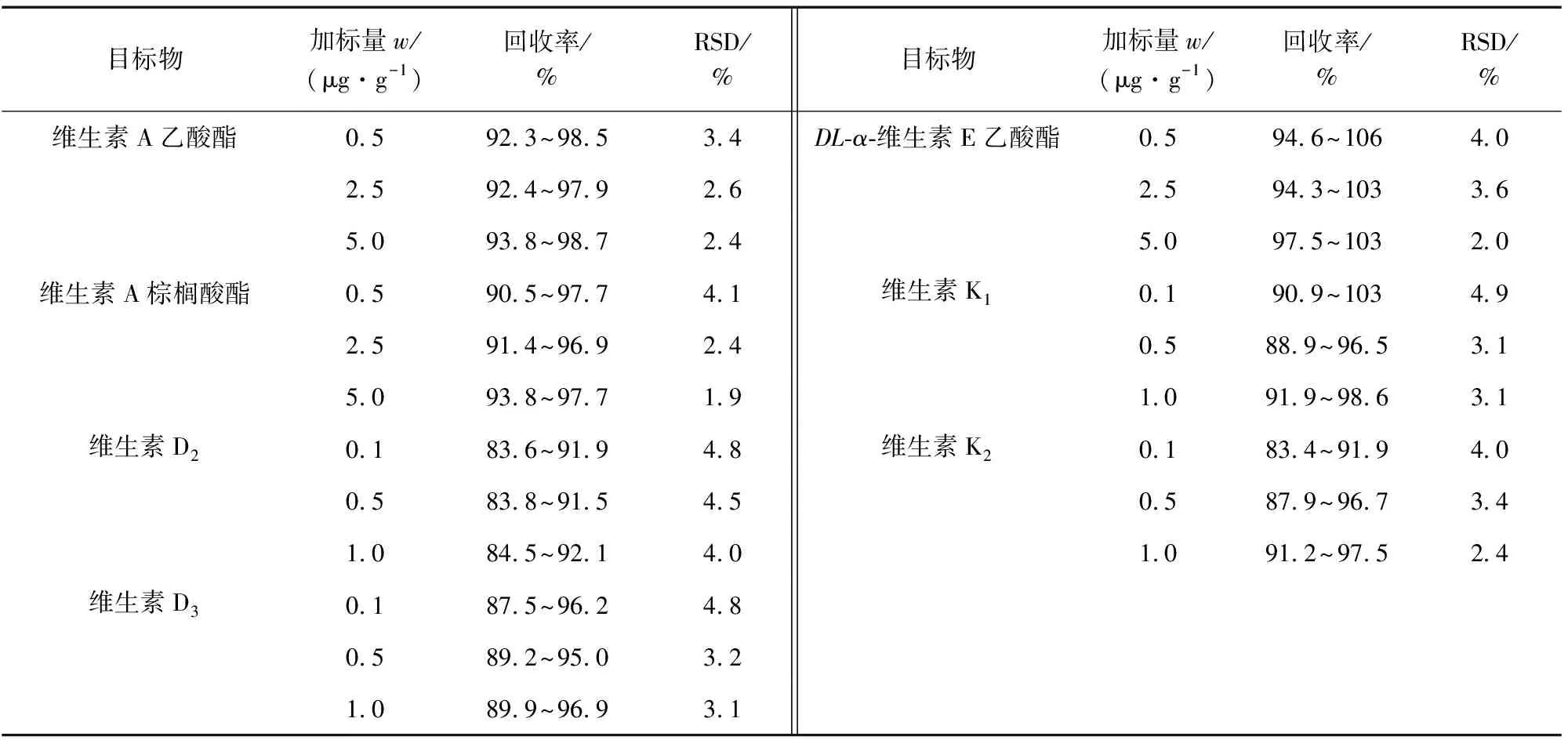
表3 精密度和回收试验结果(n=6)Tab. 3 Results of tests for precision and recovery(n=6)
由表3可知,各目标物的回收率为83.4%~106%,测定值的RSD为1.9%~4.9%,满足脂溶性维生素的实际检测要求。
2.8 样品分析
按照试验方法分析一款颗粒型保健食品,该保健食品包含维生素A乙酸酯、维生素D3、DL-α-维生素E乙酸酯、维生素K1和维生素K2,标签值分别为4.0,0.2,50.0,0.5,1.8 μg·g-1。结果显示,上述物质的检出量分别为4.83,0.225,58.6,0.593,2.05 μg·g-1,检出量和标签值基本一致,略高于标签值。
本工作采用酶解法降解复杂基质保健食品中的脂肪和蛋白质,正己烷提取7种脂溶性维生素营养补充剂,超高效液相色谱-串联质谱法测定其含量。和传统皂化法比较,方法操作简单、检测快速、有机试剂消耗量少、环境友好度高,具有一定的推广价值。

