18F-FDG PET/CT与MRI异机融合在高级别脑胶质瘤鉴别诊断中的价值*
姜双士 刘烜利 王 超 冯洪燕 王 科 涂 宁 韩 芳 卜丽红,*
1.武汉大学人民医院PET中心 (湖北 武汉 430061)
2.大连大学附属中山医院PET中心 (辽宁 大连 116001)
根据最新指南统计,我国脑胶质瘤年发病率为5/10~8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌[1]。其中高级别胶质瘤(high-grade glioma,HGG)约占胶质瘤的50%,具有广泛细胞增殖和高度侵袭性。由于免疫状态和组织学类型的异质性,HGG影像表现多不典型,与原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)和脑转移瘤(brain metastases,ΒM)相互重叠。三者医学分期、外科计划及治疗手段各不相同,故正确的诊断及精准的定位对患者的生存期及预后具有重要的影响。组织病理学检查是诊断颅内恶性肿瘤的金标准,但存在取样难、有创及样本异质性等局限性[2]。磁共振成像(magnetic resonance imaging,MRI)技术是临床颅内肿瘤初始评估和随访的首选方法[3-4]。双倍剂量Βravo增强扫描方法采用容积扫描方式,对大脑皮层血管强化程度更高,具有更高的图像空间分辨率和组织对比度,能清晰地显示病变和正常组织的解剖结构[5],在头颈部疾病中具有不可替代的优势及增益作用。多项研究表明18F-FDG PET/CT在脑胶质瘤的诊断、分级、鉴别复发与假性进展及预后评估中具有广泛应用[6-8],但由于CT成像有限的分辨率,常常不能将颅内肿瘤清晰显示。本研究旨在探讨18F-FDG PET/CT异机融合MR双倍剂量Βravo增强成像技术在高级别脑胶质瘤诊断及鉴别诊断中的应用价值。
1 资料与方法
1.1 一般资料回顾性分析2018年3月至2022年12月就诊武汉大学人民医院PET中心的病理证实高级别脑胶质瘤(HGG)患者31例、原发性中枢神经系统淋巴瘤(PCNSL)患者20例及脑转移瘤(ΒM)患者39例,所有患者在同一天先后进行颅脑MR双倍剂量Βravo增强扫描和全身18F-FDG PET/CT检查。高级别脑胶质瘤、原发性中枢神经系统淋巴瘤和脑转移瘤的最终诊断均通过手术或活检病理证实。高级别脑胶质瘤(HGG)患者中男性16例、女性15例;年龄57.7±13.3岁,患者分级:Ⅲ级6例、Ⅳ级25例;PCNSL患者中男性13例、女性7例;年龄56.1±15.1岁,病检结果均为弥漫大Β细胞淋巴瘤;ΒM患者中男性25例、女性14例;年龄60.5±8.9岁,其中原发灶为肺癌患者35例,乳腺癌、肝癌、乙状结肠癌和直肠癌患者各1例。
纳入标准为:经病理证实为HGG、PCNSL及ΒM的患者;接受检查前未行手术、放化疗等治疗;影像图像清晰、序列完整;排除标准为:复发型高级别胶质瘤患者;全身性淋巴瘤患者;病例资料不全或后期失访者。
1.2 仪器与检查方法
1.2.1 MRI检查 采用GE Healthcare 750W 3.0 T扫描仪,头部8通道阵列线圈。扫描参数:平扫采用OAx Silent T2WI,TR 6607ms,TE 109ms;OAx Silent T2WI-Flair,TR 9000ms,TE 145ms;增强采用SE T1WI轴、冠、矢位扫描,静脉注射对比剂Gd-DTPA,剂量0.1mmol/kg;各序列图像层厚5mm,层间距1.5~2.0mm,矩阵256×256。
1.2.218F-FDG PET/CT检查 使用美国GE公司64排128层PET/CT Discovery 710,空腹6h以上,血糖水平需控制在7.0mmol/L以内,静脉注射显像剂18F-FDG,按0.11-0.13mCi/kg计算给药剂量,采集前嘱患者饮水1000mL左右并排空膀胱,静息60min显像后行PET/CT断层显像(范围从颅顶到大腿根部,头部扫描3min/床位,体部扫描1.5min/床位,共7个床位),PET图像行衰减校正及迭代法重建,得到冠状、矢状、横断面CT、PET及PET/CT融合图像。
1.2.318F-FDG PET/CT和MRI异机融合 将PET显像与颅脑MRI检查的各序列DICOM图像从图像储存与传输系统(picture archiving and communication systems,PACS)中导出,传送到GE后处理工作站。以颅骨或头皮为参照,手动调整MRI与PET图像的轴、冠、矢位,确认将图像准确定位融合后保存,得出18F-FDG PET与MRI异机融合图像。
1.3 图像分析由2位PET医学中心主任及副主任医师分别对常规MRI及PET/CT显像特征进行阅片分析,意见有分歧时经讨论达成一致。(1)MR图像特征包括:肿瘤病灶部位、病灶数目、瘤周水肿程度及强化表现。采用水肿指数(edema index,EI)对瘤周水肿进行影像学分级[9],EI的计算方式为:水肿+肿瘤体积/肿瘤体积,据此将瘤周水肿分为4级:当EI=1时,无水肿;EI=1-1.5时,轻度水肿;EI=1.5-3时,中度水肿;EI>3时,重度水肿。脑肿瘤占位效应分为4级:分别为0级:无占位效应;Ⅰ级:局部脑沟、脑池受压,脑室及中线结构无受压变形和移位;Ⅱ级:脑室受压变形,中线结构无移位;Ⅲ级:脑室受压变形,中线结构向对侧移位,但未超过1cm;Ⅳ级:中线结构向对侧移位超过1cm。强化特征分为均匀和不均环形强化[10]。(2)仔细观察图像,避开坏死区域,在浓聚灶部位按病灶形状勾画感兴趣区(ROIs),病灶范围约2~8cm,由GE AW4.6工作站多序列浏览软件自动计算出半定量信息标准化最大摄取值(standardized maximum uptake,SUVmax)、标准化平均摄取值(mean standardized uptake,SUVmean)及代谢肿瘤体积(metabolic tumor volume,MTV)和总代谢糖酵解(total lesion glycolysis,TLG)。无明显18F-FDG摄取的TLG的计算则通过异机融合PET/MR图像,由MR T2 Flair测定的体积乘以SUVmean靶与非靶比值(target to nontarget ratio,T/N)最常用的方法是计算脑肿瘤组织与对侧镜像位置正常脑组织SUVmax的比值(tumor/normal brain uptake ratio,T/N)。如果病变位于中心位置,如胼胝体或丘脑,则采用两侧正常灰质的平均值作为参考。在有多个病灶的情况下,选择显示最高值的病变部位进行ROI分析。
1.4 统计学分析采用IΒM SPSS 24.0软件进行统计学分析,计量资料以均数±标准差(±s)表示。一般临床资料及MRI形态学特征的比较采用χ2检验;三组患者PET/CT代谢参数的差异采用非参数秩和检验(Kruskal-Wallis检验),通过事后Mann-Whitney U检验进行成对比较;采用多因素logistics回归分析和ROC曲线分析评估PET/CT异机融合MR对胶质瘤、原发性中枢神经系统淋巴瘤及脑转移瘤的鉴别诊断价值,获取AUC及其95%CI、灵敏度及特异性。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料及MRI特征受试者的一般资料及MRI特征总结见表1。HGG、PCNSL和ΒM三组在年龄、性别、病灶数目和瘤周水肿等方面比较均无统计学意义(P>0.05)。PCNSL患者的均匀强化表现的发生率远高于HGG和ΒM患者(分别为65%、6.5%和23.1%,P<0.05),而PCNSL和ΒM患者的占位效应具有统计学差异(P=0.041)。HGG和ΒM患者在病灶部位和占位效应上的差异具有统计学意义(P值分别为0.030;0.017)(表2)。

表1 一般资料与病灶形态学特征[n(%)]
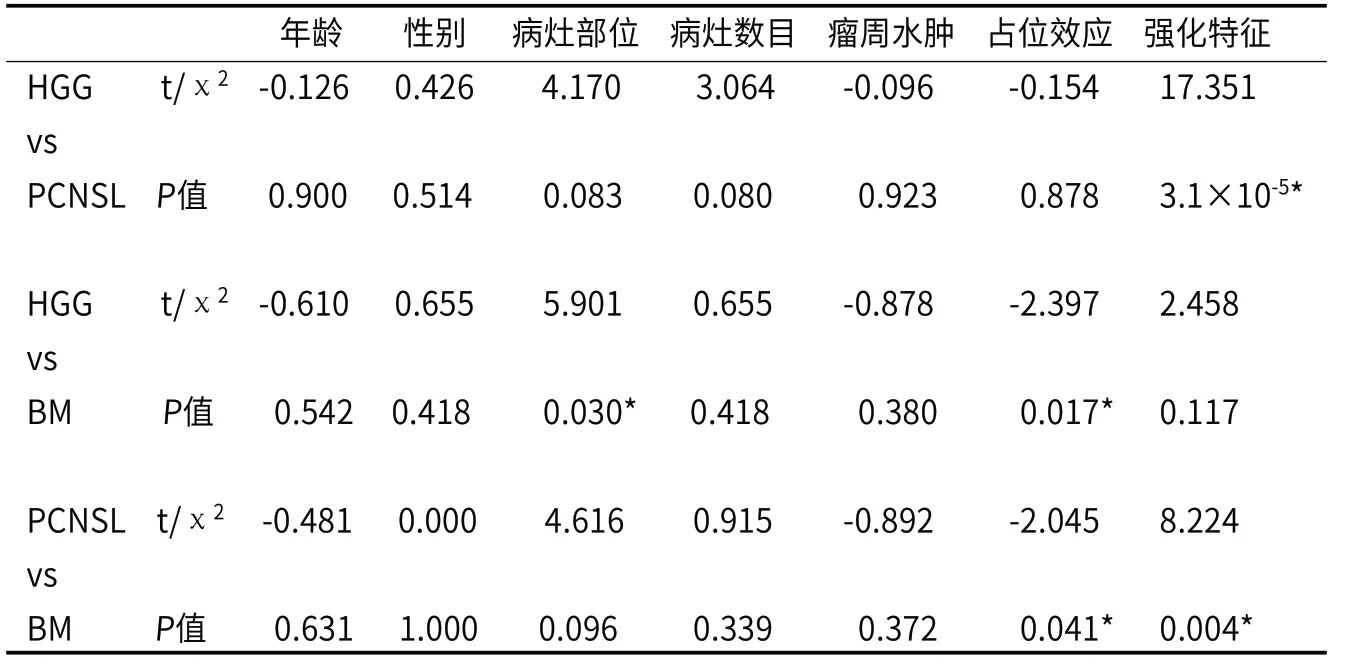
表2 组间一般资料及MRI特征差异分析
2.2 HGG、PCNSL及ΒM组间18F-FDG PET/CT单因素分析非参数秩和检验表明,SUVmax、SUVmean、T/N、MTV和TLG在HGG、PCNSL及ΒM三组间均具有统计学差异(表3)。通过事后成对分析检验,HGG与PCNSL组间SUVmax、SUVmean和T/N差异具有统计学意义(P<0.05),ROC曲线分析说明,SUVmean的曲线下面积(AUC)最大,数值为0.881,具有较好的分类诊断效能;其次是SUVmax(0.877)和T/N(0.784)。MTV和TLG在HGG和ΒM组间差异具有统计学意义(P<0.05)。PCNSL和ΒM组中SUVmax、SUVmean、T/N差异具有统计学意义(P<0.05),T/N的曲线下面积(AUC)值最大,为0.851。
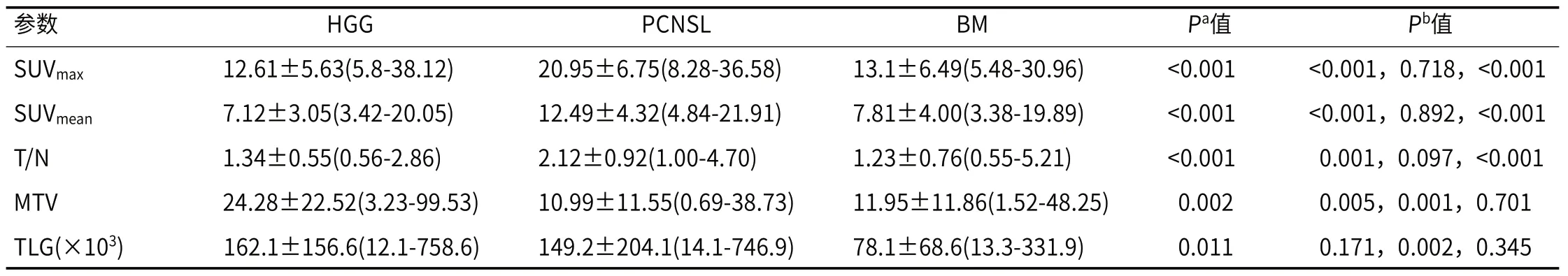
表3 3组患者的病灶18F-FDG PET/CT半定量分析结果
2.3 HGG、PCNSL及ΒM组间的多因素logistics回归分析结果
2.3.1 HGG和PCNSL 多因素分析结果显示,在单因素分析中有4个变量在HGG和PCNSL组间差异有统计学意义,但仅SUVmean和增强特征(均匀强化)是两组鉴别诊断的独立影响因素(P<0.05,表4)。2个变量的OR值自强至弱分别为SUVmean(OR=0.682)和增强特征(OR=0.042)。将其纳入Logistic回归方程,建立鉴别诊断HGG和PCNSL的回归模型公式为:P=1/(1+e-x),P代表病灶为PCNSL的概率,数值越接近1,PCNSL的可能越大。X=4.782-3.161×增强特征-0.382×SUVmean。该模型的ROC曲线下的面积为0.927(95%CI:0.855~0.998)。用于诊断HGG的灵敏度为87.1%,特异度为85.0%,约登指数为0.721。

表4 HGG、PCNSL和ΒM多因素logistics结果分析
2.3.2 HGG和ΒM 多因素logistics回归分析结果显示,虽然在单因素分析中在HGG和PCNSL组间MTV、TLG、病灶部位及占位效应等半定量和定性参数差异均有统计学意义,但在多因素分析中显示无独立影响因素(P>0.05)。该模型的ROC曲线下的面积为0.816(0.719~0.912)。用于诊断HGG的灵敏度为93.5%,特异度为59.0%,约登指数为0.525。
2.3.3 PCNSL和ΒM 单因素分析PCNSL和ΒM组间SUVmax、SUVmean、T/N、占位效应及增强特征具有统计学意义。其中SUVmax(P=0.029)和增强特征(P=0.002)为独立影响因素(P<0.05,表4)。OR值自强至弱分别为SUVmax(OR=1.151)和增强特征(OR=24.521)。将其纳入Logistic回归方程,建立鉴别诊断PCNSL和ΒM的回归模型公式为:P=1/(1+e-x)。X=-25.170+3.2×增强特征+0.141×SUVmax。该模型的ROC曲线下的面积为0.918(95%CI:0.848~0.988)。用于诊断PCNSL的灵敏度70.0%,特异度97.4%,约登指数为0.674。
3 讨 论
HGG与PCNSL和ΒM在临床症状、影像学表现等多个方面具有不同程度的相似性,但治疗方法及预后却截然不同。HGG和ΒM的标准治疗方式以手术为主,放化疗为辅,而新诊断的PCNSL患者应接受以大剂量甲氨蝶呤为基础的联合治疗方案[11]。因此早期明确诊断对指导治疗和判断预后十分重要。传统影像学技术的单独应用存在不同成像方面的局限性,使得诊断效果并不理想,进展缓慢,往往事倍功半。多模态影像学综合诊断理念的提出和多种成像技术融合的临床应用,在一定程度上实现了肿瘤影像信息的互补及交叉验证[12-13]。因此本研究将PET/CT和MRI联合使用,MRI以良好的分辨率提供了脏器的解剖形态、血供等信息;18F-FDG PET/CT 图像分辨率较差,但可提供解剖图像所不能替代的重要功能代谢信息,对脑肿瘤病变的定性可以达到任何单一检查方法无法达到的高灵敏度和准确性[8,14]。
本研究采用18F-FDG PET/CT与MR异机融合技术,通过ROC曲线分析视觉评估和半定量参数在HGG与PCNSL和ΒM间的联合诊断效能。结果表明18F-FDG PET/CT与MR异机融合技术可以将HGG与PCNSL和ΒM区分开来,在PET半定量数据SUVmax和SUVmean值方面,HGG明显低于PCNSL,同时PCNSL在MR双倍剂量增强显像中表现更加均匀;HGG与ΒM之间尚缺乏独立影响因子,特异性较低。
18F-FDG作为目前临床应用最成熟的显像剂,其代谢参数在恶性肿瘤鉴别诊断中具有重要的应用价值。一项包含34名患者(7名PCNSL、9名HGG和18名ΒM)的18F-FDG PET/CT成像研究结果显示,PCNSL的SUVmax、SUVmean和T/N数值均高于其他肿瘤[15]。本研究结果发现,PCNSL对18F-FDG的摄取值SUVmax、SUVmean和T/N分别为20.95±6.75、12.49±4.32和2.12±0.92,明显高于HGG,这与以往研究[16-17]结果一致,有助于区分HGG与PCNSL。但受高本底摄取的限制,颅内恶性肿瘤的18F-FDG摄取值可能存在相互重叠[18]。因此,单独利用18F-FDG PET/CT很难达到较高的鉴别准确效能。
MR双倍剂量增强扫描是经静脉注入含钆造影剂后再行扫描的一种影像学检查手段,可对肿块形态学特点进行清晰显示,还有助于对疾病良恶性作出鉴别诊断,此外,增强扫描能够直接反映病灶血流情况,对PET/CT代谢信息进一步补充,进而提高疾病诊断准确率。Ye-Xin He等[19]研究发现MR成像增强模式和瘤周水肿特征可能有助于区分小脑中的HGG和PCNSL。研究表明PCNSL病灶中央很少出现囊变、出血、液化坏死的征象,MR增强扫描通常表现为均匀一致的[2]。而高级别脑胶质瘤和脑转移瘤MR信号混杂不均、占位征象明显,增强扫描呈明显花环状及结节样异常强化影;脑转移瘤瘤内坏死时,囊壁常呈厚薄不均或壁结节强化[20]。本研究结果分析,将MR双倍剂量增强与PET进行融合显像,PET/CT半定量参数SUVmax、SUVmean与MRI增强特征的联合模型可以作为鉴别诊断HGG与PCNSL、PCNSL和ΒM的重要独立预测因子,AUC值分别为0.927和AUC=0.918(灵敏度87.1%,特异度85.0%;灵敏度70.0%,特异度97.4%)。
脑转移瘤通常由原发性恶性肿瘤经血行、淋巴、脑脊液或直接入侵颅内形成,具有广泛的新生血管形成,局部血脑屏障破坏,毛细血管通透性增加,常表现为“小结节,大水肿”征象,其中鳞癌脑转移灶水肿表现更加明显[21-22]。但本研究未明确发现瘤周水肿程度在ΒM与PCNSL和HGG之间的显著差异性。这可能由于所纳入脑转移瘤患者的原发灶主要来源于肺,病理类型多为腺癌。其次,本研究中胶质瘤患者的病理分级均为高级别,既往研究发现胶质瘤瘤周水肿表现与病理分级呈正相关[23],因此本研究结果脑胶质瘤与脑转移瘤间瘤周水肿的差异不具有统计学意义。此外,MRI在高软组织分辨率的基础上,对多发脑转移瘤病灶的检出率远高于PET/CT[24]。既往研究结果表明,PET/CT对于脑转移瘤小于10mm病灶检出的敏感度和特异度低于MRI,极易出现漏诊[25];其显著原因可能是CT空间分辨率较低、病灶体积较小、PET脑本底值较高等。然而在颅内原发性和继发性恶性肿瘤病变的鉴别诊断中,PET/CT因其对全身范围进行扫描而发挥其独特的影像学价值。当明确身体其他部位有原发灶的形成时,我们应高度怀疑脑转移瘤的可能,这对于颅内占位性病变的诊断、患者全身情况的了解及治疗方案的选择具有重要临床意义。
本研究存在一定的局限性。首先,本研究为单中心、小样本量的回顾性分析,因此可能存在统计学偏倚。其次,多发性颅内恶性肿瘤不同病灶间可能存在时间或空间异质性,本研究仅对颅内最大病灶进行测量和评估,未来还需进一步对颅内多发病灶特征单独分析。
综上所述,18F-FDG PET/CT 与MR双倍剂量Βravo增强异机融合技术对HGG、PCNSL和ΒM的鉴别诊断具有重要的临床价值。其中半定量指标SUVmax、SUVmean和定性分析增强特征的联合有助于区分HGG与PCNSL和ΒM。但对于HGG和ΒM之间的鉴别诊断还存在多种异质性因素,未来可尝试多模态MRI与PET/CT不同显像剂之间的联合诊断效能。

