慢性肾衰竭大鼠OAT1 的表达对骨代谢的影响
沈文娟 ,梁纹鑫 ,李 清 ,徐宏芳 ,张伟琴 ,李海欣
(1)昆明医科大学海源学院病理生理学教研室;2)人体解剖学教研室;3)医学机能学实验室;4)人体寄生虫学教研室,昆明 云南 651700;5)昆明市第二人民医院骨科,昆明 云南 650204)
肾功能衰竭的肾性骨营养不良、尿毒症环境、药物和全身性疾病可导致慢性肾脏疾病患者的骨损伤。慢性肾脏疾病患者的骨折发生率比常人高出4~5 倍,并且骨折的发生率随着肾功能的恶化而增加[1]。骨折对慢性肾功能衰竭患者的生活质量和死亡率有不利影响,骨丢失和骨折的发病机制复杂多样。
有机阴离子转运蛋白(organic anion transporter,OAT)由 540~560 个氨基酸组成,含12 个跨膜结构域,负责有机阴离子的跨膜转运[2]。OAT1、OAT2、OAT3 共同参与肾小管上皮细胞尿酸分泌的第1 阶段,具有尿酸转运功能,OAT1 与尿酸分泌和排泄密切相关,主要见于肾近端小管的基底膜一侧,参与肾脏分泌[3-4]。肾小管上皮细胞表达OAT,尿酸的分泌和重吸收由不同的转运蛋白表达[5]。OAT 转运的底物的多样性决定了OAT 的重要作用。当发生尿毒症的有机毒素增加时,内源性毒素在OAT 运输不平衡下引起组织损伤。有研究指出,在高尿酸环境下,OAT1 的表达会下调[6]。
笔者着重研究慢性肾衰竭中OAT 表达对骨代谢的影响,采用单肾切除+腺嘌呤灌胃法建立大鼠慢性肾衰竭模型,观察慢性肾衰竭时OAT1 表达的变化,探讨OAT1 表达对骨代谢的影响,为肾性骨营养不良的防治提供一定基础。
1 材料与方法
1.1 试剂与仪器
苏木素(赛维尔,批号:G1004-100ML);二甲苯(西陇化工股份有限公司,批号:33535);伊红染色液(索莱宝,批号:G1108);山羊抗兔二抗(赛维尔,批号:G1213-100UL);DAB 试剂盒(赛维尔,批号:G1212-200T);迈瑞兽用全自动血液细胞分析仪(型号:BC-2800vet);卧式冷冻箱(美菱,型号:BCD-318AT);全自动生化分析仪(深圳雷杜生命科技,型号:Chemray 800);实维仪器石蜡切片机;尼康倒置显微镜(型号:TS2)。
1.2 实验动物
20 只的SD 雄性大鼠(体重350~400 g,12 周)购自昆明医科大学海源学院动物提供合作中心,将大鼠随机分为对照组和模型组,每组10只大鼠。大鼠在24 ℃和(60±10)% 相对湿度下适应性饲养1 周,光照/黑暗周期为12 h。本次动物实验方案经昆明医科大学实验动物权利与伦理管理委员会批准[SCXK(滇)K2020-0004]。
1.3 研究方法
1.3.1 大鼠慢性肾衰竭模型的复制采用“单肾切除+腺嘌呤灌胃法”建立大鼠慢性肾衰竭模型,模型组给10%的水合氯醛腹腔注射麻醉。取俯卧位将模型组大鼠固定在手术台上,进行背部手术区常规备皮,酒精消毒,以肋脊角为标志进行左侧背部斜切口,在脊柱旁0.5 cm 处,分离皮肤。分离腰大肌,进入后腹膜,找到肾脏,使用止血钳分离肾周围脂肪囊和肾蒂,注意避免损伤肾上腺。充分暴露左侧肾脏,用止血钳夹闭肾蒂,确认肾动脉、静脉和输尿管均包括在内后,用丝线结扎。用剪刀剪断肾蒂,摘除肾脏,并将结扎的肾蒂放入腹腔,见图1。关闭腹腔。1 号线分层缝合肌肉和皮肤。术后对照组蒸馏水灌胃,模型组腺嘌呤灌胃,模型组大鼠每天上午以加200 mg/(kg·d)剂量的腺嘌呤混悬液灌胃造模,连续28 d。每只动物均可自由获得水和食物。采集大鼠血液、处死后获得肾脏、骨组织保存在-80 ℃冰箱,进行后续实验研究。

图1 左侧单肾切除过程Fig.1 Left side single kidney resection process diagram
1.3.2 生化指标检测测定大鼠的一般指标,每隔7 d 测定并观察大鼠的体重、摄食和饮水量,共持续4 周。测量大鼠生化指标,连续0、2、4、6、8、10 周采全血。麻醉用10% 水合氯醛腹腔注射,从股动脉抽血。全血标本于室温放置2 h或4 ℃过夜。后于2~8℃采用3 000 r/min 离心15 min,取上清分装。并将标本放于-20 ℃或-80 ℃保存。红细胞(RBC)和血红蛋白(Hb)通过血常规分析仪测定。尿素氮(BUN)、肌酐(Cr)、尿酸(UA)、血钙(Ca2+)、血磷(P3+)通过全自动生化分析仪测定。
采用尿素酶-谷氨酸脱氢酶法测定尿素,上样3 µL 样本。采用酶法测定肌酐,上样8 µL。采用酶标检测仪测定尿酸,上样7.5 µL 血清样本。采用终点法测定钙浓度,加入试剂250 µL,试剂盒型号:C057,每份加入2.5 µL 血清样本,反应120 s。采用两点法测定磷浓度,加入试剂300 µL,试剂盒型号:C014,每份加入6 µL 血清样本,反应300 s。测量大鼠肾脏一般指标,10 周处死大鼠,取出肾脏,用生理盐水冲洗,除去淤血及血管、脂肪等非肾脏组织。裸肾用滤纸吸干,用精密电子天平称单肾湿重,计算大鼠单侧肾重/体重的值,肉眼观察肾脏,大小、形态、颜色、质地、包膜、皮质、髓质等。
1.3.3 Hematoxylin-eosin Staining(HE 染色)将组织用4%多聚甲醛溶液固定,石蜡包埋,切片。(1)烤片:将组织片放入64℃恒温箱中烘烤1 h;(2)脱蜡:将玻片放入到二甲苯中Ⅰ(10 min)-二甲苯Ⅱ(10 min);(3)水化:100% 酒精Ⅰ(5 min)-100%酒精Ⅱ(5 min)-95%酒精(5 min)-80%酒精(3 min)-70%酒精(2 min);PBS 冲洗3 次,每次5 min;(4)苏木素复染:将玻片放到苏木素中染色5 min,蒸馏水冲洗,放入到酒精-盐酸溶液中进行分化,分化10~15 s,放入到自来水中返蓝,返蓝至少15 min;(5)伊红染色:将玻片放入到伊红中染色5~10 s,放入到蒸馏水中洗1 次;(6)脱水:95%酒精(5~10 s)-100%酒精Ⅰ(5 min)-100%酒精Ⅱ(5 min);(7)透明:二甲苯Ⅰ(10 min)-二甲苯Ⅱ(10 min);(8)封片:用中性树胶进行封片;(9)拍片:选择中间和四周不少于5 个视野进行拍照和分析。将对照组和模型组大鼠的肾组织用HE 染色,以观查其基本结构,分析病变情况、分辨细胞种类以及炎症细胞浸润情况等。
1.3.4 X 线拍片检测大鼠胫骨标本的生长情况使用X 线检查对照组和腺嘌呤诱导模型组大鼠胫骨标本,观察到对照组骨质内骨小梁排布的比较紧密、规律,骨质的密度正常;模型组骨小梁排布得比较稀疏,甚至出现紊乱或者缺失,骨密度不足。对比其骨小梁变化分析骨密度情况。
1.3.5 免疫组化检测OAT1 表达(1)取材和切片及脱蜡:二甲苯、二甲苯Ⅱ各7 min,4 个梯度乙醇各4 min,冲洗3 min,PBS 冲洗2 次(3 min/次);(2)抗原修复:2 次(8 min/次),自然冷却至室温;(3)灭活:使内源性过氧化物酶失去活性;(4)加一抗∶1∶150 的一抗(阴性对照加PBS),37℃孵育150 min 后,PBS 冲洗;(5)加OAT1 抗体:加二抗并置于37℃烘箱20 min,PBS 冲洗3 次;(6)DAB 显色及封片:避光环境下,滴加现配的DAB 试剂,显色、冲洗、脱水,中性树胶封片。将骨切片染色确认骨质吸收情况,使用图像分析系统计算吸收面积。
1.4 统计学处理
应用SPSS 24.0 进行统计学分析,以均数±标准差()表示计量资料,组间比较采用t检验,采用 Graphpad Prism 5.0 作图,P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠的一般情况
造模后,体重维持不变,而后呈下降趋势。单侧肾重占比模型组与对照组并无明显差别(P=0.077)。对照组则先上升、后下降,后又上升,模型组饮水量呈上升趋势,随后持平,在3~4 周区间范围内呈波动趋势。对照组则随时间上升,模型组饮食量随时间呈下降趋势,见图2。

图2 大鼠的一般情况Fig.2 General situation of rats
2.2 单肾切除+腺嘌呤诱导对大鼠肾组织的影响
2.2.1 大鼠肾组织取材对照组大鼠肾脏红润光滑,其形态、大小正常,模型组大鼠肾脏明显肥大,表面苍白粗糙,见图3。
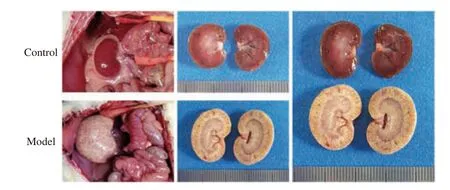
图3 大鼠肾组织取材Fig.3 Rat kidney tissue sampling diagram
2.2.2 大鼠右肾HE 染色结果显微镜下可见对照肾小球、肾小管结构正常,系膜细胞和基质无增生,肾间质无炎性细胞浸润及纤维化;模型组肾间质炎性细胞浸润,使肾小管萎缩、肾小管上皮细胞空泡样变,基底膜增厚、肾间质大量炎性细胞浸润及纤维化,见图4。

图4 大鼠右肾HE 染色Fig.4 HE staining of right kidney in rats
2.3 单肾切除加腺嘌呤诱导对大鼠肾功能的影响
模型组的尿素氮(BUN)、肌酐(Cr)及血钙(Ca2+)、血磷(P3+)较对照组升高(P<0.05),见表1。
表1 不同组间大鼠的肾功能指标比较(,n=6)Tab.1 Comparison of renal function indicators among different groups of rats(,n=6)

表1 不同组间大鼠的肾功能指标比较(,n=6)Tab.1 Comparison of renal function indicators among different groups of rats(,n=6)
与对照组比较,*P<0.05,**P<0.01。
2.4 OAT1 表达对尿酸、钙磷代谢及骨组织的影响
2.4.1 OAT1 表达对尿酸、钙磷代谢的影响与对照组相比,模型组大鼠血清中的尿酸、血磷和血钙升高,差异具有统计学意义(P<0.05),见表2。
表2 不同组间大鼠的尿酸、钙和磷水平(,n=6)Tab.2 Uric acid,calcium,and phosphorus levels in rats of different groups(,n=6)

表2 不同组间大鼠的尿酸、钙和磷水平(,n=6)Tab.2 Uric acid,calcium,and phosphorus levels in rats of different groups(,n=6)
与对照组比较,*P<0.05,**P<0.01。
2.4.2 OAT1 表达对骨组织的影响大鼠胫骨X线拍片检查观察骨生长情况。观察到对照组骨质内骨小梁,排布紧密、规律,骨质的密度正常,而模型组骨小梁排布得比较稀疏,甚至出现紊乱或者缺失,骨密度低于对照组,见图5。

图5 大鼠胫骨X 线拍片Fig.5 X-rays of rat tibia
2.5 OAT1 对骨营养不良的影响
对照组和腺嘌呤诱导模型组大鼠OAT1 的面积。将骨组织中的OAT1 染色,并使用GraphPad Prism 5 计算面积后发现:模型组大鼠骨组织结合OAT1 值低于对照组(P<0.05),见图6。
3 讨论
有机阴离子转运蛋白家族属于溶质载体家族(solute carrier family,SLC22),在肾脏上皮细胞中表达以调节内源性和外源性有机阴离子的排泄和重吸收,包括各种药物及其代谢物[7-9]。OATs 也在血脑屏障、肌肉细胞和成骨细胞中表达,这暗示了OAT 介导的尿毒症毒素转运的各种致病作用[10]。慢性肾衰竭大鼠肾 OAT1 表达减少,并且其分泌负荷减少[11]。有研究指出,一些有机阴离子转运多肽(OATPs)和有机阴离子转运蛋白参与了尿毒症毒素的肾脏清除[12]。且已有研究证明OAT家族中的OAT1 在肾脏中参与尿酸盐的转运过程[13-14]。并发现,在OAT 下降的条件下,慢性肾衰竭的尿酸清除率降低,导致慢性肾衰竭大鼠血清中尿酸含量增高。临床上慢性肾功能衰竭患者体内的尿酸水平可反映患者体内肾功能损伤情况,两者具有明显的相关性,可作为其临床诊断或术后评估的参考依据之一[15-16]。
本研究结果观察到造模后模型组体重、饮水量、饮食量的变化,单肾占比未变。并且,对照组和模型组大鼠的红细胞、血红蛋白水平,尿素氮及肌酐水平显符合腺嘌呤诱导慢性肾功能衰竭预期[17]。大鼠处死后,取肾组织发现模型组大鼠肾脏明显肥大,表面苍白粗糙,而对照组大鼠肾脏红润光滑,其形态、大小也无异常。将肾组织切片染色,显微镜下可见对照肾组织正常,系膜细胞和基质无增生,肾间质无炎性细胞浸润及纤维化;模型组肾间质炎性细胞浸润,使肾小管萎缩、肾小管上皮细胞空泡样变,基底膜增厚、肾间质大量炎性细胞浸润及纤维化。上述结果均表明单肾切除+腺嘌呤灌胃法已成功建立大鼠肾衰竭模型,且与张圆圆等[18]的研究成果相符合。
肾性骨营养不良是指在慢性肾功能衰竭患者中经常观察到的骨形态和代谢的改变,并且由于骨量和质量的恶化导致骨强度受损,致使患者易发生骨折[6,19-21]。本研究通过X 线拍片观察大鼠胫骨生长情况、骨形态分析显示,观察X 线拍片,模型组大鼠骨小梁结构的变化和皮质骨密度降低。确定了慢性肾功能衰竭大鼠有肾性骨营养不良的状况。有研究显示,骨营养不良主要表现在骨重塑(骨保护素、骨钙素、骨桥蛋白)和维生素D 代谢(7-脱氢胆固醇还原酶、Gc-球蛋白、Cyp2r1、Cyp27a1)的基因失调,以及钙和维生素D 稳态的改变[6]。实验数据表明模型组大鼠的钙磷流失高于对照组。维持机体钙磷代谢稳态是肾脏的主要功能之一,慢性肾功能衰竭患者体内的肾功能受损后,机体内的矿物质和骨代谢发生异常可导致肾性骨病[22-23]。因此笔者推测慢性肾功能衰竭大鼠内的钙磷代谢紊乱导致骨营养不良[24]。然而,慢性肾衰竭又通过什么因素导致了骨营养不良?
据报道,在慢性肾功能衰竭中,OAT1、OAT2、Oct1、Oct2、Oatp4C1 的mRNA 表达均下调[25]。并且OATP1B 活性可能在肾衰竭患者中降低,影响其药物代谢清除率及药物转运能力[26]。笔者观察到模型组大鼠骨组织结合OAT1 值低于对照组(P=0.001 8)。这意味着,肾衰竭影响了OAT1 在骨组织中的表达。OAT1 在骨组织中的结合能力下降,会影响骨组织的钙磷结合能力,导致慢性肾衰竭大鼠骨小梁结构的变化和皮质骨密度降低。
综上所述,本实验证明了模型组大鼠骨组织OAT1 表达值远低于对照组,影响钙磷代谢,致慢性肾衰竭大鼠骨小梁结构的变化和皮质骨密度降低。从而加重肾性骨营养不良,该研究进一步探明慢性肾衰竭大鼠OAT1 表达与肾性骨营养不良两者的关系,为临床提供一定的理论依据。

