某肿瘤专科医院伦理委员会初审能力现状分析及提升策略研究〔1〕
吕永强,贾海霞,夏志卿,田学智,王育生,康金秀,李育民,余红梅,米 悦,阎敬华,张振杰,李 媛,杨晓棠*
(1.山西省肿瘤医院,中国医学科学院肿瘤医院山西医院,山西医科大学附属肿瘤医院,山西 太原 030013;2.山西医科大学第二医院,山西 太原 030001;3.山西医科大学,山西 太原 030001)
以人为研究参与者的医学研究是医学发展所必需的,但医学研究必须符合伦理性要求。伦理委员会的职责是通过伦理审查以保证医学研究符合科学性和伦理性的要求,确保受试者的权益、安全和健康,保证受试者参与临床研究的潜在受益与可能遭受的风险在合理范围内[1]。随着临床需求及医药事业的发展,全球药物及器械临床试验项目日益增多,伦理委员会即将面临新的机遇与挑战,确保伦理委员会审查能力的提高,跟上新药与新器械的发展步伐势在必行。为了促进伦理事业的发展,我国坚持全球层面的《赫尔辛基宣言》[2]、国家层面的《涉及人的生命科学和医学研究伦理审查办法》[3]《涉及人的临床研究伦理审查委员会建设指南》《药物临床试验质量管理规范》及科研层面的《肿瘤临床研究受试者知情同意共识》[4]《干细胞临床研究伦理管理和审查的北京地区专家共识》[5]《中药新药多中心临床试验协作伦理审查共识》[6]《北京地区医疗卫生机构重大突发传染病临床研究伦理审查共识》[7]等伦理审查共识。尽管上述伦理审查法律法规在总体层面上规范了伦理委员会组成、审查原则、监督管理等方面的内容,但我国伦理审查起步较晚,各伦理委员会审查能力参差不齐[8]。随着临床研究项目的增多,我们需要了解本伦理委员会的审查能力现状,发现不足之处,提出提高伦理审查能力的策略与措施,以达到提高本伦理委员会审查能力的目的。
1 资料与方法
1.1 研究对象
以山西省肿瘤医院2020年1月1日—2022年12月31日受理的临床试验项目为研究对象。
1.2 资料收集
收集临床试验项目的分期与初审受理日期、会议审查日期、批件日期,计算审查等待耗时(指项目受理到会议审查的等待天数)、审查批准耗时(指伦理审查完成到获得伦理批准函或意见函的等待天数)和受理到批件耗时(指项目受理到获得伦理批准函或意见函的等待天数)。采集项目主审委员审查意见及会议审查意见。每年随机抽取20 份研究项目,由两名无利益冲突的资深伦理委员(工作时间5 年及以上)重复审查项目科学性和伦理性,若两名伦理委员审查意见不一致,邀请第3名伦理委员参与讨论,直到达成一致意见,收集项目重审意见。
1.3 统计学方法
2 结 果
2.1 项目一般情况
山西省肿瘤医院2020年1月1日—2022年12月31日共受理270 项临床试验项目,其中Ⅰ期26 项,Ⅱ期92 项,Ⅲ期141 项,Ⅳ期11 项(见表1),均为纸质版。2020年、2021年、2022年分别有58,85和127项临床试验项,不同年份项目分期构成存在显著差异(χ2=54.06,P<0.001),三年间Ⅰ,Ⅱ期临床试验项目占比逐年增多。2020年复审率高达22.41%(13/58),2021年与2022年复审率分别为8.20%(7/85)和4.70%(6/127)。不同年份复审率比较,差异有统计学意义(χ2=14.59,P=0.001),且有逐年减少趋势(χ2=12.74,P<0.001)。
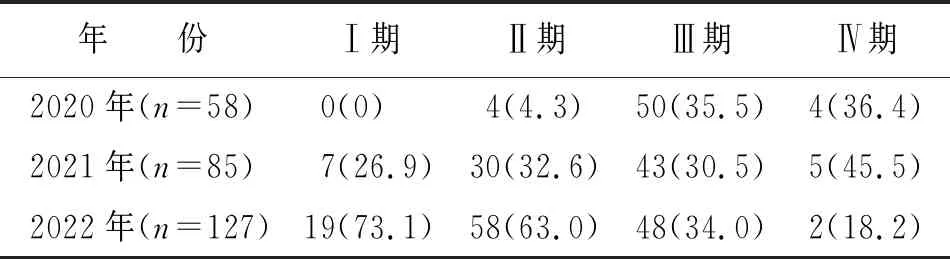
表1 2020年—2022年年临床试验项目情况 单位:项(%)
2.2 审查效率
山西省肿瘤医院2020年、2021年与2022年受理到批件、审查等待及审查批准耗时改善情况见表2。

表2 2020年—2022年审查等待耗时情况 单位:d
2.3 审查质量
2020年、2021年与2022年主审会审意见一致率分别为10.3%,5.9%和3.1%,不同年份间比较,差异无统计学意义(χ2=3.89,P=0.137),提示同期伦理委员审查能力无明显差异。2020年与2021年的整体重审一致率分别为90%和95%,其中2020年2 个项目原始批件意见(同意)与重审意见(修改后同意)不一致,2021年1 个项目原始批件意见(同意)与重审意见(修改后同意)不一致,重审建议修改内容均在此前的跟踪审查中得到修改。2022年重审一致率为100%。尽管从2020年到2022年重审一致率有增高趋势,但差异无统计学意义(χ2=1.92,P=0.766)。
3 讨 论
本研究通过评估临床试验项目的审查效率和审查质量反映伦理委员会的审查能力。作为肿瘤专科医院,2020年伦理审查能力较差,主要原因是受理到批件耗时太长,平均大于30 d,2021年与2022年受理到批件耗时明显缩短,其中2022年95%的项目在受理后30 d内开展伦理审查并出具审查意见,但仍有个别项目受理到批件耗时大于30 d。审查质量分析显示,同期伦理委员审查能力无明显差异,2022年伦理委员审查能力较2020年及2021年有提高趋势,但差异无统计学意义。项目复审率逐年下降,而审查质量无明显变化,考虑与项目撰写质量逐年提高有关。
2023版《涉及人的生命科学和医学研究伦理审查办法》明确表示,医学研究项目应在受理后30 d内完成审查并出具审查意见[9]。尽管本伦理委员会审查效率在逐年提高,但仍有不足,分析主要原因如下:2020年临床试验项目数较少,大约一个季度开展一次伦理会议,以致审查等待耗时平均大于30 d;纸质版临床试验材料处理耗时费力,导致伦理委员不能及时审查项目;临床试验项目撰写质量低可能是引起复审率高与审查耗时长的原因之一;伦理委员会审查能力有待提高是影响伦理审查效率与质量的另一个原因;伦理专职工作人员短缺也影响伦理审查的效率;缺乏伦理互认制度。
伦理审查信息化建设不仅可方便伦理工作人员及时处理与管理项目文件,而且方便伦理申请者提交文件、查阅审查进度及审查结果,已成为伦理发展的必然趋势[10]。对于多中心临床研究,伦理互认可避免重复审查引起的人力、物力及财力的不必要浪费,提高审查效率[11]。为了提高山西省肿瘤医院伦理委员会审查效率与质量,我们将针对本伦理委员会的不足从下面几点加强伦理审查工作:逐年增多的临床研究项目增加了伦理审查会议频数;实现伦理委员会从项目受理到委员审查的电子信息化管理模式;对研究者开展临床试验设计及科学性与伦理性培训,提高研究者临床试验项目撰写及阅读能力;加强伦理培训,提高伦理委员的伦理审查能力;增加伦理专职工作人员,并加强专业伦理培训;制订具有自身特色的伦理互认制度,以提高伦理审查效率。
总之,本伦理委员会处于发展阶段,审查能力虽逐年提高,但仍有一些不足之处需要改进。我们将实行上述提高伦理审查能力的策略与措施,进一步提高伦理审查效率与质量,确保临床研究项目在开展前须经伦理委员会初始审查,且项目获得批准后才可实施,后续还需要对项目进一步跟踪审查,监督研究过程,以保护研究参与者的安全与权益。

