肾小管HIF-1α/miR-23a通路在脓毒血症急性肾损伤中的作用机制
陈思宇 强立娟 朱嘉兴 马世兰 陈占龙
脓毒血症是指由感染引起的全身炎性反应综合征,其发病率很高,可由任何部位的感染引起,能够导致机体多个器官功能障碍,引起患者死亡[1]。脓毒血症急性肾损伤(sepsis associated acute kidney injury,SA-AKI)是脓毒血症最常见的并发症之一,SA-AKI以肾脏排泄功能迅速丧失为主要特征,可严重影响脓毒血症患者预后并增加患者病死率[2]。目前,笔者发现临床上尚缺乏有效预防和治疗SA-AKI的干预措施,因此,探索SA-AKI具体致病机制,明确SA-AKI的重要调节因子,对提高脓毒血症治疗效果、防治SA-AKI具有重要意义。肾小管上皮细胞损伤是SA-AKI的典型病理特征,研究发现,脓毒血症病理生理情况下,缺氧是引起肾小管上皮损伤的重要致病因素[3]。低氧诱导因子(hypoxia inducible factor,HIF)是机体适应缺氧环境机制中的最主要因素,也是脓毒血症引起多器官功能损伤的主要原因之一[4]。在缺氧性肾损伤中,HIF-1α主要表达于肾小管上皮细胞,HIF-1α调控的下游通路在调节能量代谢、线粒体功能、细胞凋亡等多种生理病理过程中发挥重要作用[5]。在SA-AKI的进程中,HIF-1α可以通过调节能量代谢、促进血管再生、降低细胞耗氧来调节肾损伤[6]。但目前笔者发现其在SA-AKI中的详细机制尚未阐明。MicroRNA(miRNA)是一种内源性非编码小RNA,通过调节靶基因表达参与氧化应激、炎性反应、细胞凋亡等过程。近年来一些研究提示miRNA在调节肾脏损伤和修复等方面发挥至关重要的作用[7-8]。研究表明,miR-23a可通过多种途径调节脓毒血症损伤期间的炎性反应和细胞凋亡[9-10]。作为一种调节氧稳态的核转录因子,HIF-1α已被证实可以直接调控多种miRNA的表达[11]。然而,SA-AKI病理生理过程中HIF-1α和miR-23a的作用机制及相互关系尚不完全清楚。因此,本研究体外培养肾小管上皮细胞,探讨肾小管上皮细胞中HIF-1α表达对miR-23a的调控作用,并分析二者参与SA-AKI发生、发展的作用机制,以期为临床防治SA-AKI提供新的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞:人近曲小管上皮细胞(HK-2细胞)购自中国上海科学院细胞库。
1.1.2 主要试剂:DMEM/F12培养基、胎牛血清均购自美国Gibco公司;脂多糖(lipopolysaccharide,LPS)(规格:10 mg)购自上海吉至生化科技公司;HIF-1α小干扰RNA序列(HIF-1α siRNA)及其阴性对照序列(NC siRNA)、miR-23a模拟物(miR-23a mimic)及其阴性对照(miR-NC)、miR-23a抑制剂(anti-miR-23a)及其阴性对照(anti-miR-NC)均购自上海吉玛公司;Lipofectamine 2000试剂购自美国Invitrogen公司;TRIzol试剂、反转录试剂盒、qRT-PCR试剂盒均购自美国Thermo Fisher公司;CCK-8试剂盒、Annexin V-FITC/PI凋亡检测试剂盒、BCA蛋白检测试剂盒均购自上海爱必信生物科技公司;白细胞介素-1β(interleukin 1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA检测试剂盒购自北京鼎国昌盛公司;HIF-1α、核转录因子-κB-p65(nuclear factorκB-p65,NF-κB-p65)、磷酸化NF-κB-p65(p-NF-κB-p65)、NF-κB抑制蛋白α(IκBα)、磷酸化NF-κB抑制蛋白α(p-IκBα)、GAPDH一抗、过氧化物酶标记的山羊抗兔二抗均购自英国abcam公司。
1.1.3 主要仪器:HeracellTM240iTM二氧化碳恒温培养箱、MultiskanTMFC多功能酶标仪、Attune NxT流式细胞仪购自美国Thermo Fisher公司;DYY-4C电泳仪购自南京普阳科学仪器研究所;LEIA-X4荧光定量PCR仪购自济南爱来宝仪器设备公司;iBright凝胶成像系统购自美国Invitrogen公司。
1.2 方法
1.2.1 细胞培养:HK-2细胞采用含10% 胎牛血清的DMEM/F12培养基培养,置于37℃、5%二氧化碳、饱和湿度的细胞培养箱中培养。取对数生长期的HK-2细胞进行后续实验。
1.2.2 SA-AKI细胞模型构建:参考文献[12]方法,将对数生长期的HK-2细胞按照1×105个/mL细胞密度接种于24孔培养板,每孔100 μL,常规培养待细胞密度达到约80%后,加入含5 μg/mL LPS的培养液培养24 h。
1.2.3 细胞分组与转染:LPS处理的HK-2细胞分为LPS组(不进行转染处理)、NC siRNA 组(转染NC siRNA)、HIF-1α siRNA组(转染HIF-1α siRNA)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-23a组(转染anti-miR-23a)、HIF-1α siRNA+miR-NC组(转染HIF-1α siRNA和miR-NC)、HIF-1α siRNA+miR-23a组(转染HIF-1α siRNA和miR-23a mimic),以正常培养、未经任何处理的HK-2细胞作为空白对照组(Control组)。转染过程严格按照Lipofectamine 2000试剂说明书进行,转染后6 h更换培养液,随后继续培养48 h,检测转染效率。
1.2.4 qRT-PCR实验:使用TRIzol试剂提取HK-2细胞中总RNA样本,确定RNA浓度后,通过反转录试剂盒将RNA反转录成cDNA,将合成的cDNA使用qRT-PCR试剂盒进行定量扩增。引物序列:HIF-1α正向引物序列:5’-GAACGTCGAAAAGAAAAGTCTCG-3’,反向引物序列:5’-CCTTATCAAGATGCGAACTCACA-3’;GAPDH正向引物序列:5’-TGTTCGTCATGGGTGTGAAC-3’,反向引物序列:5’-ATGGCATGGACTGTGGTCAT-3’;miR-23a正向引物序列:5’-CAGAGCAAGGGAACAGTAAGTGTGT-3’,反向引物序列:5’-GGAGGTCACTTCCGATCCA-3’;U6正向引物序列:5’-CTCGCTTCGGCAGCACA-3’,反向引物序列:5’-AACGCTTCACGAATTTGCGT-3’。反应条件为:95℃ 2 min,95℃ 30 s,60℃ 30 s,72℃ 30 s,进行40个循环。使用2-ΔΔCt法计算目的基因相对表达量。
1.2.5 细胞活力测定:采用CCK-8法检测。将HK-2细胞以2×105个/孔的密度接种到96孔板上,孵育24 h后,将体积为10 μL的CCK-8溶液添加至每个孔中,37℃继续孵育2 h。用酶标仪检测450 nm波长下每个孔的光密度值(OD值)。
1.2.6 细胞凋亡检测:采用流式细胞术检测。4组HK-2细胞调以1×106mL/孔接种于24孔板,常规培养24 h,加入预冷的磷酸缓冲盐溶液(phosphate buffered solution,PBS)洗涤,用100 μL结合缓冲液重悬细胞,分别加入5 μL Annexin V-FITC溶液和10 μL PI溶液,震荡混匀后,室温避光孵育15 min,加入400 μL结合缓冲液稀释细胞,于1 h内在流式细胞仪上检测细胞凋亡情况。
1.2.7 细胞中炎性因子水平检测:收集4组HK-2细胞培养液,离心留取上清液,采用ELISA法检测细胞中IL-6、IL-1β和TNF-α含量实验操作严格按照试剂盒说明书进行。
1.2.8 Western blot法:使用RIPA裂解缓冲液从HK-2细胞中提取总蛋白,BCA蛋白检测试剂盒用于评估蛋白质样品含量。取等量蛋白质样品上样,通过10 % SDS-PAGE分离,将目标蛋白转移到PVDF膜上,转染蛋白的PVDF膜用5%脱脂牛奶封闭2 h,清洗PVDF膜,与稀释的一抗在4℃共同孵育过夜,一抗包括HIF-1α(1∶800)、NF-κB-p65(1∶1 000)、p-NF-κB-p65(1∶1 000)、IκBα(1∶1 000)、p-IκBα(1∶1 000)和GAPDH(1∶1 000)。洗膜,与二抗(1∶1 000)室温孵育1 h。洗膜,滴加增强的化学发光试剂,在凝胶成像系统中对蛋白条带进行可视化,以GAPDH作为内部对照,利用Image J软件分析蛋白条带灰度值。
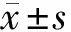
2 结果
2.1 HK-2细胞中HIF-1α表达水平比较 与Control组比较,LPS组HK-2细胞中HIF-1α蛋白和mRNA表达水平均显著升高(P<0.05);与LPS组比较,NC siRNA 组HK-2细胞中HIF-1α蛋白和mRNA表达水平变化差异无统计学意义(P>0.05),HIF-1α siRNA组HK-2细胞中HIF-1α蛋白和mRNA表达水平均显著降低(P<0.05)。见表1,图1。

图1 HK-2细胞中HIF-1α表达

表1 HK-2细胞中HIF-1α表达水平比较
2.2 HK-2细胞中miR-23a表达水平比较 与Control组比较,LPS组HK-2细胞中miR-23a mRNA表达水平显著升高(P<0.05);与LPS组比较,anti-miR-NC组HK-2细胞中miR-23a mRNA表达水平变化差异无统计学意义(P>0.05),anti-miR-23a组HK-2细胞中miR-23a mRNA表达水平显著降低(P<0.05)。与HIF-1α siRNA组比较,HIF-1α siRNA+miR-NC组HK-2细胞中miR-23a mRNA表达水平变化差异无统计学意义(P>0.05),HIF-1α siRNA+miR-23a组HK-2细胞中miR-23a mRNA表达水平显著升高(P<0.05)。见表2。

表2 HK-2细胞中miR-23a表达水平比较
2.3 抑制HIF-1α表达对HK-2细胞活力、细胞凋亡和细胞中炎性因子水平的影响 与Control组比较,LPS组HK-2细胞活力显著降低,细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平均显著升高(P<0.05);与LPS组比较,NC siRNA 组HK-2细胞活力、细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平变化差异均无统计学意义(P>0.05),HIF-1α siRNA组HK-2细胞活力显著升高,细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平均显著降低,差异有统计学意义(P<0.05)。见表3,图2。

图2 抑制HIF-1α表达对HK-2细胞凋亡的影响

表3 抑制HIF-1α表达对HK-2细胞活力、细胞凋亡和细胞中炎性因子水平的影响
2.4 抑制HIF-1α表达对HK-2细胞中miR-23a表达的影响 与Control组比较,LPS组HK-2细胞中的miR-23a mRNA表达水平显著升高,差异有统计学意义(P<0.05);与LPS组比较,NC siRNA 组HK-2细胞中的miR-23a mRNA表达水平变化差异无统计学意义(P>0.05),HIF-1α siRNA组HK-2细胞中的miR-23a mRNA表达水平显著降低,差异有统计学意义(P<0.05)。见表4。

表4 抑制HIF-1α表达对HK-2细胞中miR-23a表达的影响
2.5 抑制miR-23a表达对HK-2细胞活力、细胞凋亡率和细胞中炎性因子水平的影响 与Control组比较,LPS组HK-2细胞活力显著降低,细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平均显著升高(P<0.05);与LPS组比较,anti-miR-NC组HK-2细胞活力、细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平变化差异均无统计学意义(P>0.05),anti-miR-23a组HK-2细胞活力显著升高,细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平均显著降低,差异有统计学意义(P<0.05)。见表5,图3。

图3 抑制miR-23a表达对HK-2细胞中miR-23a表达的影响

表5 抑制miR-23a表达对HK-2细胞活力、细胞凋亡和细胞中炎性因子水平的影响
2.6 抑制HIF-1α表达并过表达miR-23a对HK-2细胞活力、细胞凋亡率和细胞中炎性因子(IL-6、IL-1β、TNF-α)水平的影响 与HIF-1α siRNA组比较,HIF-1α siRNA+miR-NC组的HK-2细胞活力、细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平变化差异均无统计学意义(P>0.05);HIF-1α siRNA+miR-23a组的HK-2细胞活力显著降低,细胞凋亡率、细胞中IL-6、IL-1β和TNF-α水平显著升高,差异均有统计学意义(P<0.05)。见表6,图4。

图4 抑制HIF-1α表达并过表达miR-23a对HK-2细胞凋亡的影响

表6 抑制HIF-1α表达并过表达miR-23a对HK-2细胞活力、细胞凋亡和细胞中炎性因子水平的影响
2.7 8组HK-2细胞NF-κB信号通路蛋白表达水平比较 与Control组比较,LPS组HK-2细胞p-NF-κB-p65/NF-κB-p65、p-IκBα/IκBα比值均显著升高(P<0.05);与LPS组比较,NC siRNA 组和anti-miR-NC组HK-2细胞p-NF-κB-p65/NF-κB-p65、p-IκBα/IκBα比值变化差异均无统计学意义(P>0.05),HIF-1α siRNA组和anti-miR-23a组HK-2细胞p-NF-κB-p65/NF-κB-p65、p-IκBα/IκBα比值均显著降低(P<0.05);与HIF-1α siRNA组比较,HIF-1α siRNA+miR-NC组HK-2细胞p-NF-κB-p65/NF-κB-p65、p-IκBα/IκBα比值变化差异均无统计学意义(P>0.05),HIF-1α siRNA+miR-23a组HK-2细胞p-NF-κB-p65/NF-κB-p65、p-IκBα/IκBα比值均显著升高,差异有统计学意义(P<0.05)。见图5,表7。

图5 8组HK-2细胞NF-κB信号通路蛋白表达水平比较

表7 8组HK-2细胞NF-κB信号通路蛋白表达水平比较
3 讨论
HIF-1α是一种氧调节蛋白,是调节细胞代谢以响应缺氧变化的关键调节因子,在炎症性疾病的发生、进展中发挥作用。当炎症性疾病发生时,炎症导致局部新陈代谢加快,对氧气的需求增加;另一方面,由于血管收缩和血栓形成,组织从血流中获得的氧气受到限制,最终导致炎性缺氧,促使HIF-1α表达变化,HIF-1α在一系列生理和病理过程中起着至关重要的作用[13-14]。越来越多的证据表明,HIF-1α参与AKI的调节。Bondi等[15]研究报道,HIF-1α通过调控核因子红细胞-2相关因子2(NRF2)活性参与缺血性AKI后纤维化。Fu等[16]报道,肾小管细胞中HIF-1α-Bcl-2/腺病毒E1B-19k相关蛋白3(BNIP3)介导的线粒体自噬通过抑制AKI中细胞凋亡和活性氧产生发挥保护作用。本研究旨在探讨HIF-1α在SA-AKI中的作用和潜在机制。研究结果显示,HIF-1α在LPS诱导的HK-2细胞中表达显著上调,抑制HIF-1α表达可增强LPS诱导的HK-2细胞活力,抑制细胞凋亡。此外,HIF-1α的抑制通过降低IL-6、IL-1β和TNF-α炎性细胞因子水平改善LPS诱导的炎性反应。表明HIF-1α可能在SA-AKI进展中发挥促进作用。
miR-23a是miR-23家族的成员。最近研究表明,miR-23家族在炎性反应和肾脏损伤的发展中发挥关键作用[17]。先前的一项研究报道,miR-23a对高葡萄糖诱导肾小管上皮-间充质转化和体外肾纤维化的进展有显著影响[18]。本研究表明,LPS诱导的HK-2细胞中miR-23a表达水平显著升高,抑制miR-23a表达后,LPS诱导的HK-2细胞活力升高,细胞凋亡率以及细胞中IL-6、IL-1β和TNF-α水平均降低。该结果提示miR-23a可能参与SA-AKI发生、发展。此外,本研究结果显示,抑制HIF-1α表达可降低LPS诱导的HK-2细胞中miR-23a水平,同时,miR-23a过表达逆转了抑制HIF-1α表达对LPS诱导的HK-2细胞活力、细胞凋亡以及IL-6、IL-1β、TNF-α等炎性细胞因子水平的调控作用。上述结果表明HIF-1α可能通过调控miR-23a表达在SA-AKI中发挥作用。既往研究表明,HIF-1α参与AKI中多种功能性miRNA的调节[19],并且HIF-1α水平受特定miRNA的调节。本研究结果证实,在SA-AKI中,HIF-1α可能通过调控miR-23a表达发挥作用。HIF-1α/miR-23a途径可能是SA-AKI的有效干预靶点。
NF-κB是一种特征性促炎转录因子,NF-κB信号通路在炎症和免疫反应中发挥关键作用。大量研究表明,NF-κB信号通路参与调节LPS诱导的肾损伤炎性反应的基因表达和脓毒血症的病理生理过程[20-22]。NF-κB的激活受IκB激酶(IKKs)和抑制蛋白IκB调控,可被LPS、促炎细胞因子等多种刺激激活。在脓毒血症小鼠的肾脏组织中,通过检测NF-κB-p65易位和相关蛋白的磷酸化程度,可以观察到NF-κB信号的激活[23]。近年来有证据显示,AKI中HIF-1α可以调节NF-κB信号通路,同时NF-κB参与了AKI中HIF-1α表达的增加[24-25]。但SA-AKI中HIF-1α调控NF-κB信号通路激活的具体机制尚未完全阐明。Fan等[26]报道,miR-23a可能通过活化NF-κB信号通路参与细胞生物学过程。Xu等[27]报道,miR-23a-3p通过靶向脓毒血症中的NF-κB信号传导来改善AKI。本研究结果显示,LPS诱导的HK-2细胞中NF-κB-p65和IκBα磷酸化水平升高,抑制HIF-1α和miR-23a表达均明显降低LPS诱导的HK-2细胞中NF-κB-p65和IκBα磷酸化水平;此外,miR-23a过表达减弱了抑制HIF-1α表达降低LPS诱导的HK-2细胞中NF-κB-p65和IκBα磷酸化水平的作用。该结果表明,肾小管HIF-1α可能通过调控miR-23a表达,进而调节NF-κB信号通路活化,促进SA-AKI的发生。
综上所述,抑制肾小管HIF-1α表达能够增强LPS诱导的肾小管上皮细胞活力、抑制细胞凋亡和细胞中炎性反应,其作用机制可能与抑制miR-23a表达,从而抑制NF-κB信号通路激活有关。本研究结果证实,HIF-1α和miR-23a参与SA-AKI发生、发展,HIF-1α/miR-23a途径可能是SA-AKI的潜在治疗靶点。但本研究仅从体外细胞层面开展了实验探索,后期仍需在动物实验中进一步验证。

