桦木酸通过Wnt/β-catenin信号通路调控瘢痕疙瘩成纤维细胞增殖、侵袭和胶原合成
唐悦玲 李心怡
瘢痕疙瘩是皮肤伤口愈合异常形成的瘢痕组织,病变超出损伤部位范围,持续生长且无自愈倾向[1]。瘢痕疙瘩不仅引起疼痛和瘙痒等不适反应,而且影响正常身体功能,同时也影响美观,给患者的生活质量和身心健康带来极大的损害[2]。大量细胞参与瘢痕疙瘩的形成过程,其中成纤维细胞处于核心位置[3]。成纤维细胞功能异常活化,导致细胞异常增殖和胶原过度合成,从而导致瘢痕不断生长和扩大,形成瘢痕疙瘩,具有类似肿瘤细胞的特征,因此瘢痕疙瘩又被成为皮肤良性肿瘤[3]。目前,瘢痕疙瘩的临床治疗手段多种多样,但是治疗效果却不令人满意,并且治疗后复发率极高[4]。近年来,中药治疗瘢痕疙瘩取得了一定的进展,受到了广泛的关注和研究[5]。特别是鉴定中草药中对瘢痕疙瘩成纤维细胞增殖、侵袭和胶原合成具有调控作用的活性单体成分,是目前研究的热点,有望为瘢痕疙瘩的治疗提供新的突破口。Wnt/β-catenin信号通路是目前研究比较广泛的信号通路,参与调控细胞增殖、分化、凋亡和迁移等细胞生物学过程,其异常调控和疾病的发生密切相关[6]。β-catenin在该通路的信号传导过程中处于中心位置。当没有Wnt信号时,β-catenin在细胞质内被降解,维持在极低的水平。当Wnt信号激活时,β-catenin的降解复合体解散,导致β-catenin在细胞质内积累,随后进入细胞核,与T细胞因子/淋巴增强因子(T-cell factor/Lymphoid enhancing factor,TCF/LEF)转录因子结合,调控Wnt靶基因表达,产生生物学效应[7]。研究表明,Wnt/β-catenin信号通路的过度激活和瘢痕疙瘩的形成密切相关[8]。研究发现,β-catenin及其下游靶分子在瘢痕疙瘩和分离的成纤维细胞中都呈高表达状态[9]。抑制Wnt/β-catenin信号通路可以有效抑制瘢痕疙瘩成纤维细胞的增殖、迁移和胶原合成[10-11]。因此,鉴定具有抑制Wnt/β-catenin信号通路活性的中药单体成分,对于治疗瘢痕疙瘩具有重要的参考价值。桦木酸(betulinic acid,BA)是一种可从多种草本植物中提取出的羽扇豆烷型五环三萜类活性物质,其在桦树皮中的含量最高,具有抗肿瘤、抗菌、抗炎和抗纤维化等广泛的药理作用[12-13]。近年来,BA的生物活性及其治疗疾病的潜在价值受到国内外学者的广泛关注。本研究探讨BA对瘢痕疙瘩成纤维细胞增殖、侵袭和胶原合成的调控作用,并探讨其可能的分子作用机制,为BA应用于瘢痕疙瘩的治疗提供初步的理论依据。
1 材料与方法
1.1 材料与试剂 BA(分析标准品,HPLC≥98%)购自上海蓝木化工有限公司;细胞培养基、胎牛血清和青霉素-链霉素溶液购自武汉普诺赛生命科技有限公司;CCK-8试剂盒、EdU试剂盒、TOPFlash报告基因质粒、Lipo8000转染试剂和萤光素酶报告基因检测试剂盒购自上海碧云天生物科技有限公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自上海翌圣生物科技股份有限公司;Trizol总RNA提取试剂购自美国Thermo Fisher Scientific公司;cDNA合成试剂盒PrimeScript RT reagent Kit和定量PCR试剂盒TB Green Fast qPCR Mix购自大连宝生物工程有限公司;蛋白提取试剂盒、BCA蛋白定量试剂盒和ECL发光试剂盒购自北京全式金生物技术有限公司;兔抗人Col Ⅰ抗体、β-catenin抗体、c-myc抗体、cyclin D1抗体和GAPDH抗体自武汉三鹰生物技术有限公司;Transwell小室购自美国Corning公司。
1.2 方法
1.2.1 成纤维细胞分离和培养:在无菌条件下,将手术切除的新鲜瘢痕疙瘩组织转移到实验室。在超净工作台内,将组织放入培养皿中,加入含有1%双抗的0.9%氯化钠溶液,漂洗,去除皮下组织。将瘢痕疙瘩剪成0.5~1 mm3的碎块,用镊子将小块接种于培养瓶中,滴加少量胎牛血清,以便组织块贴壁。将培养瓶放入培养箱内,瓶底朝上。孵育5 h,待组织块完全贴壁,加入2 mL含10%胎牛血清和1%双抗的DMEM培养基,继续培养,每3天更换1次培养液。待组织块周围爬满细胞时,去除组织块和培养液,PBS洗涤2次。加入胰酶消化液,孵育3 min。显微镜下观察,待细胞收缩,间隙变大时,加入2 mL含10%胎牛血清和1%双抗的DMEM培养基,终止消化。采用移液枪反复吹打,使细胞悬浮。将细胞悬液收集到离心管,离心收集细胞沉淀,再次加入含10%胎牛血清和1%双抗的DMEM培养基,转移到新的培养瓶中继续培养。每2天更换培养基1次,待细胞融合度到达80%以上,进行传代。取3~4代细胞,进行后续实验。
1.2.2 CCK-8实验:将瘢痕疙瘩成纤维细胞常规消化,制成细胞悬液,按照3 × 103个/孔的密度,细胞接种到96孔板,每组设5个复孔。过夜孵育,待细胞贴壁后,加入不同浓度的BA处理,继续孵育24 h。取出培养板,吸去培养液,向每孔加入10 μL的CCK-8试剂,置于培养箱中,继续孵育。培养2 h后,取出培养板,置于酶标仪上。调节酶标仪,于450 nm波长处,测定细胞溶液在的吸光度。
1.2.3 细胞分组:将瘢痕疙瘩成纤维细胞分为3组:空白对照组、二甲基亚砜(dimethyl sulfoxide,DMSO)处理组(溶剂对照组)和BA处理组。加药后,充分混匀,置于细胞培养箱中孵育24 h,然后进行相关检测。
1.2.4 EdU实验:将瘢痕疙瘩成纤维细胞接种到含盖玻片的6孔培养板中,过夜培养,待细胞恢复到正常状态,加入BA处理。培养24 h后,将37℃预热的EdU工作液,等体积的加入到6孔板中,使终浓度达到10 μmol/L。加入EdU后,继续孵育2 h。倒掉培养液,加入1 mL 的4%的多聚甲醛,室温固定15 min。倒掉固定液,PBS洗涤细胞3次。加入1 mL 的通透液,室温孵育15 min。倒掉通透液,PBS洗涤细胞3次,加入0.5 mL的EdU反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品,室温避光孵育30 min。倒掉反应液,PBS洗涤3次,加入1 mL的DAPI溶液复染,室温避光孵育10 min。PBS洗涤3次,采用抗荧光淬灭封片液,进行封片,随后在荧光显微镜下观察和采集图像。
1.2.5 流式细胞术:采用胰酶消化待检测的细胞,离心收集细胞沉淀,预冷的PBS洗涤2次。收集1×105细胞,加入100 μL 1 × Binding Buffer重悬细胞。向细胞悬液中加入5 μL的 Annexin V-FITC和10 μL的PI 试剂,室温避光孵育15 min。然后,加入400 μL 1 × Binding Buffer,轻摇混匀,立即采用流式细胞仪检测。
1.2.6 Transwell实验:采用胰酶消化瘢痕疙瘩成纤维细胞,重悬于不含血清的培养基中,制成浓度为5 × 104个/mL的细胞悬液。将Transwell上室提前铺好基质胶。待干燥后,将200 μL瘢痕疙瘩成纤维细胞悬液接种到上室,并添加BA。向下室注入500 μL含20%胎牛血清的培养液。将Transwell系统置于培养箱中,孵育24 h。取出小室,倒掉剩余液体,用棉棒擦除残留细胞。加入4%多聚甲醛溶液固定30 min;PBS洗涤,加入结晶紫染液,染色10 min。流水缓缓冲洗,去除染色液。待小室风干后,置于显微镜下观察和采集图像。
1.2.7 Western blot:倒掉培养液,预冷PBS洗涤细胞,加入细胞裂解液,剧烈震荡,冰上孵育30 min。4℃离心,收集上清,采用BCA试剂盒测定总蛋白浓度。向蛋白样品中加入上样缓冲液,沸水煮沸5 min,使蛋白变性。按30 μg/孔的上样量,将蛋白样品加入道浓缩胶中,进行电泳。待电泳结束,取出分离胶,将滤纸、凝胶和PVDF膜制成“三明治转模结构”,进行转模。转模完成后,取出PVDF膜,放入封闭液中,室温孵育1 h。然后,将膜与一抗稀释液孵育,4℃过夜。TBST洗膜,将膜与二抗稀释液孵育,室温孵育1 h。将发光液A和B混匀,均匀涂抹在膜上。将膜放入凝胶成像仪中,进行曝光和图像采集。
因此,中心日间手术开展前,筹备小组认真研究和借鉴欧美的日间手术流程和指南,并实地考察四川大学华西医院等国内率先开展日间手术的医院,再结合中心儿科专科手术、妇科手术特点等,最终确定采用,以麻醉医生为主导的围术期管理模式,对日间手术中心进行管理。
1.2.8 荧光素酶报告基因实验:将瘢痕疙瘩成纤维细胞接种到24孔板,过夜孵育培养,待细胞融合度达到80%左右,采用Lipo8000转染试剂将TOPFlash报告基因质粒转染至细胞内。细胞转染48 h后,加入BA处理,继续培养24 h。每孔加入萤火虫萤光素酶检测试剂200 μL,室温孵育10 min。采用多功能酶标仪检测荧光素酶活性。
1.2.9 RT-qPCR:根据Trizol试剂抽提步骤,提取细胞总RNA。取1 μg总RNA为模板,加入,加入逆转录酶溶液、缓冲液和反转录引物配,补加无RNase的水,配置成20 μL反应体系。反转录反应条件设置为37℃,15 min;85℃,5 s。取2 μL逆转录反应产物,加入TB Green Fast qPCR Mix和正反扩增引物,补加无菌水,配置成25 μL反应体系。PCR反应条件设置为95℃,30 min;95℃,5 s 和60℃,10 s(40个循环)。以GADPH为内参基因,采用2-ΔΔCt公式计算析mRNA相对表达水平。
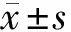
2 结果
2.1 BA处理抑制瘢痕疙瘩成纤维细胞的生长活性 BA为白色结晶,分子式为C30H48O3,相对分子质量为456.7。采用CCK-8实验检测了不同浓度BA对瘢痕疙瘩成纤维细胞的生长活性的影响。与空白对照组相比,不同浓度BA处理后,瘢痕疙瘩成纤维细胞的生长活性降低,差异有统计学意义(P<0.05和P<0.01)。在30 μmol/L BA处理后,瘢痕疙瘩成纤维细胞的生长活性大约减少1/2,后续实验将采用30 μmol/L BA处理细胞进行研究。见图1,表1。

表1 BA对瘢痕疙瘩成纤维细胞生长活性的影响 %,

图1 BA化学结构式
2.2 BA处理抑制瘢痕疙瘩成纤维细胞的增殖 采用EdU实验检测BA对瘢痕疙瘩成纤维细胞的增殖的影响。与空白对照组和DMSO处理组相比,BA处理组EdU阳性细胞的比例下降,差异有统计学意义(P<0.01)。见表2,图2。

表2 3组细胞增值率比较 %,

图2 EdU实验检测BA对瘢痕疙瘩成纤维细胞增殖的影响(EdU染色×200)
2.3 BA处理促进瘢痕疙瘩成纤维细胞的凋亡 采用Annexin V-FITC/PI对瘢痕疙瘩成纤维细胞染色,然后采用流式细胞术分析BA对瘢痕疙瘩成纤维细胞凋亡的影响。与空白对照组和DMSO处理组相比,BA处理组凋亡细胞比例上升,差异有统计学意义(P<0.01。见图3,表3。

表3 3组细胞凋亡率比较 %,

图3 流式细胞术检测BA对瘢痕疙瘩成纤维细胞凋亡的影响
2.4 BA处理抑制瘢痕疙瘩成纤维细胞的侵袭 采用Transwell实验检测BA对瘢痕疙瘩成纤维细胞侵袭的影响。与空白对照组和DMSO处理组相比,BA处理组细胞侵袭数目降低,差异有统计学意义(P<0.01)。见图4,表4。

表4 3组细胞侵袭能力比较 个,

图4 Transwell实验检测BA对瘢痕疙瘩成纤维细胞侵袭能力的影响染色(结晶紫染色×200)
2.5 BA处理抑制瘢痕疙瘩成纤维细胞的胶原合成 采用Western blot检测BA对瘢痕疙瘩成纤维细胞的胶原合成的影响。与空白对照组和DMSO处理组相比,BA处理组Col Ⅰ蛋白表达量减少,差异有统计学意义(P<0.01)。见图5,表5。

表5 3组细胞ColⅠ蛋白表达相对定量分析

图5 Western blot检测BA对瘢痕疙瘩成纤维细胞胶原合成的影响
2.6 BA处理下调瘢痕疙瘩成纤维细胞中的Wnt/β-catenin信号通路 采用荧光素酶报告基因实验评估BA对瘢痕疙瘩成纤维细胞中的Wnt/β-catenin信号通路的影响。与空白对照组和DMSO处理组相比,BA处理组Wnt/β-catenin信号通路的活性降低,差异有统计学意义(P<0.01)。Western blot检测结果显示,与空白对照组和DMSO处理组相比,BA处理组β-catenin蛋白量减少,差异有统计学意义(P<0.01)。采用RT-qPCR检测BA对Wnt/β-catenin靶基因c-myc和cyclin D1表达的影响。与空白对照组和DMSO处理组相比,BA处理组c-myc和cyclin D1的mRNA表达水平下降,差异有统计学意义(P<0.01)。Western blot结果进一步证实,与空白对照组和DMSO处理组相比,BA处理组c-myc和cyclin D1的蛋白量减少,差异有统计学意义(P<0.01)。见图6、7,表6~9。

表6 BA对Wnt/β-catenin信号通路的影响 RLU × 107,

表7 3组细胞β-catenin蛋白表达相对定量分析

表8 RT-qPCR检测BA对c-myc和cyclin D1 mRNA表达的影响

表9 3组细胞c-myc和cyclin D1 蛋白表达相对定量分析

图6 Western blot检测BA对β-catenin蛋白表达的影响

图7 Western blot 检测BA对c-myc和 cyclin D1蛋白表达的影响
3 讨论
中药治疗瘢痕疙瘩历史悠久,疗效显著,越来越受到重视,从中药中鉴定疗效确切、不良反应少的单体活性化合物,是目前的研究的热点,有望为瘢痕疙瘩的治疗提供新的突破口。BA具有广泛的药理活性,本研究检测了BA对瘢痕疙瘩成纤维细胞生物学功能的影响,初步探讨BA治疗瘢痕疙瘩的潜在价值。本研究发现,BA可有效抑制瘢痕疙瘩成纤维细胞的生长、增殖、迁移和胶原合成,而促进细胞凋亡。进一步的分子机制研究表明,BA可能通过下调Wnt/β-catenin信号通路在瘢痕疙瘩成纤维细胞中发挥作用。
研究表明,BA具有显著的抗肿瘤活性,可抑制肿瘤细胞的生长、增殖、迁移和侵袭,并且诱导肿瘤细胞凋亡[14-17]。瘢痕疙瘩被认为是一种良性肿瘤,其中成纤维细胞的生物学功能异常活化,具有类似肿瘤细胞的特征。目前,关于BA是否对瘢痕疙瘩成纤维细胞的生物学功能具有调控作用,尚未见报道。因此,本研究首次对BA在瘢痕疙瘩成纤维细胞中作用进行了探讨。研究发现,BA可以显著抑制瘢痕疙瘩成纤维细胞的生长活性。进一步的检测实验表明,BA可以有效降低制瘢痕疙瘩成纤维细胞的增殖、侵袭和胶原合成,而促进细胞发生凋亡。这些结果表明,BA具有逆转瘢痕疙瘩成纤维细胞异常生物学功能的作用,可能对瘢痕的形成和生长具有抑制作用,可作为治疗瘢痕疙瘩的潜在药物。
BA具有较强的抗纤维化作用,可以很好的抑制心、肝、肺和肾等器官的纤维化[18-21]。据报道,BA可以抑制肝星状细胞向成纤维细胞转化,抑制细胞增殖、迁移和胶原合成,从而减轻肝纤维化的进展[22]。BA还可以抑制肺成纤维细胞中胶原合成,从而延缓肺纤维化的进展[20]。本研究表明,BA对成纤维细胞的生长、增殖、凋亡、侵袭和胶原合成等生物学功能具有显著的调控作用,进一步证实了BA的抗纤维化作用,也拓展了BA对瘢痕疙瘩成纤维细胞的调控作用。本研究为BA的抗纤维化活性,提供了进一步的理论依据。
Wnt/β-catenin信号通路在瘢痕疙瘩的形成过程中发挥关键作用[8]。研究表明,Wnt/β-catenin信号通路相关分子,包括β-catenin和下游靶基因在瘢痕疙瘩及分离的成纤维细胞中,都成高表达状态[9]。抑制Wnt/β-catenin信号通路可以有效抑制瘢痕疙瘩成纤维细胞的增殖、迁移和胶原合成[10-11]。已有研究报道发现,BA具有抑制Wnt/β-catenin信号通路的活性。BA处理肿瘤细胞可以下调β-catenin和c-myc的表达,从而发挥抑癌作用[23]。Li等[20]报道,BA可阻断Wnt配体和膜受体的结合,从而下调β-catenin和下游靶基因的表达,抑制Wnt/β-catenin信号通路的信号传导过程。这些研究表明,BA对Wnt/β-catenin信号通路具有抑制活性。鉴于Wnt/β-catenin信号通路在瘢痕疙瘩的形成过程中发挥关键作用,本研究检测了BA是否影响瘢痕疙瘩成纤维细胞中Wnt/β-catenin信号通路传导过程。通过荧光素酶报告基因实验结果发现,BA处理可有效抑制瘢痕疙瘩成纤维细胞中Wnt/β-catenin信号通路的活性。进一步检测发现,β-catenin以及下游靶基因c-myc和cyclin D1的表达水平在BA处理的瘢痕疙瘩成纤维细胞中都显著降低。这些结果表明,BA可以下调瘢痕疙瘩成纤维细胞中的Wnt/β-catenin信号通路。
综上所述,BA具有抑制瘢痕疙瘩成纤维细胞增殖、侵袭和胶原合成的活性,其分子作用机制可能与负向调控Wnt/β-catenin信号通路相关。鉴于成纤维细胞的异常活化是瘢痕疙瘩形成和发展的关键,因此BA具有治疗瘢痕疙瘩的潜在价值。

